Sammanfattat
Nociceptiv och neurogen smärta blir ibland långvarig.
Smärtsensationer kan spridas längs med ena kroppshalvan, men även till den andra kroppshalvan.
Långvarig smärta och smärtspridning kan påverkas av kroppens egna signaleringssystem.
En hypotes är att långvarig smärta och smärtspridning induceras och underhålls genom aktivering av nervsystemets gliaceller, astrocyter och mikroglia.
Gliacellerna kan vara målceller för behandling av långvarig smärta och smärtspridning.
Det finns olika typer av smärta. Den akuta fysiologiska smärtan utgör ett varningssystem. Nociceptiv smärta är en följd av en vävnadsskada, ofta med en inflammatorisk komponent. Neurogen eller neuropatisk smärta utgår från en nerv-skada eller sjukdom. Smärtan kvarstår ibland efter att den ursprungliga skadan läkt och kan övergå i långvarig smärta. Signalvägar finns således för underhåll och även spridning av smärtupplevelsen.
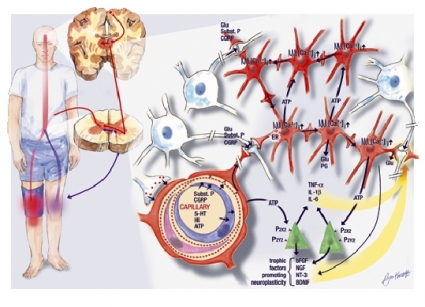
Under senare år har hållpunkter framkommit för att aktive-rade astrocyter och mikrogliaceller kan vara generatorer för underhåll av smärta. Vid skada frisätts bl a substans P, calcitonin gene related peptide (CGRP), 5-HT, histamin och ATP, dels från neuron, både centralt och perifert, dels från bindvävsceller och blodceller. Dessa substanser påverkar blod– hjärnbarriären både från blodsidan och från nervsystemet. På kärlsidan sker en permeabilitetsökning mellan endotelcellerna, och dessa celler frisätter substanser som påverkar astrocyternas ändfötter, som ligger an mot kärlen. Det sker volymförändringar i dessa ändfötter och i astrocyternas cellkroppar.
Astrocyterna, som är kopplade med varandra i gap junc-tions och bildar nätverk, svarar med intracellulära Ca2+- ökningar, vilka sprider sig i astrocytnätverken i form av Ca2+-oscillationer/vågor. Astrocyterna frisätter ATP som stimulerar närliggande astrocytnätverk och omkringliggande mikro-gliaceller samt monocyter som har vandrat över den skadade blod–hjärnbarriären. Mikroglian frisätter cytokiner, framför allt TNF-(alfa), IL-1(beta) och IL-6, samt trofiska faktorer. Cellulära underlag skapas för underhåll och spridning av smärtimpulser. En hypotes är att de uppkomna Ca2+-vågorna tillsammans med frisatta cytokiner och tillväxtfaktorer skapar nya synapser och därigenom bildar nya neuronala kontakter, vilket skulle kunna ge förutsättningar för underhåll och spridning av smärtupplevelse med astrocytnätverken som »brygga«. Om denna hypotes är riktig kan man fråga sig om Ca2+-vågorna, bildningen av cytokiner och tillväxtfaktorer samt cellvolymförändringar kan modifieras av kroppsegna opioider eller nikotin.
Smärta
Akut smärta är anpassningsbar och kan dämpas av kropps-egna substanser, exempelvis endogena opioider. Nociceptiv smärta relaterar man ofta till en vävnadsskada, vilket medför ökad aktivitet i sensoriska impulser i smärtkänsliga system. Denna smärta är inte anpassningsbar [1]. Perifert, där skadan sker, finns smärtreceptorer vilka är sensoriska receptorer som gör att man upplever smärta. När en skada uppstår leds smärtsignalen i långsamma omyeliniserade C-fibrer och snabba myeliniserade A(delta)-fibrer via pseudounipolära nervceller i dorsalrotsganglierna och vidare till bakhornen i ryggmärgen [2]. De presynaptiska terminalerna frisätter neurotransmittorer, vilka aktiverar postsynaptiska receptorer på interneuron, som i sin tur förmedlar impulsen till motorneuron i framhornet. »Smärtimpulsen« förmedlas via efferenta motoraxon ut till periferin igen. Från interneuronen i bakhornet korsar axon över till andra sidan i ryggmärgen, och information förmedlas till högre hjärncentra. Information från C-fibrerna kopplar om på hjärnstamsnivå, och information från A(delta)-fibrerna kopplar om till nytt neuron på talamusnivå. Informationen förs sedan vidare till parietalloben för identifiering [3, 4].
Runt de presynaptiska terminalerna i ryggmärgens bakhorn finns gliaceller, astrocyter och mikroglia. Vid stimulering av smärtbanorna aktiveras också gliacellerna av »smärt-transmittorer« såsom substans P, CGRP, glutamat och ATP. Från de presynaptiska terminalerna frisätts en ökad mängd av dessa. De postsynaptiska neuronen depolariseras; det sker ett inflöde av Ca2+ och kväveoxidsystemet aktiveras, vilket leder till ytterligare frisättning av glutamat, substans P och CGRP presynaptiskt. De postsynaptiska neuronen blir över-aktiva, och astrocyterna och mikroglian i området aktiveras (Figur 1) [5]. En kvarstående aktivering av smärtbanor resulterar både i en neuroinflammation och i en neuroimmun aktivering [6]. Vid neuroinflammationen sker en infiltration av immunceller till det skadade området som svar på skadan. Vid den neuroimmuna aktiveringen sker en uppreglering av cytokiner, kemokiner och adhesionsmolekyler som bl a kontrolleras av transkriptionsfaktorn NF-(kappa)B. NF-(kappa)B reglerar också vandringen av substanser över blod–hjärnbarriären. Dessa impulser ökar frisättningen av peptider såsom substans P och CGRP, vilket i sin tur ökar blodflödet och den vaskulära permeabiliteten.
Vid inflammatorisk smärta förändras tight junction-permeabiliteten mellan endotelcellerna i kapillärerna. IL-1(beta) minskar occludinkoncentrationen och ökar permeabiliteten. TNF-(alfa), histamin och interferon-(gamma) förändrar också permeabiliteten [7]. Det finns ett flöde av metaboliter, joner och andra substanser mellan astrocyterna och endotelcellerna, som är viktiga för blod–hjärnbarriärpermeabiliteten. Kända molekyler som bildas och frisätts av astrocyterna är transforming growth factor-beta (TGF-(beta)), glial cell line-derived neuro- trophic factor (GDNF) och basic fibroblast growth factor (bFGF). Kända molekyler som syntetiseras och frisätts av endotelcellerna är leukaemia inhibitory factor (LIF) [8].
Astrocyters och mikroglias reaktion på nervcellsaktivitet
Astrocyterna har ett strategiskt läge mellan blodkärlen och nervcellerna. De är stjärnformade celler med långa utskott som sträcker sig i alla riktningar från cellkroppen. Utskotten är sammankopplade i stora astrocytnätverk. En del av astrocyternas utskott kontaktar kapillärernas yta med sina ändfötter och bildar tillsammans med endotelcellerna blod–hjärnbarriären. Kommunikationen mellan astrocyter och nervceller sker via det extracellulära rummet, vilket är förhållandevis litet i nervsystemet. Astrocyterna uttrycker receptorer för flertalet kända transmittorer och har både spännings- och receptorreglerade jonkanaler [9]. Genom aktiva upptags- och frisättningssystem för olika joner, transmittorer och vatten kontrollerar astrocyterna den extracellulära miljön i hjärnan. Genom astrocytnätverken möjliggörs intercellulär kommunikation och överföring av neuroaktiva substanser [10].
När astrocyterna aktiveras förändras deras morfologi. Cellerna förändras i storlek genom att de svullnar [11] och ökar sin GFAP(glial fibrillary acidic protein)-mängd, ett glialt surt protein som finns i astrocyternas intermediärfilament. Genom den ökade glutamatfrisättningen från neuronen aktiveras astrocytnätverken genom en förhöjd intracellulär Ca2+-koncentration. De ökar bl a sin frisättning av glutamat och prostaglandiner samt av ATP [12-14]. Den förhöjda ATP-frisättningen leder till stimulering och aktivitet i närliggande astrocytnätverk [15]. Mikrogliacellerna är normalt små, runda celler med korta utskott. När de aktiveras drar de ihop sina utskott och cellerna förstoras. Under patologiska förhållanden får de ett amöbaliknande utseende, prolifererar och vandrar till det skadade området. De uppvisar fagocytos och producerar och frisätter proinflammatoriska cytokiner som TNF-(alfa), IL-1(beta) och IL-6 [16, 17].
Mekanismer bakom smärtans spridning och underhåll
Man känner till att efter en perifer nervskada kan man känna av eller uppleva smärta, förutom från det skadade området också längs med kroppshalvans riktning, ipsilaterala sidan. Men man kan också uppleva smärta i motsatt kroppshalva, det vill säga på den kontralaterala sidan. Dessa effekter är kvalitativt lika men mindre uttalade. Vi vet inget om de mekanismer som orsakar denna smärtupplevelse eller obehag, men man vet att fenomenet existerar och kan uppstå vid långvariga smärttillstånd [18]. Fenomenet visar att det finns signaleringssystem som förbinder de båda kroppshalvorna med varandra, och man har kallat fenomenet »mirror-image pain« [19, 20]. Signaleringssystemen har förmodligen förbindelser, bl a via kommissursystemet på ryggmärgsnivå, där signaleringen via interneuronen medieras med hjälp av olika tillväxtfaktorer, t ex brain-derived neurotrophic factor (BDNF) och neurotrofin-3 (NT3). Vid en perifer inflammation ökar BDNF i dorsalrotsneuronen [21]. Förmodligen finns också förbindelser på både talamisk nivå och hjärnbarksnivå. De proinflammatoriska cytokinerna TNF-(alfa), IL-1(beta) och IL-6 tycks ha en nyckelfunktion vid detta fenomen [18].
Att gliacellerna kan vara involverade i smärtspridning och smärtunderhåll har diskuterats av två orsaker: dels att pro- inflammatoriska cytokiner bildas av gliaceller, framför allt mikrogliacellerna, frisätts och transporteras på ett parakrint sätt till målcellen som sedan kan orsaka en överaktivitet hos de smärtledande neuronen [5], dels att astrocyterna är organiserade i nätverk, ihopkopplade via gap junctions, och genom elektrisk signalering kan sprida Ca2+-signaler i form av oscillationer eller vågrörelser genom nätverken med en hastighet av Å 20 (my)m/s [13, 22]. Astrocyterna kan under dessa förhållanden frisätta substanser, t ex glutamat och prostaglandiner, som kan leda till upplevelse av smärta [12, 14]. Om denna spridning och förmedling av substanser i astrocytnätverken kan nå den kontralaterala sidan skulle man kunna för-vänta sig att frisatta proinflammatoriska cytokiner, glutamat, kväveoxid och andra ämnen ger upphov till spridning av smärta. Det har också visats att om man hämmar signaleringen via astrocytnätverken så upphör eller minskar smärtan [23].
Kroppsegna opioid- och nikotinsystem
Kroppens endogena opioidsystem kan aktiveras genom akupunktur, antingen med hjälp av nålar eller genom elektrisk stimulering där muskelafferenter, A(beta)- och A(delta)- men även C-fibrer, aktiveras. Endogena opioidpeptider som frisätts vid akupunktur är framför allt (beta)-endorfin, som stimulerar särskilt (my)-receptorer men också (delta)-receptorer. Vid smärta har även frisättning av enkefalin, som också aktiverar (my)- och (delta)-receptorerna, endomorfin, som aktiverar (my)-receptorerna, samt dynorfin, som aktiverar (kappa)-receptorerna, betydelse [24]. Vid låg frekvens, 2 Hz, frisätts opioider som stimulerar m-receptorerna, och vid hög frekvens, 100 Hz, frisätts opioider som stimulerar (kappa)-receptorerna [25]. Opioiderna syntetiseras i olika neuron i CNS, frisätts från dessa och transporteras över blod– hjärnbarriären [26]. Vid kronisk huvudvärk ökar koncentrationen av de proinflammatoriska cytokinerna TNF-(alfa), IL-1(beta) och IL-6 i mononukleära blodceller, medan efter akupunktur sjunker koncentrationen till normal nivå [27]. Det är känt att kolecystokinin minskar opioidernas smärtstillande effekt och att morfin får en bättre smärtstimulerande effekt hos patienter tillsammans med antagonister mot kolecystokinin [28].
Rökare har en högre smärttröskel än icke-rökare, och det är nikotinet i tobaken som ligger bakom detta [29]. Nikotin-acetylkolinreceptorer består av en familj ligandkopplade jonkanaler, där man hittills har identifierat 16 olika subenheter med olika strukturella och farmakologiska egenskaper [30]. Huvudfunktionen för denna receptorfamilj är att överföra signaler med neurotransmittorn acetylkolin vid nervändslut i neuromuskulära kopplingar, i perifera ganglier och i CNS. I neuromuskulära kopplingar och i centrala synapser bildar nikotinreceptorerna aggregat, vilka möjliggör snabb transmission. Det har också visat sig att nikotinreceptorer kan modulera överföring av smärta i CNS och att (alfa)7- nikotinreceptorsubenheten är starkt involverad [31]. Mikrogliacellerna uttrycker (alfa)7-nikotinreceptorsubenheten [32]. Nikotin inhiberar frisättning av åtminstone TNF-(alfa) från både blodburna makrofager och mikroglia i CNS [32, 33]. I vävnadssnitt har man funnit att när rökare har exponerats för nikotin minskar uttrycket av (alfa)7-nikotinreceptorsubenheten på astrocyter [34].
Smärtspridning via gap junction-kopplade astrocytnätverk
En hypotes är att gliacellerna är de drivande cellerna för att generera och underhålla den långvariga smärtan och orsaka upplevelse av smärtspridning [35]. När substanser i blodet påverkar endotelcellerna i CNS kapillärer frisätts ämnen från dessa celler som stimulerar astrocyterna att frisätta intracellulärt Ca2+, vilket leder till Ca2+-oscillationer/vågor i de gap junction-kopplade astrocytnätverken. Denna aktivering i astrocytnätverken kan verka som en »brygga« över neuronala kopplingar och förmedla spridning av smärta och bildandet av nya neuronala kontakter. Detta kan hypotetiskt förklara fenomenet smärtspridning och upprätthållandet av smärta. Också mikrogliacellerna aktiveras och flera neuroaktiva substanser produceras och frisätts från dessa celler, vilket ytterligare underhåller smärtan. Nyare data har visat att aktiverade gliaceller kan vara generatorer för den långvariga smärtan och därmed målceller för behandling.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.