Sammanfattat
Hemostasanamnes är viktig att ta upp vid blödning.
Vid »icke-kirurgisk« blödning finns det flera substanser för systembruk – prohemostatika, antifibrinolytika, koagulationsfaktorer och medel att reversera effekt av antikoagulantia – som är värdefulla.
Lokala hemostashjälpmedel har olika funktion och har sina specifika indikationsområden beroende på blödningstyp.
Preparat av animalt ursprung bör brukas med försiktighet.
Endovaskulära metoder har utvecklats, och ett intimt samarbete med interventionister är viktigt (embolisering, täckt stent, ballongocklusion).
Kirurgisk hemostas är ofta svår. Anatomisk friläggning, bra assistans och specifika instrument underlättar.
»The only weapon with which the unconscious patient can immediately retaliate upon the incompetent surgeon is hemorrhage.« William Stewart Halstead, 1912
Öppen kirurgi utan blödning är inte möjlig. I de flesta fall är en blödning inget bekymmer och får inga konsekvenser. Emellertid kan kirurgen hamna i situationer där en blödning av olika skäl blir svår att kontrollera, vilket innebär hög risk för komplikationer inklusive reoperationer och död. En transfusionskrävande blödning är dessutom behäftad med de risker som tillförsel av blod medför. Avsikten med den här artikeln är att sammanfatta ett symposium med titeln »Hjälp det blöder – vad skall man göra?« under kirurgveckan i Gävle 2005. Vi har valt att fokusera på praktiska aspekter efter att först kortfattat ha sammanfattat hemostasmekanismen.
Hemostasmekanismerna
Normal hemostas är ett intrikat samspel mellan faktorer som åstadkommer vasokonstriktion, trombocytaggregation och fibrinbildning. Optimalt samverkar dessa system för att en sk hemostatisk plugg skall bildas. I samband med kirurgi och trauma finns olika orsaker till defekt hemostas (Fakta 1). Olika sjukdomstillstånd kan ge försämrad hemostas, och i den mån dessa är kända måste anamnestiska uppgifter beaktas (tex hemofili, von Willebrands sjukdom etc).
En annan viktig grupp som kan drabbas av blödningskomplikationer är patienter med patologiskt sköra kärl på grund av defekt stödjevävnad, tex vid Ehlers–Danlos´ syndrom typ IV. Man bör rådfråga läkare som sköter patientens specifika sjukdom, och man bör frikostigt beställa journalhandlingar.
Likaså är man skyldig att i sin anamnes kartlägga vilka mediciner en patient har, då många kan påverka hemostasmekanismen negativt (olika trombocythämmare, antikoagulantia, en del antibiotika etc). Vid stora kirurgiska ingrepp används dessutom koagulationshämmare i tromboemboliprofylaktiskt syfte (i Sverige framför allt lågmolekylära hepariner). Vid uppkommen oväntad blödning, som inte är kirurgisk, ger en enkel laboratoriescreening värdefull information (Tabell I).
Iatrogena kärlskador
Kärlkirurger och interventionella radiologer blir ofta anlitade av kolleger när besvärliga blödningar uppstår. Volymmässigt dominerar blödningar efter ljumskpunktion, ofta efter kardiologisk intervention, då man kombinerar artärpunktion med multipla farmakologiska substanser för att minska trombosrisken. Ortopediska ingrepp som är behäftade med risk för artärskada är reartroplastik i höftleden, knäledsartroplastik och diskbråckskirurgi. Vid tumörkirurgi kan stora blodkärl vara engagerade, och de kan resekeras och rekonstrueras, planerat eller oplanerat. Detta är särskilt vanligt vid bäckentumörer, njurcancerkirurgi och huvud–halskirurgi.
Swedvasc
Det svenska kärlregistret (Swedvasc från 1987) har sedan 1994 registrerat ca 9000 kärlingrepp per år (90 procent av alla i Sverige). Fram till maj 2005 hade 1710 ingrepp för kärltrauma registrerats. Av dessa var 809 (47 procent) iatrogena med en ökning över tid. Medan andra kärlskador ofta drabbar barn och yngre män drabbar de iatrogena framför allt äldre, med en topp omkring 75 år och utan åldersskillnad mellan könen. Skadorna är ofta allvarliga: En månad efter skadan vårdas fortfarande 14 procent på sjukhus, och 6 procent har avlidit. Artärskador dominerar stort över venskador (11:1). Även om punktionsskador i höger arteria femoralis dominerar är skadorna spridda över hela kärlträdet.
Alltmer avancerade endovaskulära ingrepp, ofta i kombination med aggressiv antitrombotisk behandling, talar för ökad frekvens av iatrogena kärlskador. Olika förslutningsanordningar (closure devices) har emellertid utvecklats, vilket gör artärpunktion med även grova katetrar/införingshylsor säkrare. Allt fler kärlskador går att åtgärda med endovaskulär teknik. Om en kraftig blödning inträffar kan dock öppen kärlkirurgi vara livräddande. Denna kompetens måste därför finnas tillgänglig även i framtiden på sjukhus som bedriver avancerad sjukvårdande behandling.
Farmakologiska hjälpmedel för att stoppa blödning
Den minsta gemensamma nämnaren för icke-kirurgisk blödning är låg koncentration av trombin (FIIa), vilket leder till att fibrinogen inte aktiveras till fibrin. Trombin har också flera andra, väsentliga hemostasfunktioner. Trombocyter aktiveras, liksom FXIII, som tvärbinder fibrin. Trombin deltar i den endogena regleringen av koagulationen och i det fibrinolytiska systemet. Hypotermi och/eller acidos skall undvikas eller korrigeras snarast, då det hemostatiska systemet har ett snävt temperatur- och pH-optimum. Flera systemiska icke-licenspreparat finns i Sverige (Fakta 2).
Prohemostatika – desmopressin. Desmopressin är en modifiering av det naturligt förekommande hormonet vasopressin. Det verkar genom frisättning av FVIII och von Willebrand-faktor från endotelet. Nivåerna stiger 2–4 gånger efter 1,5 (my)g/kg med en halveringstid på 2,5–4 timmar. Förutom vid lindrig hemofili A (FVIII-brist) och lindrig von Willebrands sjukdom används desmopressin vid kongenitala och förvärvade trombocytdefekter, tex efter behandling med acetylsalicylsyra. Det finns dock ingen anledning att ge desmopressin till en hemostatiskt normal patient vid allmän-, torax-, kärl- eller ortopedisk kirurgi.
Huvudvärk, palpitationer och blodtrycksfall är tillsammans med ansiktsrodnad de vanligaste biverkningarna av desmopressin. Vidare har desmopressin en antidiuretisk effekt. Huruvida desmopressin kan leda till tromboemboliska komplikationer är under debatt.
Antifibrinolytika – tranexamsyra. Tranexamsyra (Cyklokapron) är en syntetisk serinproteasinhibitor som kompetitivt hämmar plasminogen, vilket leder till att plasmin inte bildas, och därmed bryts fibrin inte ner. Den rekommenderade dosen är 10–15 mg/kg med en halveringstid på ca 2 timmar.
Profylaktisk behandling med tranexamsyra reducerar blodförlusten vid torax- och ortopedisk kirurgi. Nyttan vid allmän- och kärlkirurgi är ofullständigt utredd. Gastrointestinala biverkningar, blodtrycksfall och njurtoxisk effekt vid alltför snabb intravenös tillförsel är välkända. Enstaka fall av tromboemboliska komplikationer är rapporterade.
Plasma. En enhet plasma innehåller ca 7 procent av koagulationskapaciteten hos en individ som väger 70 kg, och det behövs ca 25–30 procent för att uppnå rimlig hemostas. Detta innebär att man behöver ge 20–30 ml/kg plasma. Plasma är blodgruppsspecifik, varför patienten måste vara blodgrupperad.
Plasma är vanligen inte virusinaktiverad. Innehållet av koagulationsfaktorer varierar, varför effekten är mindre förutsägbar. Frusen plasma tar tid att tina, och färsk plasma finns inte alltid tillgänglig. Volymeffekten är inte försumbar. Plasma är dock billig, och någon trombogen effekt har inte dokumenterats.
Trombocytkoncentrat. Drygt 50 109 trombocyter brukar anses som tillräckligt för primär hemostas i frånvaro av annan koagulationsdefekt. En enhet trombocyter ger en ökning av antalet trombocyter med omkring 30 109.
Trombocytopeni kan orsakas av ökad perifer destruktion, nedsatt produktion eller omfördelning av trombocyterna. Trombocyternas adhesivitet kan även vara defekt, tex efter behandling med acetylsalisylsyra. Långsiktigt skall terapin riktas mot trombocytdefektens orsak. Temporär behandling med desmopressin bör övervägas.
Protrombinkomplexkoncentrat. Det finns idag endast ett icke-licenspreparat för protrombinkomplex, Ocplex, som innehåller de K-vitaminberoende faktorerna II, VII, IX och X. Den vanligaste indikationen för preparatet är akut reversering av vitamin K-antagonister. Den exakta aktiviteten är alltså känd, vilket gör det enklare och säkrare att dosera i förhållande till färskfrusen plasma.
Preparatet är framställt ur poolad humanplasma. Det har genomgått inaktivering av höljeförsedda virus som HIV, hepatit B-virus och hepatit C-virus, men inaktiveringen av icke-höljeförsedda virus, såsom hepatit A-virus och parvovirus B19, kan inte garanteras. Blodgruppering krävs inte, och den tillförda volymen leder inte till någon nämnvärd volymbelastning. Preparatet är frystorkat, vilket möjliggör snabb administrering. Framför allt vid överdosering av faktorkoncentrat finns risk för tromboemboliska komplikationer.
Human rekombinerad FVIIa. Användning av rFVIIa är en etablerad och väldokumenterad metod för behandling av blödande hemofiliker med antikroppar mot FVIII/FIX. Genom att tillföra suprafysiologiska koncentrationer av rFVIIa kan tillräckligt med trombin skapas för stabil hemostas.
Ett stort antal fallrapporter har visat effekt av rFVIIa vid allvarliga traumatiska blödningssituationer. Effekten har verifierats i en placebokontrollerad studie på traumapatienter (trubbigt våld) med en signifikant sänkning av transfusionsbehovet. Under 2005 publicerades den första serien patienter med intraktabel icke-kirurgisk blödning efter stor kärlkirurgi, vilket visar att rFVIIa kan ha en framtida plats i denna svårbehandlade patientkategori. Vid trauma har man använt 60–120 (my)g/kg.
En fördel med rFVIIa är att det inte föreligger någon risk för blodburen smittspridning, eftersom man använder ett rekombinerat protein. Nackdelarna är dels kostnaden, dels en eventuell risk för tromboemboliska komplikationer. Den sistnämnda risken förefaller dock liten.
Reversering av vitamin K-antagonister mm. Läkemedelsverket har under våren 2006 utgivit rekommendationer angående reversering av vitamin K, plasma och protrombinkomplexkoncentrat. Ett INR under 1,5 krävs för att en blödning skall avstanna. Vid pågående allvarlig blödning rekommenderas 10 mg vitamin K intravenöst och 10–30 E/kg protrombinkomplexkoncentrat alternativt 20–30 ml plasma/kg om protrombinkomplexkoncentrat inte finns tillgängligt.
Reversering av hepariner – protaminsulfat. Protaminsulfat är ett kraftigt basiskt protein som utvinns från fisk. Det binder till de sura heparinerna och formar ett inert komplex. 1 mg protaminsulfat neutraliserar permanent 100–140 IE ofraktionerat heparin. Visserligen är blödningskomplikationer vid behandling med lågmolekylärt heparin mindre vanliga än vid behandling med ofraktionerat heparin – men inte försumbara.
Situationen vid neutralisering av behandling med lågmolekylärt heparin är annorlunda än den är vid behandling med ofraktionerat heparin, därför att lågmolekylärt heparin vanligen ges subkutant och därmed har förlängd halveringstid, vilket leder till att det lågmolekylära heparinets antikoagulativa egenskaper återkommer. Protaminsulfat neutraliserar inte antitrombinaktiviteten fullständigt, och dessutom neutraliseras anti-FXa-aktiviten in vivo endast delvis.
Man bör vara restriktiv med att använda protamin, då risken för biverkningar är betydande; särskilt blodtrycksfall kan vara en obehaglig komplikation hos en blödande patient.
Lokala hemostashjälpmedel
I Fakta 3 listas de vanligast förekommande lokala hemostashjälpmedlen. I Fakta 4 visas vilka lokala hemostashjälpmedel som kan vara av värde i olika kliniska blödningssituationer.
Duk och väntan är i de flesta fall lösningen på problemet, men det måste få ta sin tid. Man bör titta på klockan och vänta 4–5 minuter så att trombocyterna hinner aggregera.
Polysackaridpulver kan pudras över tex en anastomos. Det anges fungera genom att resorbera vätska ur blodet runt själva polysackaridkornen med koncentration av trombocyter och koagulationsfaktorer. Dokumentationen är dock bristfällig.
Kollagen erbjuder en idealisk yta för trombocytadhesion, men dessa preparat har presenterats i svårhanterliga former. Man får inte ta i dem med blodiga instrument eller handskar. Kollagen finns numera i kombination med antibiotika och kan användas för att täcka svårare anastomoser och blödningar, tex vid reoperationer.
Oxiderad cellulosa består av regenererad, stickad och oxiderad cellulosa med bakteriedödande egenskaper. Det läggs på torrt, blir till en gröt och ger ett bra underlag för koagulation.
Fibrinlim finns i många varianter, men endast Vivostat innehåller enbart autologt fibrinogen. Övriga innehåller dels koncentrerat fibrinogen och faktor XIII, dels trombin, kalciumklorid och plasmaproteiner. Aktiverad faktor XIII orsakar korsbindning av fibrinmonomererna och mellan kollagen och fibrin, vilket ger en adhesiv styrka åt vävnaden. En fibrinolys-inhibitor är i allmänhet tillfogad till den ena av komponenterna. Produkten är djupfryst och måste tinas. Spray ger en möjlighet att sprida produkten över upp till tio gånger större yta än annars.
Gelatin och trombin gör att fibrinogenet på platsen för blödningen bildar fibrin. Dessutom sväller gelatinet med ca 20 procent, vilket ger en tamponerande effekt. Polymeriseringen tar ca 3 minuter när man använder sig av tryck med fuktig duk, på vilken kombinationen gelatin–trombin inte fastnar. Aktiv blödning krävs för att preparatet skall fungera. Trombin kan vara bovint eller humant. Garantier för fullständig virusinaktivering kan inte lämnas. Gelatinet kommer från djurriket (häst eller gris). Dessa preparat bör alltså användas med försiktighet.
Polyetylenglykol (PEG) är en syntetisk tätningsmassa som består av två komponenter. Det polymeriseras inom loppet av 60 sekunder och skall användas på torrt område, tex på en anastomos som ännu inte utsatts för tryck och puls. Polymerisatet resorberas i kroppen på mindre än 4 veckor.
Endovaskulär teknik för att stoppa blödning
Angiografi användes tidigare framför allt som en diagnostisk metod för att kartlägga blödningsorsak, men under det senaste decenniet har angiografisk endovaskulär teknik utvecklats för att stoppa blödningar. Idag finns en arsenal av material för att åstadkomma endovaskulär hemostas. Det finns olika typer av emboliseringsmaterial för att ockludera blödande kärl. Så kallade täckta stentar kan användas för att reparera ett skadat större kärl. I speciellt svåra situationer kan man stoppa flödet till ett blödande område med ballong.
Läkare med endovaskulär kompetens finns på de flesta större svenska sjukhus. I samband med en akut blödning bör man tidigt kontakta interventionisten och diskutera möjlig endovaskulär behandling. Ju tidigare kontakten tas, desto smidigare blir den fortsatta handläggningen. Före behandling bör blödningen kartläggas och lokaliseras. Olika blödningar (traumatiska, per- och postoperativa, gastrointestinala, post partum, iatrogena) kan lämpa sig väl för endovaskulär teknik.
Vid embolisering, pluggning av blodkärl, används ofta resorberbar gelatinsvamp. Material från gelatinsvampen blandas med röntgenkonstrastmedel och injiceras i blodkärlet. Om inte gelatin finns att tillgå kan man embolisera koagulerat blod. Metallspiraler, vävnadsklister och andra typer av partiklar kan också användas, beroende på blödningens typ och lokal.
Avgörande för behandlingsresultatet är att man säkert kan avgöra vilket kärl som blöder. Fynden vid angiografi kan vara subtila, och blödningar är ofta intermittenta, vilket innebär att blödningen tillfälligt kan ha upphört. Det är därför viktigt att man med andra metoder har kartlagt blödningen och i bästa fall märkt ut det blödande området. Vid övre gastrointestinala blödningar kan man med gastroskopi markera blödningsområdet, vilket underlättar snabb och korrekt riktad embolisering. Vid trauma är det viktigt att blödningen är kartlagd med kontrastuppladdande datortomografi.
Påvisande av kontrastextravasering, som tecken på pågående blödning, underlättar att hitta det blödande området med angiografi. Ibland kan man med hjälp av skadetyp och anamnes relativt väl förutse blödningslokalisationen. Svåra postpartum-blödningar lämpar sig väl för selektiv embolisering av uterina kärl med gelatin. Metoden är skonsam med relativt liten risk för framtida men eller påverkan på fertiliteten.
Mjält-, lever- och njurblödningar kan behandlas endovaskulärt med gott resultat. Om blödningen säkert kan lokaliseras emboliserar man det blödande kärlet så selektivt som möjligt. Vid diffus blödning i mjältparenkymet rekommenderas ocklusion av a lienalis proximalt med metallspiraler för att få blödningen under kontroll. Mjälten överlever oftast genom kollateral cirkulation.
Vid skada på större kärl (aorta, vena cava, bäcken- och extremitetskärl) använder man sig av täckta stentar (stentgraft) för att från blodkärlets insida täcka det skadade området. Det rör sig om antingen en ballongexpanderande eller en självexpanderande stent som är täckt med polyester eller polytetrafluoretylen. Idag finns storlekar som passar alla kärldiametrar. Storleken på punktionshålet, där man för in stentgraftet, kan variera mellan 3 och 8 mm beroende på stentstorleken. För att undvika ljumskpunktionsblödning frilägger man kärlet eller använder förslutningsanordning (closure device).
En aortaruptur vid decelerationstrauma är vanligtvis lokaliserad strax efter avgången för vänster a subclavia och kan med fördel behandlas endovaskulärt med aortastentgraft. Aortadissektioner kan leda till ruptur och torakal blödning. Om det rupturerade området är gynnsamt beläget, distalt efter avgången för vänster a subclavia, kan det behandlas med stentgraft.
Skador på iliacakärlen är ofta iatrogena. Exempelvis kan det ske en ruptur vid ballongdilatation av en stenos eller en perforation vid användning av införingshylsor i slingriga arteriosklerotiska kärl. Initialt kan man blåsa upp en ballong under ca 5–10 minuter över det skadade området. Om blödningen inte upphör kan man täcka det skadade området med stentgraft.
Även skador på hals- och övre extremitetskärl kan behandlas enligt samma principer. Viktigt är dock att man använder självexpanderande stentgraft i denna region, eftersom ballongexpanderande stentar kan kollabera vid yttre tryck. Artärpunktionsskada i samband med insättande av en central venkateter behandlas med fördel med endovaskulär metod. Om den centrala venkatetern accidentellt lagts in i större artär skall man låta den sitta kvar och omedelbart kontakta interventionist. Man kan då ta ut katetern över ledare och plugga punktionshålet med en förslutningsanordning.
Sammanfattningvis är fördelarna med endovaskulär teknik stora, med specifik diagnostik, mer riktad och effektiv terapi, mindre trauma och stor framtidspotential. Man får dock inte glömma att metoden är invasiv och kan vara förenad med mer eller mindre allvarliga komplikationer, som i vissa material angivits till ca 10 procent. Metoden är tekniskt krävande, ett stort och dyrt materialförråd behövs och lång utbildning krävs. Ett logistiskt problem är att ett joursystem ännu inte utvecklats.
Kirurgisk hemostas för att stoppa blödning
När man själv orsakat en kärlkomplikation kan man oftast snabbare och lättare åtgärda skadan. Noggrann och försiktig dissektion och säker ligatur innan man delar kärl i »djupa« lägen är basal kunskap.
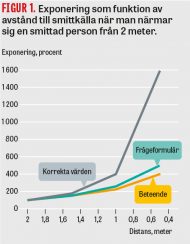
Om man blir kallad för att hjälpa till vid oväntad blödning är det viktigt att först skaffa sig en uppfattning om patienten, hur skadan uppkom och hur mycket blod som förlorats. Packning med duk kan vara bra primärt medan man inhämtar information om patienten. Visar det sig att skadan måste åtgärdas är bra assistans, bra belysning och lupp samt instrument man själv är van vid en fördel. Speciellt viktigt är att man använder en kärlsug som mer precist kan få området torrt, så att sutur eller annan teknik kan användas optimalt. Anatomisk orientering är av största vikt. Proximal och distal kontroll skall eftersträvas. Skaftad tork kan trubbigt och atraumatiskt räcka för de flesta venösa blödningar (Figur 1). Vid större ven- eller artärskada kan instrumentet Hemostop vara värdefullt (Figur 2).
Peanger bör undvikas, då de oftast inte kan sättas med precision när det blöder diffust, dessutom kan skadan förvärras. En kärlskada sys bäst om man inte väljer ligatur och delning av kärlet. Vener kan oftast delas utan allvarligare konsekvenser. Skadans lokalisation och storlek samt patientens tillstånd får avgöra. Atraumatiska kärlsuturer med så liten nålstorlek som möjligt skall användas för att undvika stickhålsblödningar.
På svårt förkalkade eller sköra kärl kan »pledgets« av teflonfilt eller annat material användas för att stödja suturer och förhindra att de skär vid knytning.
Principen »liv före lem« är viktig och gäller naturligtvis inte bara extremiteterna. Ligatur eller tamponad av framför allt venösa skador kan vara livräddande. Om man bestämt sig för att sy skadan primärt räcker det oftast med att få ett bra suturtag över skadan, hålla upp båda trådändarna och sy fler stygn över skadan och därefter knyta.
Vid artärskador kan venpatch eller mobilisering och ända-till-ända-anastomos användas. Dock måste översträckning undvikas, då detta kan ge intimaskador och risk för sekundär trombos. Clips som inte kan sättas mycket precist skall undvikas. Det är mycket svårare att sy skadan om clipsen inte fungerar.
Slutord
Blödning i samband med kirurgi är i någon mån alltid att betrakta som iatrogen. Ur såväl patientsäkerhets- som medikolegal synvinkel är det därför viktigt att man vid svårartade blödningar försäkrar sig om högsta möjliga kompetens att nå snabb och effektiv hemostas och att man beaktar att situationens komplexitet kan kräva samarbete mellan personer med olika kompetens.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.