Sammanfattat
Lungkomplikationer inträffar hos 40–60 procent av allogent stamcellstransplanterade patienter och svarar för 10–40 procent av den transplantationsrelaterade mortaliteten.
Den vanligaste allvarliga sena icke-infektiösa lungkomplikationen till hematopoetisk stamcellstransplantation (SCT) är obliterativ bronkiolit.
Inertgasutsköljning är en känslig metod för att upptäcka obstruktion av de perifera luftvägarna.
Obliterativ bronkiolit efter SCT kan påvisas i tidigt skede med inertgasutsköljning.
Hematopoetisk stamcellstransplantation (SCT) är idag en etablerad behandlingsform vid många sjukdomstillstånd, framför allt vid leukemi men också vid andra hematologiska sjukdomar, nedärvda ämnesomsättningssjukdomar och primära immunbristsjukdomar [1]. De första lyckade allogena stamcellstransplantationerna genomfördes 1968 på tre barn med svåra immunbrister. Idag kan antalet allogena SCT per år uppskattas till drygt 30000. Cirka 9000 av dessa utförs på personer under 20 års ålder [2].
Lungkomplikationer efter SCT
Allogen SCT medför risk för komplikationer i många olika organsystem. Lungkomplikationer inträffar hos 40–60 procent av vuxna patienter som genomgått allogen stamcellstransplantation och svarar för 10–40 procent av transplantationsrelaterad död [3, 4]. Några säkra siffror för barn finns inte, men incidensen är sannolikt lägre hos barn än hos vuxna [5]. Tabell I listar kända lungkomplikationer efter SCT. Flera potentiella riskfaktorer för lungkomplikationer har identifierats, däribland hög ålder på donator eller mottagare [3, 7], underliggande grundsjukdom [7] och förekomst av graft-versus-host-reaktion (GvH) i annat organ [3, 6, 7].
En graft-versus-host-reaktion är en immunologisk reaktion där lymfocyter från det nya immunsystemet från transplantatet uppfattar stamcellsmottagaren som främmande och därför angriper den. Lungorna är ett av de organ som drabbas, särskilt vid den kroniska formen av GvH [6, 8]. Andra lungkomplikationer efter SCT är infektioner, tex med virus och svamp, som är förenade med hög mortalitet och sequelae hos överlevande [3, 6], restriktiva tillstånd [3, 4] och obliterativ bronkiolit [3, 4, 6]. Obliterativ bronkiolit (OB), ett obstruktivt lungtillstånd som anses vara irreversibelt, är starkt kopplat till förekomst av GvH [7, 9], och tillstånden förväxlas ofta, trots att de utgör olika entiteter. Den histologiska bilden vid GvH finns sparsamt beskriven i litteraturen, och där den nämns talas det ofta om just manifestation i form av OB. Den kliniska bilden vid GvH varierar med manifestationsformen [6].
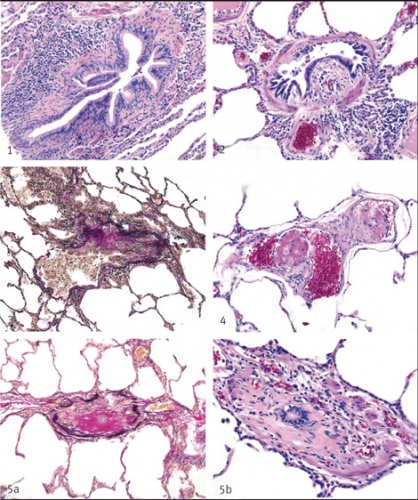
OB påverkar primärt de perifera delarna av luftvägarna [10] och är hos stamcellstransplanterade patienter starkt kopplat till förekomsten av GvH i lungorna [7]. Tillståndet är en inflammatorisk och senare fibrotisk process i bronkiolerna, som orsakar en svår luftvägsobstruktion [11, 12] (Figur 1). Diagnosen är histologisk och kräver således lungbiopsi. Studier har dock visat att transbronkiella biopsier har en mycket låg sensitivitet för att ställa diagnosen OB [13].
Incidensen av OB efter SCT varierar stort mellan olika studier (mellan 2 och 20 procent) och rapporteras vara lägre hos barn än hos vuxna [3, 7]. I en stor amerikansk uppföljning av stamcellstransplanterade barn och vuxna ställdes diagnosen OB i genomsnitt 465 dagar efter SCT, men tidsspannet för diagnos var stort [7].
Det finns inga kontrollerade studier som har lyckats påvisa någon effektiv behandling av OB efter SCT. Symtomatisk behandling (med bla syrgas och luftrörsvidgande medel), behandling av eventuella samtidiga infektioner och ökad immunsuppressiv medicinering utgör de riktlinjer som finns och baseras främst på expertrekommendationer. Anekdotiska rapporter finns också om behandlingseffekter av bland annat azitromycin [14].
Mortaliteten i OB uppges till mellan 20 och 100 procent trots insatt behandling men är lägre vid sen debut efter SCT. I en studie hade patienter som insjuknat i OB tidigare än sex månader efter SCT en ettårsöverlevnad på 10 procent, medan de som insjuknat senare hade en ettårsöverlevnad på 70 procent och en femårsöverlevnad på drygt 40 procent [7].
En klinisk beskrivning av OB, »bronchiolitis obliterans syndrome«, med lungfunktion som grund för diagnosen (sänkning av FEV1 med 10 procent från utgångsläget), fastställdes ursprungligen för lungtransplanterade personer [15, 16] men används också vid andra tillstånd, inklusive lungsjukdom efter SCT och hos icke-transplanterade individer [11]. Fördelen är att diagnosen inte kräver biopsi och därför kan ställas utan invasiva ingrepp. Svagheten är att den kliniska bilden förväntas korrelera med den histologiska, vilket den inte alltid gör.
Spirometri är den metod som traditionellt används för att följa lungfunktionen. FEV1 från spirometri avspeglar främst funktionen i de stora luftvägarna [10], medan OB företrädesvis påverkar de perifera delarna av lungorna [17]. Det är därför sannolikt att sjukdomen kan progrediera under lång tid innan misstanke uppkommer när traditionella lungfysiologiska undersökningar används [18, 19]. Flera rapporter finns om fall där symtom på OB i tidigt skede misstagits för ett annat tillstånd, ofta astma, därför att fysiologiska undersökningar inte givit en entydig bild [3, 6].
Det är därför angeläget att etablera diagnostiska hjälpmedel som kan indikera lungförändringarna tidigt och därmed ge förutsättningar för tidig intervention och förhoppningsvis mer framgångsrik behandling. På senare år har man därför använt högupplösande datortomografi [20, 21] och påvisande av kvävemonooxid (NO) i utandningsluften [22] för att påvisa OB, tyvärr utan större framgång.
Inertgasutsköljning
Eftersom OB är en sjukdom i de perifera luftvägarna [17] är mätning av funktionen i dessa lungdelar viktig för att få en uppfattning om utvecklingen av sjukdomen. Inertgasutsköljning är idag en etablerad metod för att mäta funktionen i de perifera luftvägarna [10, 18, 23] och har tidigare genomförts hos vuxna som genomgått SCT. Resultaten därifrån indikerar att OB-liknande förändringar kan påvisas tidigare med denna metod än med spirometri, kroppspletysmografi eller mätning av lungornas diffusionskapacitet [17, 19].
Inertgasutsköljning görs genom mätning av ett vitalandetag (dvs en maximal inandning följd av en maximal utandning), som vid single-breath washout (SBW), eller av flera tidalandetag (dvs vanlig lugn in- och utandning med normala andetag), som vid multiple-breath washout (MBW). MBW har den stora fördelen att den kan användas i alla åldrar eftersom den inte kräver aktiv medverkan från patienten och därför är den metod som lämpar sig bäst vid undersökning av små barn.
Grunden för inertgasutsköljning är utvädring från lungorna av en inert markörgas som antingen finns där normalt (kvävgas, N2) eller en som lungorna först mättats med, tex helium (He) och/eller svavelhexafluorid (SF6). Ofta används båda gaserna samtidigt. N2-tekniken används ofta på grund av sin låga kostnad, men He och SF6 har fördelen att mycket mer information kan fås ut ur undersökningen.
Vid MBW mättas patientens lungor först med de inerta gaserna (He och/eller SF6) i en sk washin-fas, genom att personen tidalandas en gasblandning med 4 procent av respektive gas i luft. När lungorna mättats med gaserna, dvs när utandningsluften innehåller samma koncentration av gaserna som inandningsluften, kopplas gasflödet bort och patienten andas vanlig rumsluft, fortfarande i tidalandning. Under varje påföljande andetag registreras luftflöde och gaskoncentrationer för de inerta gaserna. Mätningen avslutas när den endtidala koncentrationen av gaserna nått 1/40 av ursprungskoncentrationen [10].
Funktionell residualkapacitet. Från de mätresultat som erhålls från inertgasutsköljningen kan man beräkna den funktionella residualkapaciteten (FRC). Eftersom gasutsköljningsmetoderna baseras på mättning och spädning av en gas i lungorna mäts endast de lungpartier som ventileras. Hos en frisk person innebär detta att hela lungvolymen mäts, men hos en lungsjuk person kan avstängda partier finnas med så kallad trapped gas, dvs partier som inte ventileras och som alltså inte detekteras med gasutsköljning. Genom att jämföra det värde för FRC som erhålls med gasutsköljning med det som erhålls med kroppspletysmografi, som mäter hela FRC (inklusive avstängda partier), får man en uppfattning om hur stor volym trapped gas som finns. Detta är värdefullt vid tillstånd där lungorna kan vara heterogent ventilerade, såsom vid obliteration av vissa bronkioler vid OB men också vid exempelvis cystisk fibros.
Lung clearance index. Ett annat mått som rapporteras vid inertgasutsköljning är lung clearance index (LCI). LCI är det antal vilolungvolymer (FRC) som patienten behöver för att ventilera ut den inerta gasen från lungorna, från startnivån (4 procent) till den förutbestämda »nollnivån« (0,1 procent). Det faktum att det är antalet FRC, som är patientspecifikt, och inte antalet andetag eller en fast volym, som anges medför att värdet inte blir beroende av tidalvolymen eller av storleken på lungorna (indirekt av åldern). LCI är relativt konstant genom hela livet [10] med ett värde på ca 6,3–6,9±0,4–0,5 (medelvärde ±1 SD) [24-26]. Genom att standardavvikelsen är liten blir LCI ett mycket känsligt mått på avvikelser i den perifera lungfunktionen.
SnIII-analys. På senare år har sk fas III-analys av gasutsköljningskurvorna aktualiserats. Metoden beskrivs endast kort här men finns närmare beskriven i tidigare publicerad litteratur [10, 27, 28]. Varje utandning i washout-fasen genererar en kurva över koncentrationen av de inerta gaserna i utandad luft. Kurvan kan indelas i olika faser, som var och en representerar olika delar av luftvägarna. Slutet av kurvan (den sk fas III) representerar den alveolära fasen. Analys av hur denna fas progredierar för varje andetag ger en bild av ventilationsfördelning i de mest perifera delarna av lungorna [27].
Patientfall
För att exemplifiera lungpåverkan efter SCT och inertgasutsköljningens möjligheter återger vi här tre patientfall från Barncancercentrum på Drottning Silvias barn- och ungdomssjukhus i Göteborg.
Fall 1. Grav lungpåverkan efter SCT. En pojke född 1988 diagnostiserades med svår kombinerad immundefekt vid fyra månaders ålder. Han transplanterades 1989 med haploidentiska blodstamceller från modern efter reducerad konditionering. Lungfunktionsundersökningar kunde inte göras på grund av den låga åldern (inertgasutsköljningen var då inte etablerad på kliniken). Under åren efter transplantationen visades han ha en kvarstående immundefekt, som yttrade sig i form av upprepade pneumonier och utbredda vårtor. På grund av successiv försämring av immunfunktionen genomfördes i mars 2000 en retransplantation med stamceller från en HLA-identisk obesläktad givare. Efter drygt två veckor utvecklade han akut GvH i huden och efter 4 månader även en kronisk GvH i tarmen. Trots GvH-behandling med steroider och ökad immunsuppression tillkom sju månader efter den andra SCT en ökande andfåddhet. Spirometri visade klart sänkta flöden. Diagnosen lung-GvH ställdes baserat på kliniken och spirometriska fynd. Samtidigt påvisades Pneumocystis jiroveci i sköljvätska från bronkoalveolärt lavage.
Under de följande två åren upplevde han en tilltagande andningsinsufficiens. I maj 2002, två år efter hans andra SCT, genomfördes en inertgasutsköljning som visade grava förändringar med kraftigt förhöjt LCI (Figur 2) och en utveckling av fas III-platån som indikerade ojämn ventilationsfördelning. Fynden bedömdes vara förenliga med diagnosen OB. Spirometri visade samtidigt en klart obstruktiv bild med sänkt FEV1 på 0,6 liter (–13,0 SD) och sänkt forcerad vitalkapacitet (FVC, dvs den största volym som kan andas ut efter en maximal inand-ning) på 1,6 liter (–5,4 SD). Kroppspletysmografi visade hyperinflation. LCI fortsatte sedan öka, samtidigt som han kliniskt blev allt mer andfådd och orkade allt mindre. Spirometriska värden låg samtidigt kvar på samma nivåer som i maj 2002.
På grund av fortsatt försämring av lungfunktionen genomfördes en bilateral lungtransplantation i november 2003, knappt fyra år efter hans andra SCT. Inertgasutsköljning strax efter lungtransplantationen visade full normalisering av LCI (7,0), och analys av fas III-platån visade normal ventilationsfördelning. Kliniskt har han efter lungtransplantationen haft god ork och har kunnat återgå till full skolgång i vanlig skola. Den senaste kontrollen skedde i maj 2007, då han var välmående med full aktivitetsförmåga.
Fall 2. Grav lungpåverkan efter SCT. En pojke född 1988 diagnostiserades med myelodysplastiskt syndrom med sekundär akut myeloisk leukemi (AML) i maj 1998. Spirometri före transplantationen visade normal lungfunktion med FEV1 och FVC inom referensintervallen. Allogen SCT genomfördes i september samma år med en HLA-identisk syster som givare. Två månader efter SCT utvecklade han en akut GvH-reaktion i hud och lever. I februari 1999, knappt fem månader efter SCT, tillkom ansträngningsutlösta andningsbesvär och ökande hosta. Detta tolkades som astma och inhalationsbehandling initierades. Orken försämrades dock, andningsbesvären kom efter allt mindre ansträngning och ordinerade betastimulerare i inhalationsform upplevdes inte hjälpa. Spirometri i april 1999 (inertgasmetoden var då inte etablerad på kliniken) visade en obstruktiv ventilationsinskränkning (se Figur 3) utan reversibilitet efter inhalation av betastimulerare. Bilden tolkades som förenlig med obliterativ bronkiolit. Pojken upplevde viss förbättring på insatt steroidbehandling, och de perorala steroiderna trappades ned och sattes ut helt i oktober 2000. I mars 2002 bedömdes hans lungstatus fortfarande vara stabilt.
Inertgasutsköljningsmetoden etablerades i Göteborg våren 2002 och den första undersökningen i juni 2002 visade ett förhöjt LCI (Figur 3) och ett FRC som med 1,3 liter understeg FRC mätt med kroppspletysmografi, vilket indikerar trapped gas.
Andningsbesvären försämrades och från våren 2004 blev han syrgasberoende. Ny inertgasutsköljning visade i juni 2004 ett ytterligare stegrat LCI på 22,0. Han fortsatte försämras och blev syrgasberoende dygnet runt. I mitten av november 2006 genomgick han en bilateral lungtransplantation. Undersökningar av lungfunktionen har ännu inte gjorts efter detta.
Fall 3. Inertgasutsköljning som grund för OB-diagnos. En pojke född december 2001 utreddes i neonatalperioden på grund av hudblödningar och diagnostiserades med Wiskott–Aldrichs syndrom. Han transplanterades i november 2002 med HLA-identiskt obesläktat navelsträngsblod. Sju månader efter transplantationen utvecklade han hud-GvH, som svarade på behandling. I november 2003, ett år efter SCT, fick han ökande andningsbesvär och bronkoalveolärt lavage påvisade en Pneumocystis jiroveci-pneumoni.
Inertgasutsköljning en månad senare, vid två års ålder, visade ett förhöjt LCI på 11,4, motsvarande +11,8 SD och en fas III-utveckling tydande på perifer luftvägspåverkan. Bilden bedömdes förenlig med OB och behandling mot detta startades. Hans andning förbättrades kliniskt av denna behandling och steroiddoserna sänktes. Figur 4 visar förloppet vid efterföljande inertgasutsköljningar. Fas III-utvecklingen har vid samtliga tillfällen visat en bild som vid perifer luftvägspåverkan. Kliniskt har han dock varit symtomfri.
Diskussion
Vi har här presenterat tre fall med patienter från Barncancercentrum i Göteborg som efter allogen stamcellstransplantation fått mycket allvarliga lungkomplikationer. I två av fallen har barnen lungtransplanterats på grund av sin lungpåverkan.
I ett av fallen (Fall 2) tolkades lungsymtomen först som astma och behandlades som sådan. Först när en spirometri utförts och visat en icke-reversibel obstruktiv ventilationsinskränkning misstänktes diagnosen OB och behandling sattes in. Hans lungfunktion fortsatte dock att försämras. Vid enkel spirometri kan det vara svårt att tydligt skilja mellan astma och bronchiolitis obliterans syndrome, eftersom det vid båda tillstånden ses en sänkning av FEV1. Däremot kan en inertgasutsköljning skilja de två tillstånden åt, då LCI är förhöjt vid OB (perifer luftvägspåverkan) och väsentligen normalt vid astma, som påverkar de stora luftvägarna [29].
Hos patient 3 ledde diagnos med inertgasutsköljning till att immunsuppressiv behandling sattes in, med förbättring och stabilisering av den uppmätta perifera luftvägsfunktionen, även om den inte normaliserades helt. En upplevd god lungfunktion utan några subjektiva andningsbesvär kan således ändå uppvisa en påverkad bild i den perifera lungfunktionen. Detta är ett dilemma i den kliniska verkligheten, då vi inte vet om vi i detta läge ska fortsätta behandla och i så fall hur länge.
En stor amerikansk studie med patienter både i barnaålder och i vuxen ålder visade att tidig debut av OB har en mycket allvarlig prognos med klart högre mortalitet [7]. Möjligen är denna OB så aggressiv och snabb i sitt förlopp att prognosen inte kan ändras nämnvärt om sjukdomen skulle påvisas tidigare. Detta skulle i så fall innebära att den OB vars förlopp går att påverka är den som debuterar senare och att det är vid de senare kontrollerna som inertgasutsköljning skulle kunna tillföra mest.
Med den höga frekvensen av lungkomplikationer i åtanke och den subkliniska bild som rapporterats vara vanlig är det av stor vikt att transplantationskontrollerna efter SCT inkluderar en regelbunden noggrann kontroll även av lungfunktionen. På Drottning Silvias barn- och ungdomssjukhus i Göteborg är inertgasutsköljning och spirometri numera rutinundersökningar före och efter SCT.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.