Sammanfattat
Trombotisk mikroangiopati betecknar den patologiska bilden vid hemolytiskt uremiskt syndrom (HUS), trombotisk trombocytopen purpura (TTP) och några andra tillstånd.
Trombotisk mikroangiopati kännetecknas av skadat endotel i de minsta kärlen med deposition av trombocyter, ocklusion av blodkärl, minskat blodflöde och sekundär organsvikt.
HUS karakteriseras av mikroangiopatisk hemolytisk anemi, trombocytopeni och akut njursvikt. Det kan utlösas av tarminfektion med Shiga-toxinproducerande bakterier (enterohemorragiska Escherichia coli eller Shigella dysenteriae).
Atypiskt HUS kan vara familjärt och återkommande och i en del fall associerat med dysfunktion i reglering av den alternativa komplementvägen.
TTP kännetecknas av mikroangiopatisk hemolytisk anemi, trombocytopeni, feber, njur- och CNS-påverkan. Den förknippas med bristfällig aktivitet i von Willebrand-faktorklyvande proteas ADAMTS13.
Denna översikt fokuserar på klassifikation, symtom, patologi, patogenes, utredning, omhändertagande och behandling av dessa tillstånd.
Trombotisk mikroangiopati är ett samlingsbegrepp för det patologiska fyndet vid hemolytiskt uremiskt syndrom (HUS), trombotisk trombocytopen purpura (TTP) och vissa andra tillstånd [1] (Tabell I).
HUS är ett syndrom som kännetecknas av mikroangiopatisk hemolytisk anemi (ej antikroppsmedierad) med fragmenterade röda blodkroppar, trombocytopeni och akut njursvikt. Den klassiska/typiska formen förknippas med enterohemorragiska Escherichia coli (EHEC), där den vanligaste serotypen är E coli O157:H7 [9].
Genom förtäring av förorenad mat eller dryck eller direkt kontakt med smittad individ ger EHEC tarminfektion med vattnig eller blodig diarré (därför kallas denna form av HUS även D+ HUS [D=diarré]). Diarrén efterföljs i cirka 10 procent av fallen av HUS. Flera utbrott av EHEC-infektioner med HUS som komplikation har beskrivits i Sverige [10]. Denna form av HUS brukar inte recidivera.
Den atypiska formen av HUS kallas även D– HUS, eftersom den oftast inte är associerad med prodromala symtom (som diarré). Den kan vara ärftlig eller förvärvad och recidivera, och den kan i flera fall förknippas med dysfunktion i reglering av den alternativa komplementvägen [4].
TTP är ett liknande tillstånd, som kännetecknas av mikroangiopatisk hemolytisk anemi, trombocytopeni, feber, njurpåverkan och neurologiska symtom. Patienter med TTP har bristfällig aktivitet i von Willebrand-faktor(VWF)-klyvande proteas ADAMTS13 (a disintegrin-like and metalloprotease with thrombospondin type-1 motif) [8]. TTP kan också förekomma i ärftlig eller förvärvad form och recidivera.
Symtom
HUS utlöst av infektion. EHEC-smittade individer har oftast svåra tarmsymtom som diarré, buksmärtor, illamående och kräkningar, och vissa tarmkomplikationer som rektalprolaps, tarmperforation och nekros förekommer. Inom 1 till 2 veckor efter debut av tarmsymtom utvecklar patienterna blekhet och gulsot (på grund av hemolys), petekier eller blödningar, njursvikt med minskad diures och i vissa fall högt blodtryck. I cirka 30 procent av fallen utvecklas CNS-påverkan och även påverkan på andra organ som lever, hjärta och pankreas [1].
Andra infektioner som Streptococcus pneumoniae och HIV har också associerats med HUS (Tabell I). Vid invasiv pneumokockinfektion med vissa serotyper förekommer HUS utöver sepsis, meningit, pneumoni och empyem [11].
Atypiskt HUS. Skov av atypiskt HUS kan utlösas av ospecifika infektioner eller feber, och symtomen är lika de beskrivna för EHEC-utlöst HUS, men förloppet är oftast inte lika akut.
TTP. TTP brukar inte utlösas av specifika prodromala symtom men kan sättas igång av infektioner. Neurologiska symtom ingår i den kliniska bilden, allt från kramper, nedsatt sensibilitet, förvirring, huvudvärk, synrubbningar och sänkt medvetandegrad till koma. Förloppet är oftast inte så akut, och feber är vanligt. Många patienter har njurpåverkan som kan yttra sig i form av hematuri och proteinuri, och vissa utvecklar njursvikt. I övrigt liknar symtomen de som beskrevs för HUS [12].
Laboratoriefynd
Patienter med trombotisk mikroangiopati, oavsett genes, har hemolytisk anemi med sänkt haptoglobinhalt, retikulocytos, förhöjd halt LD (laktatdehydrogenas) och okonjugerat bilirubin. Direkt antiglobulintest (DAT) är negativt i alla fall av HUS förutom dem som är utlösta av Streptococcus pneumoniae [2]. Blodutstryk visar fragmenterade röda blodkroppar. Måttlig till svår trombocytopeni präglar laboratoriebilden, men protrombinkomplex (PK) och aktiverad partiell tromboplastintid (APTT) är normala. Kreatinin och urea är förhöjda, och patienter kan ha andra laboratorietecken på njursvikt och hemolys som hyperkalemi. Patologiska levervärden kan förekomma vid EHEC-utlöst HUS, liksom högt blodsocker.
Urinsticka visar förekomst av blod, hemoglobin och protein [1]. Blododlingar är negativa vid EHEC-utlöst HUS men kan vara positiva vid pneumokockutlöst HUS.
Patologi
Vid trombotisk mikroangiopati noteras tromboser i arterioler och kapillärer [13] med svullnad av intima och fibrinoid nekros i kärlväggen. I njurarna ser man skadade endotelceller, exponering av subendotel, ocklusion av kärllumen i kapillärer och arterioler och i svåra fall skadade tubuli och kortikal nekros. Tromboser vid EHEC-utlöst HUS innehåller fibrin, medan dessa vid TTP innehåller mest VWF och trombocyter [14].
Figur 1 visar patologiskt fynd i njurbarken hos ett tidigare beskrivet fall av TTP [15] utlöst av mutation i ADAMTS13.
Patogenes
HUS och TTP drabbar flera organ och ger liknande symtom, laboratorieparametrar och patologi, men skiljer sig avseende patogenes.
EHEC-infektioner. EHEC förekommer sporadiskt och i utbrott. Stora utbrott har beskrivits i USA, Kanada, England och Japan men också i Norge [16] och Sverige [10]. Fram till 1995 var EHEC-infektioner sällsynta i Sverige och oftast associerade med utlandsresa, men sedan dess har flera utbrott beskrivits. I vissa av dessa utbrott har man kunnat spåra smittan till intag av förorenad mat som kallrökt korv, mjölkprodukter eller sallad [10, 17]. Infektioner med EHEC ger oftast symtom i form av diarré, som kan vara blodig [9]. Asymtomatisk infektion kan förekomma, men EHEC hör inte till normal tarmflora. Bakterien överförs genom intag av förorenad mat (köttfärs, korv, icke-pastöriserade mjölkprodukter, förorenade grönsaker) och dryck samt genom bad i förorenat vatten. Smitta mellan människor har också beskrivits. Bakterien har en inkubationstid på upp till 8 dagar innan symtomen visar sig.
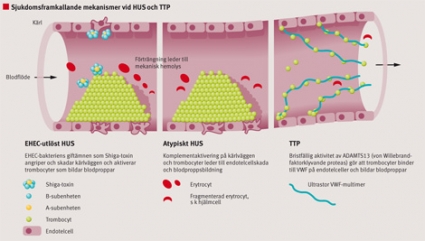
HUS-utbrott har alltid förknippats med Shiga-toxinproducerande bakterier såsom EHEC eller Shigella dysenteriae, vilket tyder på att toxinet kan bidra till patogenesen [18]. Efter det att bakterien koloniserar tarmen frisätts virulensfaktorer som Shiga-toxin och endotoxin (lipopolysackarid, LPS). Tarmen skadas förmodligen av Shiga-toxinet och av kroppens immunsvar. Shiga-toxin och LPS cirkulerar bundna till blodceller, framför allt trombocyter [19]. När Shiga-toxin når njuren binder det till en specifik glykosfingolipidreceptor på glomerulärendotel och tubuliceller och leder till celldöd efter att ha genomgått endocytos.
Både Shiga-toxin och LPS kan aktivera trombocyter, som då har lättare för att aggregera [19, 20], och genom att skada endotel [21] i mindre kärl skapas ett protrombotiskt tillstånd. När trombocyter aggregerar i mindre kärl i njurbarken ockluderas dessa kärl (Figur 2), vilket leder till minskad diures och njursvikt. Hemolys är inte immunmedierad (DAT-negativ) och orsakas av oxidativa förändringar i erytrocyter och/eller mekanisk nedbrytning i delvis ockluderade kärl [18].
Streptococcus pneumoniae-infektioner. Vid infektion med vissa serotyper av Streptococcus pneumoniae frisätts bakterieenzymet neuraminidas, som genom att avlägsna sialinsyra från glykoproteiner på erytrocyter exponerar kryptantigenet Thomsen–Friedenreich-antigen (T-antigen) [11]. Det är dock oklart hur T-antigenexponering leder till HUS. Hemolysen är DAT-positiv.
Atypiskt HUS. Mutationer i komplementfaktorer, faktor H, faktor H-relaterade proteiner 1 och 3, faktor I, membrane cofactor protein (MCP)/CD46, faktor B och C3 har hittats hos patienter med HUS [4, 6].
Mutationer i faktor H, faktor I och MCP är oftast heterozygota, dvs de ärvs från ena föräldern. En och samma patient kan dock bära på en genmutation på den ena allelen och en annan genmutation på den andra allelen. Vissa kombinationer av sjukdomsrelaterade polymorfismer i faktor H har också beskrivits [22].
Dessutom har man funnit att vissa patienter har förvärvade neutraliserande antikroppar mot faktor H som bidrar till utveckling av HUS [23].
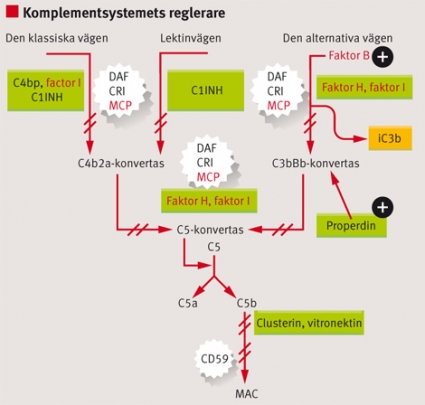
Faktor H cirkulerar i plasma och hämmar aktivering av den alternativa komplementvägen (Figur 3). När faktor H inte fungerar som den ska, på grund av mutation eller neutraliserande antikroppar, kan den alternativa vägen aktiveras på kroppsegna celler, vilket leder till endotelcellskada [25] och trombocytaktivering [26].
Faktor I är också ett cirkulerande plasmaprotein. Mutationer i faktor I har funnits hos en del patienter med atypiskt HUS fast inte alla dessa mutationer påverkar den klyvande funktion i komplementsystemet som faktor I har [27, 28]. MCP/CD46 är en cellbunden komplementhämmare som binder C3b och har faktorI-kofaktoraktivitet. Hos patienter med mutationer uttrycks proteinet mindre eller inte alls på cellytan, och i de fall där uttrycket är normalt är bindningsförmågan eller kofaktoraktiviteten nedsatt [5].
Ett fall av EHEC-utlöst HUS har beskrivits med mutation i MCP [29], men någon säker koppling mellan EHEC-utlöst HUS och aktivering av den alternativa vägen av komplement har hittills inte hittats, och dessa sammanhang betraktas som sällsynta.
Andra mindre vanliga orsaker till atypiskt HUS sammanfattas i Tabell I och har nyligen beskrivits [3, 4, 7].
TTP. Bristfällig aktivitet i ADAMTS13 leder till TTP. ADAMTS13 är ett metalloproteas som normalt klyver ultrastora multimerer av VWF och därmed begränsar storleken på blodproppar [12]. VWF utsöndras från endotelceller i multimerer av olika storlekar. De ultrastora multimererna binder till trombocyter i högre grad än mindre multimerer, och till följd av detta bildas blodproppar. I avsaknad av aktiv ADAMTS13 cirkulerar ultrastora VWF-multimerer i plasma, och trombocyter binder till dessa på ytan av endotelceller (Figur 2), vilket leder till trombocytaggregat och ocklusion av kärllumen.
ADAMTS13-aktiviteten kan vara sänkt på grund av mutation eller autoantikroppar. Mutationer förekommer vid ärftlig familjär TTP. Dessa är oftast dubbelt heterozygota (compound heterozygous) eller homozygota, och ärvs därmed från båda föräldrarna.
Förvärvad TTP inträffar hos patienter som har cirkulerande autoantikroppar mot ADAMTS13. Detta förekommer hos individer med andra autoimmuna sjukdomar som systemisk lupus erythematosus (SLE) eller i frånvaro av annan sjukdom [12].
Utredning
En patient som debuterar med hemolytisk anemi, trombocytopeni och njurpåverkan kan ha både HUS och TTP. Vid prodromala symtom bestående av blodig eller vattnig diarré bör EHEC-infektion misstänkas, och feces- och/eller serumanalyser tas enligt Tabell II. EHEC-infektion kan dock yttra sig som urinvägsinfektion [35] eller utan symtom från tarm eller urinvägar; därför bör EHEC-infektion uteslutas hos alla patienter med HUS/TTP som inte har en klar sjukdomsgenes vid debut av symtom. Vid misstanke om pneumokockassocierat HUS bör odlingar tas och analys av T-antigen på erytrocyter detekteras med lektinagglutination.
Om patienten inte har prodromala symtom som diarré eller har haft HUS/TTP tidigare eller om patienten har en familjemedlem med HUS/TTP bör en mer omfattande utredning göras avseende komplementdysfunktion och ADAMTS13-aktivitet enligt Tabell II. Det bör noteras att normal halt av C3, faktor H och faktor I inte utesluter mutation i komplementreglerare. Komplementhalt mäts på laboratorier för klinisk immunologi; faktor H mäts vid tex Klinisk immunologi, Universitetssjukhuset i Lund. ADAMTS13-aktivitet analyseras med olika metoder på koagulationslaboratorier. Analys av serumantikroppar mot E coli secreted protein B, faktor H-funktion, antikroppar mot faktor H och ADAMTS13-aktivitet samt samtliga genanalyser utförs vid artikelförfattarens laboratorium, Biomedicinskt centrum i Lund.
Omhändertagande och behandling
Patienter med njurpåverkan bör följas avseende vätskebalans, och intravenös vätsketillförsel ska ersätta förluster och perspiratio insensibilis (svett, andning). Akut njursvikt kan leda till rubbningar i syra–bas- och kaliumbalans samt högt blodtryck som bör behandlas, och dialys startas vid behov (tecken på hypervolemi, svår acidos, hyperkalemi, uremi). Vid EHEC-utlöst HUS kan patienterna kräva extra natriumtillförsel på grund av förlust via tarmen. Infusion av isotona lösningar tidigt i förloppet kan ha en njurskyddande effekt [36], men plasma är inte effektiv vid den sortens HUS.
Svåra tarmkomplikationer kan kräva total parenteral nutrition och eventuellt kirurgisk åtgärd. CNS-påverkan kan leda till krampanfall som behandlas enligt sedvanliga rutiner. Trombocyter ska inte ges rutinmässigt, eftersom dessa kan förvärra sjukdomen; de ges därför endast på vitalindikation, aktiv blödning eller inför kirurgiskt ingrepp om trombocythalten är 10109/l. Blodtransfusioner (leukocytbefriade erytrocyter) ges vid hemoglobin 60 g/l.
Antibiotikabehandling vid EHEC-utlöst HUS rekommenderas inte, eftersom bakterien kan frisätta mer toxin vid celldöd [37], men bör ges vid HUS utlöst av invasiv pneumokockinfektion.
Än så länge finns det inga specifika behandlingar vid trombotisk mikroangiopati, men om genesen är kartlagd kan behandlingen inriktas mer adekvat. Patienter med atypiskt HUS och TTP behandlas med plasmaferes för att byta ut en muterad eller dysfunktionell plasmafaktor [1]. Patienter med kongenital TTP orsakad av mutationer i ADAMTS13 kan vid skov behandlas med enstaka plasmainfusioner utan plasmabyte men kräver regelbundna infusioner av färskfrusen plasma, alternativt Octaplas (virusinaktiverad plasmapool), var 3–6 vecka för att förhindra recidiv. Eftersom det kan ta rätt lång tid att komma fram till orsaken bakom HUS eller TTP, rekommenderar man att snarast möjligt starta plasmabehandling på patienter med misstänkt atypiskt HUS eller TTP. Stora mängder plasma bör inte tillföras utan att man tar bort en del genom plasmaferes, eftersom patienter med nedsatt njurfunktion har ökad risk för överbelastning och lungödem.
Plasmabehandling eller plasmaferes fortgår tills trombocythalten normaliserats >150109/l i 2 veckor och hemolysen har upphört. Om man under tiden finner att patienten har en diagnos som inte svarar på plasmabehandling, tex bristfällig kobalaminmetabolism (som bör behandlas med hydroxikobalamin, folsyra och betain), eller om patienten utvecklar biverkningar som TRALI (transfusionsrelaterad akut lungskada), bör plasmabehandlingen avbrytas.
Mer specifika behandlingar för atypiskt HUS och TTP kan finnas i framtiden, tex faktor H- eller ADAMTS13-koncentrat. Dessa kommer dock inte att kunna användas effektivt på patienter med autoantikroppar som kan behandlas med rituximab (anti-CD-20-antikroppar) [38].
Eftersom de flesta studier tyder på en viktig roll för Shiga-toxin vid patogenesen av EHEC-utlöst HUS, testas olika behandlingar riktade mot toxinet i tarmen. Inga av dessa behandlingar har hittills kunnat förhindra att HUS utvecklas.
Transplantation
Patienter som utvecklar njursvikt kan återhämta njurfunktionen efter en period i dialys, men vid terminal njursvikt kan transplantation vara indicerad. Tyvärr finns det risk för återfall av grundsjukdomen i transplantatet hos patienter med atypiskt HUS. Risken är störst för patienter med faktor H- och faktor I-mutationer, där cirka 80–100 procent utvecklar recidiv efter transplantation, eftersom det muterade proteinet finns kvar i patientens cirkulation [4]. Patienter med MCP-mutationer löper betydligt mindre risk för återfall, eftersom MCP är cellbundet, och ett muterat protein bör inte finnas på transplantatets celler.
Risken för recidiv är lika stor om man tar njure från levande donator, men man bör utesluta mutationer hos besläktad tilltänkt givare. Eftersom komplementhämmare syntetiseras i levern, har man i enstaka fall utfört kombinerade lever- och njurtransplantationer med plasmaferes före och under operation med goda resultat [39, 40].
Prognos
Vid EHEC-utlöst HUS är prognosen god, och mortaliteten i västvärlden är 5 procent. Njurpåverkan kan bestå såsom proteinuri, kreatininstegring och högt blodtryck. Mortaliteten är mycket högre vid pneumokockutlöst HUS [11]. Patienter med atypiskt HUS utvecklar terminal njursvikt i cirka 50 procent av fallen, och mortaliteten är cirka 25 procent under det akuta förloppet. Patienter med MCP-mutationer har lättare sjukdom och är sällan dialyskrävande [4], medan prognosen är sämre hos patienter med faktor H-mutationer.
TTP är en mer systemisk sjukdom som kan drabba flera organ. Prognosen beror på vilka organ som drabbas; vissa patienter kan utveckla bestående epileptisk aktivitet eller påverkan i andra organ. Mortaliteten har minskat till 10 procent, eftersom de flesta patienter svarar på plasmabehandling.
Förebyggande behandling
EHEC-infektion kan förebyggas genom ökad hygien i hemmet. Kött bör vara välförberett och inte ätas rått, grönsaker bör sköljas ordentligt, och mjölk bör vara pastöriserad. Efter ett utbrott av EHEC i samband med intag av kallrökt korv har rekommendationerna för korvtillverkning reviderats [10]. Fall av EHEC-infektion ska smittskyddsanmälas för att förhindra sekundärspridning. Vid atypiskt HUS och TTP kan sjuklighet förebyggas i vissa fall genom regelbundna plasmabehandlingar (plasmaferes eller plasmainfusion) med färskfrusen plasma eller Octaplas.
Mer specifik behandling i framtiden
Under de senaste 10 åren har mycket kunskap vunnits kring patogenesen av både HUS och TTP. Genom adekvat diagnostik kan vi skilja mellan EHEC-utlöst HUS, atypiskt HUS och TTP och ge sakliga råd om behandling och transplantation. I framtiden kan den nya kunskapen också leda till mer specifika behandlingar.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Författarens forskning finansieras av Vetenskapsrådet, Kungliga Vetenskapsakademien, Stiftelsen Sven Jerrings Fond, Crafoordska stiftelsen, Sida/SAREC, Fonden för Njurforskning, Maggie Stephens stiftelse, Konung Gustav V:s 80-års fond, HKH Kronprinsessan Lovisas förening för barnsjukvård, Njurfonden, Magnus Bergvalls Stiftelse, Tobias Stiftelsen, Stiftelsen för blodsjukdomars bekämpande, Region Skåne och ALF-medel.
*
Docent Kerstin Westman, kliniken för njurmedicin och transplantation, Universitetssjukhuset MAS, Malmö, har granskat manuskriptet.