Sammanfattat
Humant cytomegalovirus (HCMV) finns latent hos mer än 70 procent av den vuxna svenska befolkningen.
Nedsatt immunförsvar och inflammation kan reaktivera latent HCMV, som i sin tur sannolikt kan bidra till att underhålla den befintliga inflammationen genom bla uppreglering av interleukin-6, interleukin-8, cyklooxygenas-2 och 5-lipoxygenas.
Aktiv HCMV-infektion hittas i den sjuka vävnaden hos en majoritet av patienter med ulcerös kolit, Crohns sjukdom, divertikulit och appendicit.
Om HCMV-infektionen är ett epifenomen eller spelar en kausal roll vid dessa sjukdomstillstånd är ofullständigt känt.
Det är fortfarande oklart om antiviral behandling generellt påverkar sjukdomsförloppet vid dessa inflammatoriska tarmsjukdomar.
Humant cytomegalovirus (HCMV) är ett av åtta kända humana herpesvirus och isolerades första gången 1956 från två spädbarn med kongenital HCMV-infektion. HCMV-mononukleos, som är HCMV-infektionens främsta kännetecken hos den immunkompetenta individen, beskrevs av Klemola och Kaarianinen 19 år senare. HCMV tillhör familjen betaherpesvirus, och liksom andra herpesvirus etablerar det en livslång latens efter primärinfektionen.
Redan vid 12 års ålder är mer än en tredjedel av svenskarna bärare av HCMV; denna tidiga spridning av HCMV sker sannolikt huvudsakligen via amning och daghemskontakt. Viruset sprids via samtliga kroppsvätskor såsom saliv, bröstmjölk och blod men även via organ- och benmärgstransplantat. Prevalensen ökar med stigande ålder, och i den vuxna populationen i Sverige är mellan 70 och 90 procent HCMV-infekterade [1].
HCMV-infektionen är hos den immunkompetenta patienten vanligtvis subklinisk, vilket har bidragit till att HCMV under många år inte ansetts vara ett patogen av signifikans. I slutet av 1900-talet, i takt med transplantationskirurgins framväxt och den ökande incidensen av aids, har HCMV framträtt som ett ansenligt hot, ledande till betydande morbiditet och mortalitet i dessa patientgrupper. Hos den immunsupprimerade patienten ger HCMV-infektionen ofta upphov till symtom som leukopeni, hepatit, interstitiell pneumoni och retinit [2, 3]. Efter primärinfektionen etablerar HCMV en livslång latens och kan reaktiveras under hela livet. HCMV har, i syfte att leva kvar i sin värd, utvecklat ett flertal strategier för att undvika att elimineras av immunförsvaret [4].
HCMVs påverkan på immunförsvaret
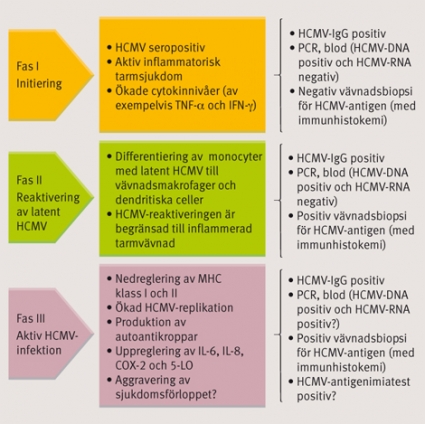
HCMV etablerar latens huvudsakligen i monocyter och kan replikera då dessa differentierar till makrofager, vilket sker tex i samband med inflammation. Denna differentiering drivs bla av interferon-(gamma) (INF-(gamma)) och tumor necrosis-alfa (TNF-(alfa)), cytokiner som secerneras av aktiverade T-celler. De exakta molekylära mekanismerna som leder till reaktivering av HCMV är dock fortfarande ofullständigt kända. Klinisk evidens talar för att en aktivering av immunförsvaret, exempelvis vid akut organrejektion som inkluderar aktivering av T-celler och frisättning av ovan nämnda cytokiner, faciliterar en reaktivering av latent HCMV.
För att kunna samexistera med sin värd har HCMV utvecklat sofistikerade mekanismer för att undkomma vårt immunförsvar men också för att använda sig av det för sin reaktivering och spridning. HCMV tros producera uppemot 250 olika proteiner, varav ca 50 är till för den essentiella replikationen. De resterande ca 200 proteinerna är sannolikt till för att modulera cellulära och immunologiska funktioner. HCMV kan undvika igenkänning och eliminering av såväl det adaptiva som det medfödda immunförsvaret (Figur 1).
HCMV och inflammatoriska sjukdomar
I analogi med att inflammation utgör en nyckelkomponent för reaktivering av HCMV har viruset upptäckts vid ett flertal inflammatoriska tillstånd. HCMV kan, som ovan beskrivet, interferera med vårt immunsystem, och därigenom tros HCMV kunna bidra till flera sjukdomar som kännetecknas av inflammation, tex ateroskleros, inflammatoriska tarmsjukdomar och cancer (Fakta 1) [3].
HCMV inducerar expression av ett flertal cytokiner och kemokiner i de celler viruset infekterar; bland dessa återfinns interleukin (IL)-1, IL-6, IL-8, IL-10, IFN-(beta), transforming growth factor-(beta) (TGF-(beta)), monocyte chemotactic protein-1 (MCP-1), macrophage inflammatory protein-1(alfa) (MIP-1(alfa)) och MIP-1(beta). Ett flertal av dessa är uppreglerade vid olika inflammatoriska sjukdomar, och ett ökat uttryck av dessa cytokiner och kemokiner har också sammankopplats med sjukdomsprognosen [3, 5].
Om en aktiv HCMV-infektion, som frekvent identifieras vid inflammatoriska sjukdomar, är en samvarierande faktor i patogenesen eller enbart ett epifenomen är fortfarande inte fullständigt klargjort. Det är dock tänkbart att dessa sjukdomar, med sin inflammatoriska komponent, förser HCMV med en adekvat miljö för reaktivering. HCMV kan vidare genom sin påverkan på immunsystemet bidra till att underhålla inflammationen och skydda de defekta cellerna från immunsystemet och därigenom bidra till sjukdomspatologin. HCMV-infektionen är i dessa fall begränsad till den inflammatoriska miljön.
Ulcerös kolit och Crohns sjukdom
Ulcerös kolit och Crohns sjukdom är inflammatoriska tarmsjukdomar (IBD) med komplex genes. En initial skada på mukosabarriären resulterar, hos genetiskt predisponerade individer, i ett oproportionerligt kraftigt inflammatoriskt svar. Hos patienter med ulcerös kolit är inflammationen kontinuerlig i kolon och engagerar enbart slemhinnan.
Patienter med Crohns sjukdom uppvisar i stället en diskontinuerlig, transmural inflammation som kan engagera hela mag– tarmkanalen. IBD kännetecknas av skovvisa aggraveringar av inflammation som gestaltas av hög frekvens av slem- och/eller blodtillblandade diarréer [6,7]. Dessa patienter är vidare ofta immunsupprimerade på grund av behandling med azatioprin, anti-TNF-(alfa) och/eller kortikosteroider, vilket potentierar HCMVs möjliga roll i patogenesen. Att dessa behandlingar i längden kan leda till reaktivering av HCMV och HCMV-associerade komplikationer har belysts i flera fallrapporter [8, 9].
Redan 1961 rapporterade Powell om HCMV-inklusionskroppar hos en patient med ulcerös kolit. Sedan dess har ett flertal rapporter om HCMVs association med ulcerös kolit och Crohns sjukdom publicerats. Prevalensen av HCMV-infektion har varierat mellan 0,5 och 100 procent i de olika studierna. Denna stora variation har sin sannolika grund i användning av olika metoder för verifiering av förekomst av HCMV, diskrepans mellan de undersökta patientgrupperna samt undersökning av relativt få patienter i respektive studie [10]. Studier som har använt sig av immunhistokemi, in situ-hybridisering och/eller PCR för detektion av HCMV rapporterar en högre prevalens av virusinfektion än studier som använt enbart histologisk undersökning. Vidare varierar sannolikt prevalensen av HCMV-infektion med sjukdomsaktiviteten, vilket stöds av att studier som undersökt förekomst av infektion hos patienter med aktiv IBD rapporterar den högsta prevalensen.
När det gäller förekomst av HCMV i biopsier från patienter med aktiv ulcerös kolit respektive Crohns sjukdom har denna undersökts i flera studier. I en studie av Wakefield [11] konstaterades HCMV-DNA hos 81 procent av patienterna med ulcerös kolit och hos 66 procent av patienterna med Crohns sjukdom med hjälp av PCR. I vår studie fann vi med hjälp av in situ-hybridisering att 92,3 procent av patienterna med ulcerös kolit hade HCMV-DNA i tarmvävnad, medan motsvarande siffra för patienter med Crohns sjukdom var 100 procent [7]. Med hjälp av immunhistokemifärgning detekterades aktiv HCMV-infektion hos 85 procent av patienterna med ulcerös kolit och hos alla patienter med Crohns sjukdom. Fynd från vår studie visar att förekomst av aktiv HCMV-infektion i tarmen hos IBD-patienter är betydligt mer vanligt förekommande än vad man tidigare har trott. Vidare detekterades inflammatoriska celler, dubbelfärgade för HCMV och IL-6, hos 77 procent av patienterna med ulcerös kolit och hos alla patienter med Crohns sjukdom [7].
Vår senaste studie visar dessutom på ökat uttryck av 5-lipoxygenas (5-LO) hos IBD-patienter. 5-LO är ett enzym som behövs för syntes av den kraftigt kemotaktiska och immunmodulerande leukotrienen B4 (LTB4). LTB4 är viktig för de vita blodkropparnas förflyttning över kärlväggarna i skadad och inflammerad vävnad. Uttrycket av 5-LO och IL-6 i HCMV-infekterade celler i tarmvävnad hos IBD-patienter kan förklara HCMV-inducerad patogenes och immunmodulation i denna patientpopulation [12] (Figur 2).
Både ulcerös kolit och Crohns sjukdom är associerade med ökad risk för kolorektala maligniteter. HCMV har detekterats i hög frekvens i kolorektala polyper och i kolorektala adenokarcinom. I koloncancercellinje uppreglerar HCMV-infektion expressionen av cyklooxygenas-2 (COX-2) och Bcl-2, vilka tros spela en viktig roll i utvecklingen av koloncancer [13]. I och med HCMVs potentiella onkomodulatoriska kapacitet och frekventa förekomst hos patienter med ulcerös kolit och Crohns sjukdom är aktiv behandling av HCMV-infektioner i dessa patientgrupper av potentiellt stor betydelse.
Huruvida den HCMV-infektion som påvisas vid ulcerös kolit och Crohns sjukdom utgör en prognostisk faktor är fortfarande oklart. Vidare är det också svårt att, baserat på de studier som finns, dra en slutsats om huruvida antiviral behandling i form av aciklovir eller ganciklovir är av kliniskt värde för dessa patienter [10]. Det finns dock ett flertal fallbeskrivningar som rapporterar positiva effekter på sjukdomsförloppet vid insättning av HCMV-inriktad antiviral behandling [14-16]. En större klinisk studie inriktad på effekterna av antiviral behandling av patienter med ulcerös kolit samt Crohns sjukdom behövs dock för att definitivt besvara denna viktiga fråga.
Akut appendicit
Akut appendicit är den vanligaste kirurgiska diagnosen hos barn. Trots detta är patogenesen vid akut appendicit ofullständigt känd. Obstruktion av det appendikulära lumen, som initierar den inflammatoriska reaktionen, anses dock utgöra ett nyckelsteg i utvecklingen av akut appendicit. IL-6 är en proinflammatorisk cytokin som har sammankopplats med akut appendicit. Polymorfism av IL-6-genen, ledande till ökad IL-6-produktion, har associerats med komplikationer till akut appendicit, såsom gangrän eller perforation. Vidare har serumnivåer av IL-6 och IL-8 korrelerats till svårighetsgraden av akut appendicit, något som stärker dessa cytokiners signifikans i patogenesen av akut appendicit [17].
HCMV är känt för att kunna orsaka infektion i ett flertal organ hos immunsupprimerade patienter. I denna patientgrupp har HCMV, enligt flera fallstudier, även visats orsaka akut appendicit [18]. När det gäller immunkompetenta individer har HCMV-infektion som kausal faktor till akut appendicit beskrivits vid enbart två tillfällen [19].
Vi har identifierat en aktiv HCMV-infektion i appendix hos 64,3 procent av patienter med akut appendicit. En latent HCMV-infektion, baserad på serologistatus och förekomst av HCMV-DNA i appendix, identifierades hos 78,6 procent av patienterna med akut appendicit. Vidare kunde vi med dubbelfärgning påvisa att HCMV-infekterade celler i appendix uttryckte IL-8 och IL-6. I enlighet med detta har HCMV i in vitro-studier visats inducera produktion av IL-8 [20] och IL-6 [21]. Vår studie visar att HCMV är associerat med akut appendicit (P=0,002) hos den immunkompetenta patienten och att HCMV möjligtvis bidrar till progressen av akut appendicit genom att inducera produktion av den proinflammatoriska cytokinen IL-6 och kemokinen IL-8. Detta öppnar potentiellt för ny farmakologisk behandling av denna patientgrupp.
Divertikulit
Divertiklar uppstår till följd av försvagningar av kolonväggen. Prevalensen i västvärlden, där man kan identifiera divertiklar hos ca 50 procent av befolkningen över 60 år, är hög [22]. Genesen är inte fullt klarlagd, men det finns belägg för att ett lågt intag av fibrer spelar en signifikant roll. Detta tros bidra till den mikroskopiska inflammation som kännetecknar divertikulos genom att inhibera motilitet och ändra bakteriefloran. Hos 10–20 procent av divertikulospatienterna sker en progress till divertikulit, dvs en inflammation av divertiklarna, vilket i svårare fall kan resultera i perforation [23].
I vår studie identifierade vi förekomst av aktiv HCMV-infektion i kolon hos 69,6 procent av patienterna med divertikulit (Figur 3). 18 procent av dessa patienter var anti-HCMV-IgG- och anti-HCMV-IgM-positiva, de övriga var endast anti-HCMV-IgG-positiva [24]. Vår studie är enligt vår kännedom den första som identifierar en association mellan HCMV-infektion och divertikulit. Med visshet om HCMVs många immunmodulatoriska funktioner, såsom IL-6-, IL-8-, COX-2- och 5-LO-induktion, beskrivna ovan, är det möjligt att HCMV fungerar som en aggraverande faktor i divertikulitprogressen, i synnerhet i den immunkomprometterade patientgruppen där HCMV utgör en ytterst signifikant patogen.
Slutsatser
Aktiv HCMV-infektion är associerad med olika inflammatoriska tillstånd i tarmen såsom ulcerös kolit, Crohns sjukdom, akut appendicit och divertikulit och kan potentiellt bidra till progressen av dessa sjukdomstillstånd genom uppreglering av de proinflammatoriska 5-LO, COX-2, IL-6 och IL-8. Om HCMV-infektionen vid dessa sjukdomar enbart utgör ett epifenomen eller om den har en kausal roll i patogenesen av dessa inflammatoriska tillstånd återstår dock att visa. Antiviral behandling mot HCMV har i flera fallrapporter visats ha en positiv effekt på inflammatoriska tarmsjukdomar. Det är dock fortfarande ofullständigt klarlagt huruvida antiviral behandling generellt har effekt på progressen av dessa tarmsjukdomar.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Forskningsstöd har erhållits från Svenska Läkaresällskapet, Bengt Ihres fond, Karolinska institutet, Stiftelsen Goljes Minne, Ruth och Richard Julines Fond, AstraZeneca och Tore Nilsons Stiftelse för Medicinsk Forskning.