Sammanfattat
Inom stamcellsforskningen har det den senaste tiden publicerats en rad epokgörande upptäckter, som förändrar vår syn på celldifferentiering.
Dessa upptäckter öppnar nya möjligheter att från differentierade celler »backa« differentieringen till ett mycket mer omoget cellstadium, liknande stadiet i embryonala stamceller (ES-celler).
Dessa upptäckter kan komma att få stor betydelse för cellterapi och regenerativ medicin.
Förra året publicerades flera viktiga rapporter inom stamcellsforskningen. De öppnar helt nya möjligheter för att odla fram stamceller och ställer viktiga frågor om de molekylära processer som driver celldifferentieringen. Två av studierna, från Shinya Yamanakas och James Thomsons forskargrupper, visar att differentierade humana celler kan reverteras till ett mycket mer omoget cellstadium, som liknar det som normalt återfinns i celler från det tidiga preimplantationsembryot [1, 2]. I en tredje studie beskriver Shoukhrat Mitalipovs forskargrupp att klonade embryonala stamcellslinjer kan skapas från apor, efter det att cellkärnan bytts ut i befruktade ägg och cellkärnan från en vuxen apa införts [3].
Styrning av stamceller centralt forskningsområde
Stamcellsforskning är ett forskningsområde som utvecklats snabbt och har rönt stor uppmärksamhet de senaste åren, framför allt därför att stora förhoppningar har väckts om att man i framtiden ska kunna använda stamceller för att ersätta förlorade celler i olika organ genom transplantation, tex vid Parkinsons sjukdom eller diabetes.
Stamceller är omogna celler, som kan differentiera till en eller flera specialiserade celltyper, samtidigt som de vid celldelning också skapar flera nya stamceller (det så kallade self-renewal-begreppet). Denna balans mellan produktion av både differentierade celler och nya stamceller är viktig, både för att få fram rätt antal mogna celler vid rätt tidpunkt och för att samtidigt se till att kroppen vidmakthåller en reserv av stamceller för nybildning av celler vid senare tillfällen.
Att förstå de molekylära program som styr stamcellers utmognad till olika differentierade celltyper är ett centralt forskningsområde, särskilt när det gäller celltyper av stor medicinsk relevans, tex dopaminproducerande nervceller och insulinproducerande beta-celler för möjlig framtida transplantation vid Parkinsons sjukdom och diabetes [4].
Pluripotenta ES-celler kan bilda alla organ
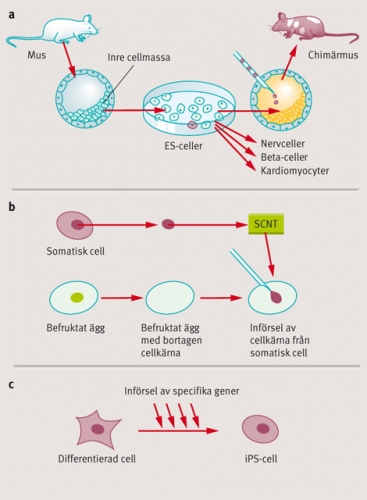
En stamcellstyp som tilldragit sig speciellt intresse som utgångsmaterial för riktad differentiering och transplantation, är de så kallade embryonala stamcellerna (ES-celler). Martin Evans visade i början på 1980-talet att ES-celler kunde bildas från celler ur den inre cellmassan hos preimplantationsembryon (blastocyster) från möss [5]. Evans visade att ES-cellerna var pluripotenta och kunde hållas odifferentierade i cellodling, samtidigt som de kunde bilda alla olika organ och vävnader om de återfördes in i ett tidigt musembryo (Figur 1 a). ES-cellernas förmåga att bilda alla olika celltyper är en av hörnstenarna i framställningen av genetiskt modifierade möss, så kallade knockoutmöss, och för sin upptäckt av ES-cellerna utsågs Martin Evans till en av förra årets tre Nobelpristagare i medicin eller fysiologi [6].
Efter dessa initiala upptäckter har metoderna för att styra odlade ES-celler till att bilda olika differentierade celltyper snabbt utvecklats, och år 1998 visade James Thomson att ES-celler kunde framställas även från människa [7]. Humana ES-celler framställs av »överblivna« preimplantationsembryon som tillkommit genom in vitro-fertilisering (IVF), där föräldrarna redan fått de barn de önskat genom behandlingen. Det faktum att befruktade mänskliga ägg används för framställning av ES-celler har i många länder lett till en omfattande etisk debatt.
ES-cellernas stora differentieringspotential och vår ökande kunskap om hur vi kan differentiera dem ex vivo i cellodling, gör dem attraktiva som celler för transplantation inom regenerativ medicin. Liksom vid all annan organ- och celltransplantation, kvarstår dock problemen med avstötning av de transplanterade cellerna, och för att minimera dessa problem är det önskvärt att försöka få fram celler som är så »patientlika« som möjligt. Det faktum att humana ES-celler odlas i cellkultur före en eventuell transplantation, öppnar möjligheter att på olika sätt förändra dem för att göra dem mer patientlika, eller i det ideala fallet »patientidentiska«. En attraktiv möjlighet att åstadkomma detta vore att byta ut stamcellens cellkärna mot en cellkärna från patienten, och en rad upptäckter, inklusive Mitalipovs nya rapport i Nature [3], visar att detta kanske är en framkomlig väg. Framgångsrik överföring av en cellkärna från ett vuxet djur till en befruktad äggcell där cellkärnan tagits bort, utfördes första gången 1958 på grodor av den engelska forskaren John Gurdon [8]. Tekniken kallas »somatisk kärnöverföring« (SCNT, somatic cell nuclear transfer) (Figur 1 b), och Gurdon visade att en ny groda kunde utvecklas från äggcellen som genomgått kärnöverföringen.
Lade grunden till kloning av djur
Detta experiment lade grunden till kloning av djur och var konceptuellt mycket viktigt, därför att det visade att en cellkärna från en vuxen cell kunde omprogrammeras med avseende på epigenetisk status och genuttryck, så att cellkärnan kunde driva igång utvecklingen av en ny individ. År 1996 skapades sedan fåret Dolly på liknande sätt genom SCNT, och det var första gången ett däggdjur klonats [9]. För några månader sedan togs så nästa steg i utvecklingen, då SCNT visade sig fungera även inom primatlinjen. Mitalipovs forskargrupp rapporterade att de kunde framställa ES-celler från ett befruktat makakägg, där cellkärnan tagits bort och ersatts med en cellkärna från en nioårig makakhane [3]. Det bör dock betonas att denna teknik ännu så länge är mycket ineffektiv – efter att ha startat med mer än 300 ägg, lyckades Mitalipovs forskargrupp enbart ta fram två ES-cell-linjer från dem. Orsaken till denna låga effektivitet är ännu okänd, men det gör självfallet tekniken mer begränsad när det gäller att framställa humana ES-celler med utbytta cellkärnor.
SCNT-tekniken och det faktum att hela djur kan utvecklas från de äggceller där SCNT genomförs, visar på ett mycket påtagligt sätt att en somatisk cellkärna har hela sitt genmaterial intakt, och kan omprogrammeras till att efterlikna och fungera som den cellkärna som ursprungligen satt i den befruktade äggcellen. Många forskare började därför fundera på om cellkärnan i en differentierad cell på något sätt kunde »backas« i sin utveckling till att bli mer lik kärnan i ett embryo, utan att behöva flyttas in i ett befruktat ägg – med andra ord, kunde den differentierade cellen på något sätt »embryonaliseras«? Det är också känt att andra arter, exempelvis amfibier, har en mycket mer välutvecklad förmåga att regenerera organ och vävnader, genom en process där celler i det skadade området först dedifferentierar.
Uppseendeväckande enkelt
Samtidigt antog man allmänt att en dylik dedifferentieringsprocess på cellulär nivå hos däggdjur skulle vara mycket komplex, och inbegripa stora epigenetiska omprogrammeringar och förändrad reglering i många olika gener. Yamanakas forskargrupp visade dock i ett mycket uppmärksammat arbete 2006 att introduktion av endast fyra gener (transkriptionsfaktorgenerna Oct3/4, Sox2, c-Myc och Klf4) kunde omvandla adulta musfibroblaster till en ES-cell-lik celltyp, som kallades iPS (induced pluripotent stem cell) [10] (Figur 1 c). I ett uppföljande arbete visade Yamanaka också att iPS-cellerna, på samma sätt som ES-celler, kunde ge upphov till alla vävnader och organ då de återintroducerades i ett tidigt musembryo [11]. Det mest uppseendeväckande med dessa arbeten är att dedifferentieringsprocessen var så till synes enkel: att det räckte med att endast införa fyra olika gener för att omprogrammera cellen till ett tidigt embryonalt tillstånd.
I november 2007 visade två publikationer från James Thomsons och Shinya Yamanakas laboratorier oberoende av varandra att man kan omprogrammera differentierade epitelceller från hud till iPS-celler också hos människa [1, 2]. Både Thomson och Yamanaka använde sig av fyra olika gener för att uppnå dedifferentiering, men de använde delvis olika gener. Medan Yamanaka använde samma fyra gener som i musexperimenten, dvs Oct3/4, Sox2, c-Myc och Klf4, använde Thomson en delvis annorlunda genkvartett (Oct4, Sox2, Nanog och Lin28). Detta är av stort intresse, då det antyder att det finns vissa frihetsgrader när det gäller vilken kombination av gener man kan använda för att »backa« differentieringen.
Öppnar helt nya möjligheter
Dessa fynd förändrar vårt sätt att se på hur celldifferentiering går till. Vi är ju vana vid att se vår egen utveckling på individnivå som linjär, från odifferentierade till differentierade celler, men dessa nya data visar att mänskliga celler under vissa omständigheter också kan reversera denna process, och att detta kan åstadkommas med hjälp av endast några få gener och experimentellt ganska enkla tekniker. Fynden öppnar potentiellt helt nya möjligheter inom stamcellsforskning och regenerativ medicin, då framtagandet av patientegna celler med ES-cell-liknande egenskaper helt plötsligt blivit en realistisk möjlighet. Sådana celler skulle vara mycket viktiga, både som utgångsmaterial för riktad differentiering till olika celltyper i cellodling, och för att kunna studera cellulära differentieringsförlopp i celler från patienter med olika sjukdomar. Att ta fram iPS-celler kringgår också de etiska problem som är associerade med framställning av ES-celler från ägg som befruktats genom IVF.
Anledning se hoppfullt på framtiden
Det är dock viktigt att poängtera att det finns tekniska problem som måste lösas innan iPS-celler, eller ES-celler, kan komma i fråga för klinisk användning inom regenerativ medicin. Först och främst har forskarna hittills använt sig av retrovirala vektorer för att föra in generna i den vuxna cellens arvsmassa och ta fram iPS-celler, och detta är en riskfaktor i sig, då virala insertioner i genomet kan ge upphov till tumörutvecklande celler efter transplantation. Vidare har i flera av experimenten den potenta proto-onkgenen c-Myc använts som en av de fyra introducerade generna, och det visade sig också att tumörer bildades i de möss som framställdes med hjälp av iPS-celler där c-Myc introducerats [11]. Thomsons rapport visar dock att c-Myc kan uteslutas från den »magiska kvartett« av gener som behövs i dedifferentieringsprocessen [2]. Ytterligare forskning krävs för att lösa dessa tekniska problem, men det ska inte förringa vidden av de nya upptäckterna, och det finns anledning att se hoppfullt på framtida möjligheter inom regenerativ medicin och cellterapi med anledning av de genombrott i forskningen om iPS-celler som gjorts på senare tid.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.