Sammanfattat
Human epidermal growth factor receptor 2 (HER2) är en tyrosinkinasreceptor som förekommer överuttryckt i ca 15– 20 procent av invasiv bröstcancer och medför ökad risk för återfall i sjukdomen.
HER2-status kan bestämmas immunhistokemiskt på proteinnivå eller med fluorescent in situ-hybridisering (FISH), som påvisar antalet genkopior. Analysen bör ingå vid rutindiagnostik av bröstcancer.
Svenska HER2-analysgruppen utförde under 2005 och 2006 en reproducerbarhetsstudie av HER2-status genom att distribuera elva bröstcancerfall till patologlaboratorier i Sverige som rutinmässigt utför HER2-analyser.
Resultaten visar att reproducerbarheten av HER2-status var god (2005) respektive mycket god (2006) för immunhistokemi och mycket god för FISH vid båda undersökningstillfällena.
Omkring 7000 svenska kvinnor får årligen diagnosen bröstcancer, och på grund av tidig upptäckt, bla genom hälsokontroll med mammografi, kan två tredjedelar av patienterna botas med lokal behandling (kirurgi och eventuell strålbehandling). Adjuvant systembehandling förhindrar återfall i sjukdomen hos ungefär 15–20 procent av patienterna. Uppskattningsvis får därmed var sjätte kvinna med tidig bröstcancer recidiv inom tio år. Den adjuvanta behandlingen kan vara cytotoxisk, endokrin eller antikroppsbaserad, och i dag ges ofta kombinationsbehandling med två eller flera modaliteter.
För att välja individualiserad och skräddarsydd behandling för den enskilda patienten används prognostiska faktorer som delar in patienterna i olika riskgrupper och behandlingsprediktiva faktorer för att välja den lämpligaste terapiformen. Allmänt vedertagna prognostiska faktorer är ålder, lymfkörtelstatus, tumörstorlek och histologisk grad, medan förekomst av östrogen- (ER) och progesteronreceptorer (PgR) huvudsakligen används för att bedöma känslighet för endokrin behandling [1], http://www.swebcg.roc.se/ .
HER2-status analyseras rutinmässigt
Överuttryck av tillväxtfaktorreceptorn human epidermal growth factor receptor 2 (HER2) eller ett ökat antal kopior av HER2-genen (amplifiering) i tumörcellerna korrelerar med en aggressiv form av bröstcancer och därmed med försämrad prognos (Fakta 1) [2-6]. Andelen HER2-positiva bröstcancrar varierar i litteraturen mellan 10 och 30 procent [2-6]. Dessa siffror baseras på selekterade patientmaterial, eftersom det saknas publicerade resultat från populationsbaserade material analyserade med standardiserad metod.
Den största kliniska betydelsen har dock HER2 som behandlingsprediktiv faktor för effekten av målstyrd antikroppsbehandling med trastuzumab (Fakta 2). Därför rekommenderar Svenska bröstcancergruppen sedan 2005 att HER2 ska analyseras rutinmässigt i samtliga nydiagnostiserade bröstcancerfall i Sverige. Introduktionen av HER2-analys på ett standardiserat sätt har tidigare beskrivits i Läkartidningen [7].
För patienter med HER2-positiva tumörer är effekten av trastuzumab mycket god, både vid adjuvant behandling av primär bröstcancer efter kemoterapi med riskreduktion av återfall med nästan 50 procent redan efter ett års uppföljning [8] och vid palliativ behandling av metastaserande sjukdom [9] liksom vid lokalt avancerad bröstcancer [10]. För patienter med normalt uttryck av HER2 i sina tumörer är behandling med trastuzumab inte meningsfull. Det är därför av stor vikt för såväl patienten som sjukvårdsekonomiskt att analys av HER2 utförs med god kvalitet och enligt standardiserade protokoll på samtliga patologiavdelningar som utför HER2-analys. Internationellt bedrivs intensivt kvalitetsarbete kring validering och reproducerbarhet av HER2-analys genom referenslaboratorier och utbyte av bröstcancerpreparat för bedömning (»slide-exchange rings«) [11-16].
Vår artikel presenterar ett kvalitetssäkringsarbete av reproducerbarheten vid svenska patologlaboratorerier som rutinmässigt utför HER2-bedömning. Målsättningarna med detta arbete var att
utvärdera reproducerbarheten mellan 24 av totalt 26 patologavdelningar i Sverige med avseende på HER2-analys (färgning och bedömning) av primär bröstcancer
med hjälp av en enkät ta reda på andelen HER2-analyserade fall och bedömningsutfallet vid respektive avdelning.
STUDIEUPPLÄGG OCH METODER
Reproducerbarhetsundersökningen
Elva bröstcancertumörer preparerades vid avdelningen för patologi och cytologi i Malmö i en tissue microarray med två biopsier, diameter 1,0 mm, från varje tumör (Fakta 3) vid två tillfällen (2005 och 2006). Snitt från dessa skickades från Malmö till 25 patologavdelningar i Sverige. Proven placerades i olika ordning på vävnadsmatrisen vid de två tillfällena, och 2006 togs ytterligare ett prov med. De övriga deltagande avdelningarna hade ingen kännedom om att det var samma fall som skickades ut.
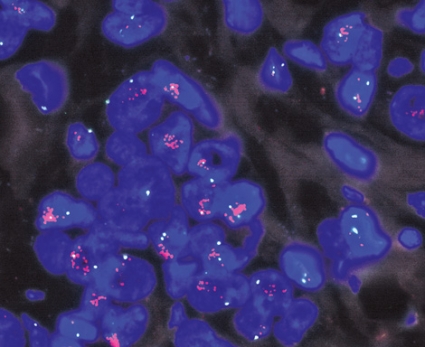
Enbart de 24 avdelningar som deltog båda åren är med i nedanstående redovisning av reproducerbarheten. Fallen var utvalda så att de representerade olika nivåer av HER2-innehåll. Alla 24 avdelningarna färgade och analyserade proven själva med immunhistokemi (analys av proteinuttrycket med hjälp av antikroppar), medan inmärkning och analys av antal genkopior (amplifieringsgrad) med FISH (Fakta 4) enbart utfördes vid de elva avdelningar som rutinmässigt använder denna metod. Svenska HER2-analysgruppen, som bildades 2001 [7], har utarbetat riktlinjer för hur analys och bedömning ska göras. Dessa riktlinjer finns på http://www3.svls.se/sektioner/pa/HER2rekommendation.doc och innebär bla att fall som bedöms som 0 eller 1+ med immunhistokemi betraktas som HER2-negativa, medan de som är 2+ eller 3+ (Figur 1) även ska analyseras med FISH (Figur 2) för att utreda om provet är amplifierat eller inte. Varje avdelning använde sin rutinmetod enligt nedanstående.
Den immunhistokemiska undersökningen utfördes med FDA- (Food and Drug Administration)godkända antikroppar och enligt tillverkarnas instruktioner, inkluderande positiva och negativa kontroller. HercepTest (Dako) och Pathway (Ventana) var de testkit som användes av flest laboratorier.
FISH-testning utfördes med FDA-godkända metoder (prober), där PatVysion (Vysis/Abbot) var den metod som flest laboratorier utnyttjade, men även andra metoder användes (INFORM HER-2/neu från Ventana och HER2 FISH pharmDx från Dako). Laboratorierna följde tillverkarnas instruktioner, som inkluderade användning av positiva och negativa kontroller. När metoden innehöll en separat prob för HER2-genen och kromosom 17 grundade sig bedömningen på kvoten mellan antal infärgade genkopior och antal kromosomer (HER2:CEP17). Om kvoten var högre än 2 bedömdes provet som amplifierat. I de fall metoden inte hade separat kromosomprob bedömdes provet som amplifierat om det innehöll fler än sex genkopior (vanligen är amplifieringen tydlig med många genkopior i kluster) (Figur 2).
I studien är reproducerbarheten mätt med kappa-statistik, en analys som innebär att man kompenserar för den slumpmässiga överensstämmelsen [17].
Enkäten
På det utskickade formuläret fanns frågor angående andelen HER2-analyserade fall av primär bröstcancer som diagnostiserats under 2006 vid respektive avdelning; andelen 0/1+, 2+ och 3+ samt andelen amplifierade 2+ respektive 3+. Enkätsvaren baserades på avdelningarnas egen rapportering, som inte var enhetlig på grund av olika grad av datorisering av provsvar. Det framkom dessutom att analysrutinerna varierade, och några sjukhus analyserade 2+ och 3+ med FISH endast då resultatet skulle påverka val av adjuvant behandling. HER2-analys gjordes inte rutinmässigt på patienter över 70 år vid vissa avdelningar. Det antal avdelningar som resultatgenomgången är baserad på är noterat nedan.
RESULTAT
Beträffande immunhistokemi rapporterade samtliga 24 avdelningar som deltog vid båda utskicken samma bedömningsresultat (0/1+ vs 2+/3+) för fem (2005) respektive sju (2006) av de elva fall som skickades ut båda åren. För fyra (2005) respektive tre (2006) av de resterande fallen var det bara en avdelning som rapporterade avvikande bedömning. Medelkappavärdet ökade från 0,79 (2005) till 0,86 (2006), vilket indikerar att överensstämmelsen, utöver vad som förväntas av slumpen, har förbättrats från bra till mycket bra. Medelkappavärdet för varje enskild avdelning varierade mellan 0,43 och 0,86 år 2005 och mellan 0,54 och 0,89 år 2006.
De elva avdelningar som använder FISH rapporterade samma resultat (amplifierat vs inte amplifierat) i nio (2005) respektive tio (2006) av de elva fallen. Medelkappavärdet uppvisade mycket god reproducerbarhet både 2005 och 2006 (0,92 och 0,96). Detta värde varierade för avdelningarna mellan 0,80 och 0,96 år 2005 och mellan 0,82 och 0,98 år 2006. Vid de patologavdelningar som angav både totalantalet nya bröstcancrar och antalet HER2-analyserade fall under 2006 utgjorde andelen HER2-analyserade fall 90 procent av det totala antalet diagnostiserade bröstcancerfall.
Vad gäller utfall för immunhistokemi rapporterade 25 avdelningar totalantalet HER2-analyserade bröstcancerfall, diagnostiserade 2006 (n=4940) liksom bedömningsutfallet. Andelen 0/1+ var 69 procent (3392/4940), andelen 2+ 20 procent (1009/4940) och andelen 3+ 11 procent (539/4940). Andelen rapporterade 0/1+ varierade mellan 58 och 84 procent för olika avdelningar, och motsvarande siffror för 2+ var 8–27 procent och för 3+ 7–15 procent.
19 avdelningar analyserade alla tumörer som bedömts som 2+ immunhistokemiskt med FISH. För dessa var andelen amplifierade fall 12 procent (95/778). Andelen amplifierade 2+ varierade mellan dessa avdelningar. Exempelvis hade en avdelning inget amplifierat fall bland 38 tumörer bedömda som 2+, medan en annan avdelning hade elva amplifierade av 46 fall bedömda som 2+. För 3+ var amplifieringsgraden 90 procent (326/364; 17 avdelningar) och varierade mellan 75 och 100 procent. Med krav på FISH-analys av samtliga 3+ erhölls nödvändig information från 15 avdelningar med sammanlagt 3109 nydiagnostiserade bröstcancrar under 2006. Av dessa var 410 amplifierade (13 procent).
DISKUSSION
Artikeln beskriver reproducerbarheten av HER2-analys av elva bröstcancertumörer på en tissue microarray, distribuerad till 24 patologavdelningar i Sverige vid två tillfällen (2005 och 2006). I studieupplägget ingick även att laboratorierna fick preparera glasen med den metod för immunhistokemi eller FISH som rutinmässigt används.
God till mycket god reproducerbarhet
Reproducerbarheten av bedömningen var god (kappa = 0,61– 0,80) till mycket god (kappa = 0,81–1,00) för såväl immunhistokemi som FISH [17]. Eftersom samma tumörvävnad skickades ut till de deltagande avdelningarna vid båda bedömningstillfällena är det möjligt att jämföra resultaten över tid. Resultaten visar en tendens till förbättring av överensstämmelse mellan laboratoriernas bedömning med tydlig indikation på att kvalitetssäkringsarbete lönar sig.
Reproducerbarheten är alltså överlag god/mycket god, men undersökningen visar också att klassifikationen HER2-positiv (2+/3+) respektive HER2-negativ (0/1+) för enstaka avdelningar avviker från majoritetens bedömning i upp till tre av de elva fallen. Avvikelserna är ett observandum som vid upprepning får följas upp med genomgång av analysrutinerna för immunhistokemi. För FISH var överensstämmelsen genomgående mycket god, vilket är i enlighet med internationell erfarenhet där reproducerbarheten för FISH är betydligt bättre än för immunhistokemi utanför referenslaboratorier [13].
Variationer får utredas vidare
Under 2006 skickades även ut en enkät för att bla få svar på produktion och bedömningsutfall vid klinisk rutindiagnostik för de deltagande patologlaboratorierna, eftersom HER2-analys enligt Svenska bröstcancergruppens riktlinjer bör utföras på all nydiagnostiserad bröstcancer. 90 procent av samtliga nydiagnostiserade bröstcancerfall under 2006 analyserades med avseende på HER2-status (baserat på svar från 23 avdelningar). Resultaten från enkäten visar därför att HER2-analys snabbt implementerats i rutindiagnostiken för primär bröstcancer i Sverige.
Att inte alla fall analyserades angavs bero på att vissa sjukhus inte analyserade HER2 i tumörer från patienter äldre än 70 år eller vid lymfkörtelnegativ bröstcancer, eftersom det inte skulle påverka val av adjuvant behandling. Enligt enkäten bedömdes 69 procent som 0/1+, 19 procent som 2+ och 12 procent som 3+ av totalt 4940 HER2-analyserade fall från de rapporterande avdelningarna. Bedömningsutfallet som rapporterades i enkäten varierade mellan de individuella avdelningarna, vilket kan bero på en selektion av patientgrupper med hög risk för HER2-positivitet vid vissa laboratorier eller på att tumöregenskaper varierar mellan olika delar av Sverige. Det kan dock inte uteslutas att analys- och/eller bedömningsmässiga skillnader föreligger när HER2-bedömningen utförs rutinmässigt – i motsats till resultaten från de elva brösttumörer som skickades ut för reproducerbarhetskontroll. Orsaken till denna variation i bedömningsutfallet mellan avdelningarna behöver utredas mer.
Kvalitetsregister och sjukhusjämförelser
Det nationella kvalitetsregistret för bröstcancer kommer att medföra att jämförelse mellan olika sjukhus i Sverige med avseende på patologiska och tumörbiologiska faktorer (lymfkörtelstatus, tumörstorlek, histologisk grad, ER och PgR) kan utföras prospektivt. Jämfört med tidigare publicerade siffror är andelen amplifierade bröstcancrar i enkätdelen av studien lägre, 15 procent jämfört med 25–30 procent, vilket kan förklaras av att tidigare undersökningar bara inkluderat selekterade patienter [2, 3]. Metoden för undersökningen med självrapporterad enkät tillåter dock inte några säkra slutsatser. Konsekutiva, populationsbaserade analyser som möjliggörs genom rikstäckande register kommer i framtiden att bidra till viktig kunskap om HER2-status.
Konklusion
Sammanfattningsvis pekar denna undersökning på att reproducerbarheten av HER2-analys är mycket god mellan patologavdelningarna i Sverige. Eftersom HER2 i dag är en central tumörbiologisk markör i klinisk bröstcancerdiagnostik, framförallt för bedömning av känslighet för antikroppsbehandling med trastuzumab, men även för att bedöma risken för återfall (prognostisk faktor), är fortsatt kvalitetssäkringsarbete mycket viktigt såväl för patienten som rent sjukvårdsekonomiskt.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Arbetsgruppen för Svenska HER2-analysgruppen doc Thomas Hatschek, Radiumhemmet, Karolinska Universitetssjukhuset Solna, leg BMA Aleksandra Kolaric, kliniken för patologi, Universitetssjukhuset i Örebro, överläkare Anikó Kovács, avdelningen för patologi, Sahlgrenska Universitetssjukhuset, Göteborg och leg BMA Ann Olsson, avdelningen för patologi och cytologi, Karolinska Universitetssjukhuset Solna samt BMA Carina Strand, onkologiska forskningsavdelningen Lund har hjälpt till med resultatsammanställning. Patologavdelningarna vid sjukhusen i Borås, Eskilstuna, Falun, Gävle, Göteborg, Helsingborg, Jönköping, Kalmar, Karlskrona, Karlstad, Karolinska Universitetssjukhuset, Linköping, Boden–Luleå, Lund–Kristianstad, Malmö, Skövde (Capio Diagnostik AB), Sankt Görans sjukhus AB (Capio Diagnostik AB), Sundsvall, Trollhättan, Umeå, Uppsala, Västerås, Växjö, Örebro och Medilab AB har deltagit i studien.