Sammanfattat
Koncentrationen av S-kreatinin ger en otillfredsställande bild av den glomerulära filtrationen.
Omräkning av S-kreatininkoncentrationen med gängse algoritmer tillför ingen ny information.
MDRD-eGFR-algoritmen neutraliserar inte ålders- och könsvariationer av S-kreatininkoncentrationen.
En enhetlig beslutsgräns för diagnostik av kronisk njursjukdom blir missvisande.
MDRD-eGFR representerar inte individens normerade glomerulära filtrationshastighet.
Med den »smarta« vägen att bedöma glomerulär filtration avses att använda algoritmer som omvandlar S-/P-kreatininkoncentrationen till uppskattad glomerulär filtrationshastighet (eGFR, estimated glomerular filtration rate). Det finns två formler som är i allmänt bruk, Cockcroft–Gault (C–G) [1] och 4-variabels MDRD (modification of diet in renal disease) [2] (Figur 1). Av båda finns ett stort antal varianter som mest speglar tillgången till avancerade statistikprogram utan koppling till fysiologi. Kreatinin är en nedbrytningsprodukt av huvudsakligen muskelprotein och utsöndras i allt väsentligt genom filtration i glomeruli. Mängden utsöndrat kreatinin blir beroende av mängden bildat kreatinin, dvs relaterad till individens muskelmassa och aktivitet. Dietärt kött kan öka serumkoncentrationen. Mängden utsöndrat kreatinin blir individuell och beroende av i huvudsak dessa faktorer. Eftersom kreatinin normalt utsöndras genom filtrering och endast i ringa grad utsöndras i tubuli kan den utsöndrade mängden kreatinin per tidsenhet vara en surrogatmarkör för filtrationen.
Clearance
Under normala förhållanden (steady state) är kreatininbildningen relativt konstant, urinmängderna likaså och således också utsöndringen av mängden kreatinin. Detta är grunden för »endogen kreatininclearance«, som innebär att volymen urin som utsöndrats under en viss tid och dess koncentration av kreatinin mäts, dvs den kreatininmängd som utsöndrats under en viss tid. Denna ställs i relation till S-/P-kreatininkoncentrationen (Figur 1).
Undersökningen blir meningslös om S-/P-kreatininkoncentrationen inte kan antas vara konstant under urinsamlingsperioden. Svårbemästrade felkällor är urinsamling och observationstid. Endogen kreatininclearance är av bl a denna anledning behäftad med stor osäkerhet och har ersatts av metoder där en substans injiceras, och försvinnandet ur blodbanan registreras. Använda substanser är inulin, Cr-EDTA och iohexol; det gemensamma är att de bara utsöndras genom filtration, är billiga, atoxiska och kan mätas med liten osäkerhet. Överensstämmelsen mellan metoderna har visats vara god, men felkällor är t ex distributionsvolymen i kroppen och dosen. Metoderna är mer kostnadkrävande än kreatininclearance, men detta uppvägs av kvalitetsökningen. Någon absolut referensmetod för GFR finns inte, men den som mätts med inulin anses vara referensmetod, etablerad standard. GFR uppskattad från iohexol användas ofta som referens av praktiska skäl.
I läroböcker definieras clearance som den »plasmavolym som renas fullständigt från en substans per tidsenhet« (Figur 1). Det är svårt att föreställa sig hur det skulle kunna ske, men formeln kan också tolkas som »volymflöde«, dvs den volym primärurin som filtreras per minut, eller som »mängdflöde« i relation till serumkoncentrationen, dvs hur mycket substans som transporteras över glomeruli per tidsenhet [3]. Primärurinen koncentreras i tubuli, där ett utbyte av olika ämnen kan ske.
Beräkningsformler
En algoritm kan skapa ett mervärde om den utgör en kombination av relevanta storheter. Algoritmer kan utformas genom statistisk analys av stora grupper av individer, där korrelationen optimerats genom att ändra valet av storheter, faktorer, konstanter och exponenter. Sådana metoder finns i alla mer omfattande statistikprogram. Algoritmer kan också skapas genom en logisk sammanställning av mätvärden, t ex anjongap eller endogen kreatininclearance. Skillnaden i dessa ansatser är att den statistiska analysen bara gäller för den grupp individer som studerats, inte andra grupper och inte den enskilda individen i gruppen, medan den logiska modellen gäller generellt.
Algoritmerna för C–G [1] och MDRD [2] för uppskattning av GFR är exempel på statistiskt framtagna algoritmer. Båda baseras på mätningar av S-/P-kreatininkoncentrationen, personens ålder och kön. C–G inkluderar även kroppsstorleken, ursprungligen »lean body mass«, nu vanligen vikten (massan). MDRD i sin globala form inkluderar en faktor för afrikaner; värdet av denna är tveksamt och omdiskuterat. Det finns också MDRD-formler som inkluderar koncentrationen av albumin och urea. C–G rapporterar det beräknade värdet av GFR uttryckt i ml/min, dvs det aktuella GFR (ibland kallat absolut), medan MDRD-värdet uttrycks i ml/(min ¥ 1,73 m2), dvs ett kroppsytenormerat GFR (relativt). I båda fallen har storhetsslaget och därmed enheten valts från den beroende variabeln i algoritmen, men egentligen är enheten godtycklig. I föreliggande arbete uttrycks därför beräknad GFR i arbiträra enheter.
Båda formlerna innehåller korrektionsfaktorn 88,4 för att omvandla kreatininkoncentrationer uttryckta i lmol/l till det i USA vanligen använda mg/dl. Notera skillnaden i könskorrektionsfaktorn mellan C–G (0,85) och MDRD (0,74) samt att en 140-åring inte kan ha någon GFR alls. En variant av C–G [4] anger en formel för män (156 – ålder) och en för kvinnor (142 – ålder). För en 50-åring ger dessa algoritmer en könskorrektionsfaktor av 0,88.
Aktuell och normerad GFR
Njurfunktionen anses vara proportionell mot kroppsytan. Om uppmätt aktuellt clearance normeras till kroppsytan (SA: »referensperson« 1,73 m2) får man ett värde som kan jämföras med ett referensvärde: (se Figur 1b.)
Aktuell GFR gäller för den enskilda individen och kan användas för dosering av läkemedel som utsöndras genom glomerulär filtration; normerad GFR kan användas bara för att jämföra en individs GFR med andras, dvs den utgör ett referensvärde för en viss ålder.
Vanligen beräknas kroppsytan (SA) med du Bois–du Bois nomogram (algoritm), publicerat 1916 (Figur 1), nu i FASS. Formeln kom till långt innan modern livsföring slagit igenom och våra kroppshyddor antagit en tilltagande sfärisk form. Från ett material av nio personer, varav en kvinna, sammanfattades resultaten i den formel som än i dag används. Formeln underskattar kroppsytan med omkring 0,3 procent för män men överskattar den mer än 1 procent för kvinnor jämfört med tredimensionell laserskanning [5]. Den härledda formeln är bara en av många, men ser således ut att stämma bra. Andra formler för beräkning av kroppsyta kan prövas interaktivt på Internet [6]. Valet av 1,73 m2 som genomsnittlig kroppsyta för män och kvinnor är tveksamt och referensvärden för GFR därför haltande.
MDRD-eGFR neutraliserar inte köns- och åldersskillnader
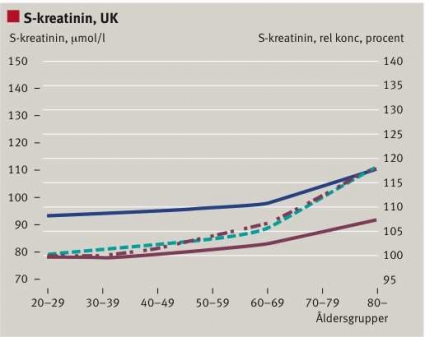
En avsikt med omvandlingen av S-/P-kreatininkoncentrationen till MDRD-eGFR var att kunna rekommendera en och samma beslutsgräns för män och kvinnor i alla åldrar [2]. Beslutsgränsen 60 enheter anges för kronisk njursjukdom (chronic kidney disease, CKD) grad III. Om en och samma referensgräns ska gälla måste den fysiologiska ökningen av S-/P-kreatininkoncentrationen med åldern och skillnaden mellan könen neutraliseras av algoritmen. Så är ingalunda fallet. Vi noterade samma skillnad mellan åldersgrupper och kön för MDRD-eGFR som för S-/P-kreatininkoncentrationen i en retrospektiv studie, som omfattade ca 50 000 patienter i sluten vård vid Karolinska Universitetssjukhuset Solna och 95 000 patienter i primärvård (Romford, UK) [7]. Som Figur 2 visar är den relativa förändringen större för MDRD-eGFR än för S-/P-kreatininkoncentrationen och olika i primärvård och sluten vård. Skillnaden mellan könen består [7].
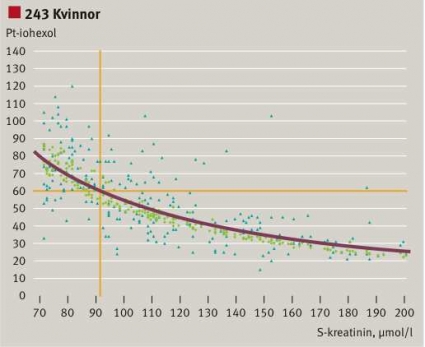
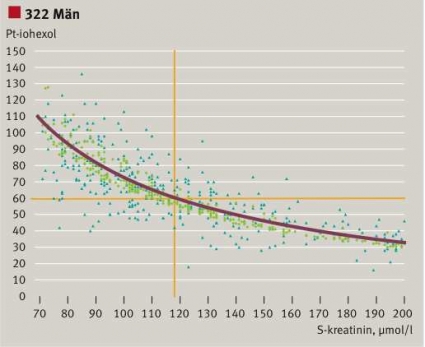
Vi studerade också relationen mellan GFR från iohexolmätningar och S-/P-kreatininkoncentrationen baserat på 322 män och 243 kvinnor på Karolinska Universitetssjukhuset Solna [7]. Definitionsvis är clearance omvänt proportionell mot serumkoncentrationen (Figur 1). Experimentellt finns en relation mellan variablerna (Figur 3), men spridningen är mycket stor. Applicerar vi MDRD-algoritmen på patientvärdena och korrigerar för kön krymper alla kreatininvärden ihop till ett smalt band av eGFR, vars spridning betingas av åldersvariationen. Den heldragna gula linjen är relationen beräknad för en 50-åring. Anammandet av eGFR ger därför en felaktig bild av njurfunktionen, lika felaktig i det individuella fallet som S-/P-kreatininkoncentrationen. Figur 3 ger förklaringen till att S-/
P-kreatininkoncentrationen är en dålig surrogatmarkör för GFR. Och inte blir den bättre av att inverteras, multipliceras med en faktor och den inverterade åldern!
Av samma anledning är det ett allvarligt misstag att korrigera MDRD-eGFR med aktuell kroppsyta för att beräkna aktuell GFR, eftersom MDRD-eGFR inte representerar patientens normerade GFR utan den för en okänd patientkategori i USA. Däremot kan sannolikt S-/P-kreatininkoncentration och därmed MDRD-eGFR användas för att följa ett kliniskt förlopp under en kortare tid under förutsättning att muskelmassa, muskelaktivitet och köttdiet inte ändras nämnvärt. Men varför gå över ån efter vatten?
En jämförelse av eGFR mellan laboratorier är förknippad med ökad osäkerhet, därför att exponenter och faktorer i algoritmen är avpassade efter ett speciellt laboratorium. Man beräknar osäkerheten till omkring ±20 enheter, dvs mittvärdet och »cut-off« representerar ett intervall mellan 40 och 80 enheter. Varje laboratorium måste därför verifiera att beslutsgränsen gäller, men det gör den ändå inte, eftersom köns- och ålderskillnaderna inte neutraliserats. S-/P-kreatininkoncentrationen kan mätas med en osäkerhet mindre än 3 procent, dvs mittvärdet 100 lmol/l motsvarar intervallet 94–106 lmol/l (95 procents konfidensintervall).
För S-/P-cystatin C [8] har en mångfald algoritmer, alla med olika faktorer, negativa exponenter och korrektionskonstanter, prövats för att erhålla ett siffervärde som liknar GFR. Stora förhoppningar knyts till andra oberoende markörer, t ex fatty acid-binding protein (FABP), kidney injury molecule (KIM-1) och neutrophil gelatinase-associated lipocalin (NGAL) [9]. Dessa finns tillgängliga på vissa laboratorier i Sverige, i försökssammanhang. Sedan länge är U-albumin etablerad som markör.
Konklusion
Med enkla algoritmer går det inte att uppskatta vare sig aktuell eller normerad GFR från S-/P-kreatininkoncentrationen hos en individ. S-/P-kreatininkoncentration och därmed eGFR har alltför låg sensitivitet och specificitet (likelihood ratio) för att tillåta säker diagnos. Den osäkerhet som introduceras vid beräkningen är stor. GFR kan endast uppskattas med verkliga mätningar. Ett kliniskt förlopp kan följas med S/P-kreatinin och med eGFR – så länge resultaten från eGFR kommer från ett och samma laboratorium.
Det konsensusdokument som Svensk förening för klinisk kemi har publicerat [10] saknar analys av eGFR-beräkningars värde jämfört med S-kreatininkoncentrationen och kan därför inte uppfattas som seriöst.