Sammanfattat
Ytterst få analgetika med nya verkningsmekanismer har introducerats efter opioider och cyklooxygenasinhibitorer.
Explosionen inom biovetenskaperna och nya tekniska genombrott ger hopp om nya typer av smärtstillande medel.
Kapsaicinreceptorn – nu kallad TRPV1 – kan ge generellt användbara analgetika. Frågetecken finns för observerade bieffekter i form av hypertermi.
Blockerare av natriumkanaler – betydligt mer selektiva än dagens lokalanestetika – skulle kunna revolutionera smärtbehandling. Dessa medel har inte nått fram till kliniska prövningar.
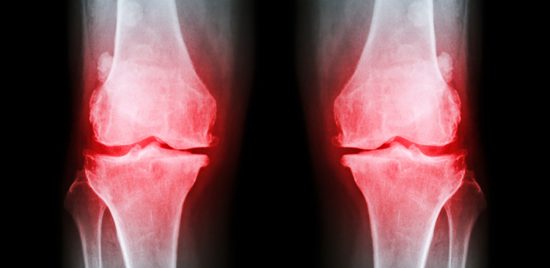
Ett nytt biotekniskt läkemedel – en monoklonal antikropp mot »nerve growth factor« (NGF) – har nått längst i utvecklingen och finns nu i fas III. Det har visat lovande resultat i prövningar mot smärta vid osteoartros i knäleden.
Samtidigt som frihet från fysisk smärta är normaltillståndet för de flesta av oss vet vi att smärta inte finns långt borta; huvudvärk, tandvärk, muskelsmärta eller mildare ryggont tillhör livet och kan i stor utsträckning hävas med dagens läkemedel.
Men patienter med långvariga svåra smärtor, särskilt av neuropatisk karaktär, har liten anledning att vara nöjda med nuvarande behandlingar. Dagens läkemedel hjälper nämligen bara ett fåtal patienter, även om läkemedlen för dem kan betyda stor skillnad. Läkemedlen har dessutom besvärande biverkningar.
Nuvarande analgetika utövar sin verkan via förvånansvärt få mekanismer. För >90 procent av givna doser rör det sig om färre än fyra–fem mekanismer: hämning av cyklooxygenasenzymerna (COX-1 och COX-2) med antiinflammatoriska läkemedel samt (my)-receptoragonister i form av opioider som morfin, ketobemidon mfl dominerar. Därtill kommer för lättare analgetika den okända mekanism – eller mekanismer – som paracetamol verkar genom.
Vid neuropatisk smärta förskrivs läkemedel som har sitt ursprung i a) antiepileptika som tex karbamazepin och under senaste årtiondet gabapentin och pregabalin, som påverkar vissa kalciumkanaler, eller b) tricykliska antidepressiva såsom amitriptylin. Om dessa läkemedel alls hjälper är de oftast förknippade med många biverkningar.
Industrins gigantiska utmaning
Kan vi snart förvänta oss nya läkemedel mot smärta som även klarar de svårare tillstånden? För insyn i detta måste vi se vad som pågår inom den forskande läkemedelsindustrin. Faktum är att kunskapsexplosionen inom biovetenskaperna ger anledning till viss optimism om mer effektiva analgetika. Men som alltid när det handlar om tillämpad forskning sker framstegen långsamt. Läkemedelsindustrin har antagit de giganiska utmaningarna att finna optimala kemiska substanser för de nya verkningsmekanismerna, och genombrotten står säkerligen för dörren.
Även om allt stämmer tar det dock mer än 10 år från igångsättning till registrerat läkemedel. Man kan i sammanhanget peka på en artikel av Leif Olgart i Läkartidningen 1997 med rubriken »Genombrott inom smärtforskningen«. Där pekas tillväxtfaktorn NGF (nerve growth factor) ut som en nyckelaktör [1], och mycket riktigt är det nog läkemedel mot denna som kommer först ut av de nya medlen – i bästa fall redan om 2–3 år.
I denna översikt vill jag kommentera ett fåtal av de många tänkbara verkningsmekanismer, som inom de närmaste 3–10 åren kan tänkas resultera i marknadsförda analgetika (kapsaicinantagonister, NGF-antagonister och selektiva blockerare av Na+-kanaler). Jag tror att här finns en del överraskningar för de läkare, som en dag ska förskriva dessa medel.
Tänkbara målproteiner för nya analgetika
Det finns väldigt många tänkbara målproteiner för nya analgetika, och därför är deras respektive roller i smärtuppkomsten mycket svåra att fastlägga. Det tar avsevärd tid innan man hamnar rätt. Några andra, särskilt intressanta mekanismer är de följande.
Prostaglandin E2 (PGE2) är välbekant som smärtsignalerare, och inhibitorer av cyklooxygenas (COX) blockerar dess bildning. Men samtidigt förhindras syntesen av de andra prostaglandinerna och av prostacyklin. Detta leder till de välkända biverkningarna med obalanser inom arakidonsyrakaskaden, med risk för blödningar i magslemhinnan och påverkan på hjärtmuskeln.
Det finns utsikter att man ska kunna selektivt förhindra syntesen av PGE2 genom att hämma det relativt nyupptäckta mikrosomalt prostaglandin-E-syntetas. Enzymet, som uppregleras vid inflammatoriska tillstånd, isolerades i slutet på 1990-talet av forskare vid Karolinska institutet i Stockholm (Per-Johan Jakobsson, Staffan Thorén, Ralf Morgenstern och Bengt Samuelsson). Flera företag, bla Biolipox i Stockholm, arbetar med denna mekanism.
Andra mekanismer som bearbetas är antagonister vid receptorer för PGE2 (EP1 och EP4), bradykinin (B1) och vissa kemokiner, tex CCR2. Ännu fler intressanta jonkanaler än de ovannämnda är andra slags TRP-kanaler (transient receptor potential), tex TRPA1 och TRPM8 som reagerar för köldstimuli, och sådana som är ATP-reglerade, för att nämna bara några.
Ett problem med att ta fram ett selektivt läkemedel mot något av de tänkbara målproteinerna är naturligtvis att just detta protein sannolikt svarar för bara en mindre del av smärtsignaleringen och att dess medverkan är temporalt och dynamiskt beroende av skadans uppkomst. Hoppfullt är dock att om flera nya typer av analgetika når fram till marknaden/patienten kan de användas i kombination. Sannolikheten för att finna synergistiska effekter är hög.
Mekanismer för smärtgenerering
Kunskapen om mekanismerna för smärtgenerering har ökat snabbt under de senaste decennierna. Vi vet åtskilligt om vilka molekyler (signalmolekyler, receptorer och jonkanaler etc) som deltar i de olika processer som leder fram till att vi känner smärta. Men förståelsen av hur deras interaktioner kan leda till uppkomst av långvarig smärta är fortfarande bristfällig, för att uttrycka sig försiktigt.
Smärtförnimmelsen startar med generering av ökad pulstrafik i de små omyeliniserade neuronen, C-fibrerna, och de tunna myeliniserade neuronen, A(delta)-fibrerna. En förenklad bild av kemisk signalering vid inflammation/trauma ges i Figur1, där några av de mest aktiva, kända signalsubstanserna anges tillsammans med sina receptorer på nervändan (i periferin).
Några av dessa substanser, tex ATP, NGF och cytokinet interleukin-1(beta), har förmåga att direkt eller inom sekunder excitera neuronet till en nivå, där det kan alstra en aktionspotential som fortleds till ryggmärgen. Andra smärtstimuli – av fysisk karaktär – är hetta, kyla och mekanisk retning. Dessa stimuli kan direkt omformas till aktionspotentialer via TRP-kanaler eller mekanokänsliga katjonkanaler (se nedan).
En del smärtmediatorer påverkar det nociceptiva neuronet i periferin via en sensibiliseringsprocess, som kan ha olika tidsförlopp. Via denna jämte analoga processer i ryggmärgen ökas smärtkänsligheten i det traumatiserade området (hyperalgesi). Att försöka påverka sensibiliseringsprocesserna är erkänt viktigt för att uppnå god lindring vid många smärttillsånd. Såväl COX-1- som COX-2 inhibitorer påverkar sensibiliseringen; sannolikt inte bara i periferin utan även i ryggmärgen.
TRPV1-antagonister
Under det senaste decenniet har en jonkanal, som tillhör undergruppen TRPV i TRP-familjen, rönt stor uppmärksamhet. Denna jonkanal kallas TRPV1 och gick tidigare under namnet kapsaicinreceptorn (även vanilloidreceptorn), eftersom den visats förmedla de starkt retande och smärtframkallande, och även eftertraktade, egenskaperna hos chilipeppar mfl liknande kryddor. TRPV1 reagerar normalt för temperaturer i området 39–50 °C, men råkar även öppnas av den lilla molekylen kapsaicin (Figur2). Förutom att framkalla brännande hetta i munnen när kapsaicin intas via chilipeppar framkallar det en intensiv smärta vid injektion i huden, alltså är kapsaicin en algogen substans.
Receptorn/jonkanalen TRPV1 klonades av David Julius och medarbetare år 1997 [2], vilket inledde en kapplöpning inom industrin om att hinna först med att utveckla blockerare/ antagonister, som skulle kunna utgöra en helt ny typ av analgetikum. Receptorn ägnades redan tidigare stor uppmärksamhet, men storskalig screening var inte praktiskt genomförbar med de receptorkällor och mättekniker som då stod till buds.
Nu, 12 år senare, hur har det gått? Faktum är att storskalig screening (HTS, high throughput screening) har levererat de kemiska ledtrådar, som den något upphaussade tekniken borde göra. Kemisterna i läkemedelsindustrin har kunnat excellera i att framställa potenta antagonister, som även har rimliga farmakokinetiska egenskaper. Några exempel ges i Figur 2.
Den längst komna TRPV1-antagonisten befinner sig enligt officiella uppgifter i fasII-studier. Några resultat har rapporterats [3, 4] och följs säkerligen inom kort av fler. Forskare från Amgen har rapporterat att försöken ledde till hypertermi hos patienterna, en faktiskt inte helt oväntad biverkning [4]. Det är inte uteslutet att Amgen bedömt biverkningarna som alltför svåra att komma till rätta med.
Förväntningarna på TRPV1-antagonister kommenteras i slutet av artikeln.
Natriumkanaler
Andra jonkanaler är också heta mål för nya smärtstillande medel. Det är väl bekant att den mycket effektiva smärtfrihet som lokalanestetika åstadkommer går via blockad av spänningsreglerade natriumkanaler.
Nackdelen med lokalanestetika är den ringa selektiviteten beträffande vilka natriumkanaler som blockeras, något som leder till hög risk för funktionsproblem för vissa organ, med hjärtstillestånd som en potentiell och tragisk slutpunkt. Även nervledning till andra muskler påverkas, på gott och ont.
Trots lokalanestetikas begränsade terapeutiska fönster har det varit möjligt att fastställa en analgetisk effekt av systemiskt givet lokalanestetikum vid neuropatiska smärttillstånd (särskilt lidokain har använts).
Det finns tio kända subtyper av spänningsreglerade natriumkanaler, där intresset i ett smärtperspektiv är störst för de som kallas NaV1.7 och NaV1.8, med viss uppmärksamhet även på NaV1.3 och NaV1.9, som också finns i smärtkänsliga nervfibrer.
De senaste två åren har NaV1.7 hamnat ordentligt i centrum och fått stark smärtanknytning via upptäckten av att flera olika mutationer i dess gen, SCN9A, ger upphov till okänslighet för smärta – ett sällsynt tillstånd som benämns CIP (congenital indifference to pain). Det har varit ett känt fenomen att individer i vissa – på världsbasis ytterst få – familjer saknar förmåga att känna smärta. Det är bara under de senaste 12–13 åren som fenomenet har kunnat knytas till specifika mutationer, och bland dessa finns alltså en i genen för NaV1.7 [5-7].
Samtliga mutationer leder till att ett förkortat, funktionsodugligt protein bildas. Människor som saknar båda allelerna för NaV1.7-genen (NaV1.7-/-) känner ingen fysisk smärta, även om temperaturregleringen är normal och personerna har normalt mentalt och intellektuellt status. Svenska forskare har medverkat till att finna den felaktiga genen hos en av familjerna, som finns i Kanada [7].
Det finns andra typer av mutationer i genen för NaV1.7 som leder till erytromelalgi (även känt som »burning feet syndrome«) respektive tarmparoxysmer mm (paroxysmal extreme pain disorder). Dessa punktmutationer aktiverar i stället jonkanalen genom att öka öppettiden.
NaV1.8 är den andra natriumkanal som tilldrar sig intresse i ett möjligt läkemedelsperspektiv. Denna finns, liksom NaV1.7, huvudsakligen i sensoriska nerver. En skillnad mot NaV1.7 är dess helt nyligen visade oförändrade ledningsförmåga vid lägre temperaturer jämfört med fysiologisk temperatur [8]. Denna omständighet för osökt tankarna till fenomenet köldallodyni vid neuropatisk smärta. NaV1.8 är i likhet med NaV1.9, men till skillnad från NaV1.7 och NaV1.5 i hjärtat, relativt okänslig för nervgiftet tetrodotoxin.
Den brännande multimiljardfrågan är om kemisterna i läkemedelsindustrin kan framställa natriumkanalblockerare som är selektiva för de intressanta kanalerna (och som duger i övrigt). Det arbetas intensivt för att detta ska bli verklighet, men resultatet låter vänta på sig. Det verkar svårare att finna sådana selektivt verkande blockerare än att hitta andra typer av receptorantagonister eller enzymhämmare. Det rapporteras att nya NaV-blockerare finns i klinisk fas, men selektiviteten hos dessa är inte känd. Det skulle överraska om kliniska prövningar av en mycket selektiv natriumkanalblockerare påbörjas före ca 2010.
NGF/trkA
Det har sedan början av 1990-talet stått klart att tillväxtfaktorn NGF (nerve growth factor) är en starkt smärtframkallande substans [9, 10]. Huruvida detta spelar en roll vid den »normala« uppkomsten av smärta har varit föremål för många undersökningar. Slutsatsen är entydig: i den inflammatoriska »soppa« som bildas vid alla slags trauma återfinns NGF som en av de substanser, som kraftigast sensibiliserar nociceptorer för smärtstimuli. Man har även visat att koncentrationen av NGF ökar mångfalt i huden vid tex brännskada. Ytterligare bekräftelse har erhållits genom att antikroppar mot NGF har använts i djurförsök där olika smärtsamma tillstånd kunnat motverkas [11]; fler detaljer nedan.
NGF är ett litet protein om 14 kD som tillhör neurotrofin(NT)familjen, i vilken även BDNF (brain-derived nerve growth factor) och NT-3 och NT-4/5 ingår. Vid utvecklingen av nervsystemet spelar NGF en avgörande roll, men hos en vuxen människa verkar det ha en mer homeostatisk uppgift. Neurotrofinernas receptorer trkA, trkB respektive trkC utgörs av ett membranbundet tyrosinkinas som har en stor extracellulär domän dit neurotrofinerna binds, alltså ett typiskt arrangemang hos receptorer för tillväxtfaktorer (Figur 3). Signalering initieras genom att en NGF-dimer binder två receptorer, som då kan inleda en rad intracellulära docknings- och fosforyleringsprocesser. Det kan nämnas att en av processerna leder till snabb uppreglering (inom sekunder) av den nämnda TRPV1-jonkanalen. Andra kända vägar ger till resultat att nociceptorerna ökar sin känslighet gentemot termiska och mekaniska stimuli.
Intramuskulär injektion av NGF i människa ger upphov till exceptionellt långvarig hyperalgesi, som kan vara i mer än en vecka. En förklaring till den långa verkan är NGF:s trofiska effekter på så sätt att proteinet vid bindning till trkA internaliseras med receptorn och sedan transporteras i nerven till cellkroppen, som är belägen i dorsalrotsgangliet. Denna långsamma resa inuti en lång C-fiber tar många timmar, och följaktligen dröjer det innan proteinsyntesen kan sättas i gång. Syntetiserade proteiner, som exempelvis kan utgöras av TRPV1- och natriumkanaler, kan sedan transporteras tillbaka till nervändan och utöva sina verkningar – på gott och ont – lång tid efter NGF-injektionen.
Ovan nämndes att det finns genetisk evidens via CIP-fynd för en viss natriumkanals stora roll i smärtsignaleringen. För NGF:s viktiga roll finns det också motsvarande fynd, som svenska forskare rapporterade för fyra år sedan. Som Minde et al då beskrev finns i Norrbotten en familj vars medlemmar uppvisar ovanlig okänslighet för smärta [12]. Liksom i fallet med NaV1.7 har personerna ådragit sig omfattande skador, särskilt i olika leder. Vad som låg bakom var naturligtvis ett mysterium, men i samarbete med kliniska genetiker kunde det lösas. NGF-genen, NGFB, har en punktmutation som gör att en arginin byts ut mot tryptofan [13]. Uppenbarligen medför utbytet att NGF:s signalering förändras tillräckligt för att upplevelse av smärta i det närmaste ska upphöra. I vilken grad detta är en utvecklingsdefekt i C-fibrerna eller en direkt följd av att NGF har sämre funktion vid trkA (och bireceptorn p75) har inte klargjorts. Det verkar troligt att båda effekterna kan ha betydelse.
Mutationer i trkA, som är NGF-receptorn, har också visats leda till smärtokänslighet. De ger dock svårare utvecklingsdefekter och oftast mental retardation.
Upprepade försök under 1990-talet visade att antikroppar mot NGF minskade smärtbeteenden hos försöksdjur. I flera studier användes diverse polyklonala antikroppar, men vid mitten av 1990-talet framställde forskare vid Genentech ett trkA–IgG-fusionsprotein av den yttre delen av trkA och Fc-domänen av en antikropp. Detta protein har affinitet till NGF i det låga nanomolara området. Gynnsamma, publicerade, försök vid inflammatoriska smärttillstånd uppnåddes med hjälp av detta verktyg [11]. Vidareutveckling ledde till monoklonala musantikroppar.
Någonstans i utvecklingen mot att föra en humaniserad antikropp in i kliniska prövningar mot smärta ändrades färdriktningen. Ett beslut att gå vidare fattades aldrig vid Genentech. I stället knoppades denna aktivitet av i ett separat bolag där de forskare, som trodde på en antikropp mot NGF, samlades. Detta var år 2001 – hur gick det sedan?
Utan överdrift kan sägas att det bolag, Rinat Neuroscience, som bildades 2001 hade stor framgång. En humaniserad antikropp fungerade utmärkt i djurmodeller, och de första kliniska försöken med tanezumab (RN624) på osteoartrospatienter rapporterades i oktober 2005; resultaten såg mycket lovande ut [14].
På våren 2006 köptes företaget upp av Pfizer, som ville fortsätta att utveckla anti-NGF. FasII-studier på osteoartrospatienter rapporterades vid IASP World Congress of Pain i Glasgow, 17–22 augusti 2008 [abstract PT214]. Resultaten ser fortsatt lovande ut, och studierna breddas nu till flera olika smärtindikationer från vilka resultat förväntas om ett par år.
Även andra företag utvecklar en liknande antikropp, tex Johnson & Johnson, som inlicensierat produkten från Amgen. Ett annat företag, Bioxell i Italien, uppger att de i stället utvecklar en antikropp mot trkA, dvs NGF-receptorn, likaledes på smärtindikationer.
Slutord
Beträffande anti-NGF frågar man sig givetvis hur ett analgetikum som måste injiceras kan uppnå en mer vidsträckt användning. Och hur blir det med priset? Erfarenheterna från de nya biotekniska läkemedlen mot reumatoid artrit och cancer pekar mot mycket höga kostnader. Jag har inget bra svar på prisfrågan men kan peka på en omständighet, som bör underlätta en vidare användning. En monoklonal antikropp behöver sannolikt inte tillföras oftare än högst var 14:e dag till var 4:e vecka, och i de fall där subkutan administration fungerar bör patienterna kunna injicera själva.
Om tanezumab under de närmaste två–tre åren klarar de återstående prövningarna beträffande säkerhet och effektivitet, finns god möjlighet att det blir ett protein (dvs ett biotekniskt läkemedel), som blir det första nya smärtläkemedlet med ett helt nytt verkningssätt. Vem hade efter decennier av misslyckade ansträngningar inom analgetikaområdet kunnat gissa detta? Dessutom finns det åtskilligt som talar för att det blir ett effektivt medel.
Kliniska prövningar av TRPV1-antagonister pågår, men situationen är mer oklar än för anti-NGF. Forskare från Amgen har nyligen rapporterat om hypertermi hos försökspersoner [4]. Det torde dröja ännu en tid innan bilden klarnar beträffande biverkningssidan.
Utvecklingen av TRPV1-antagonisterna belyser väl vilka utmaningar läkemedelsutveckling möter och hur stor osäkerheten är. En uppenbart attraktiv mekanism kan vara förknippad med stora inbyggda biverkningsproblem och inte sällan otillräcklig terapeutisk verkan. Exempelvis prövade man inom analgesiforskningen i början av 1990-talet substans P-antagonister (NK1-antagonister) som visade klart otillräcklig effekt i klinik, trots de mycket högt ställda förväntningarna.
Det ställs krav på ett stort terapeutiskt fönster för ett läkemedel för en massmarknad – med rätta. Men det är också självklart att inte så många nya substanser och mekanismer klarar den höga tröskeln. I gengäld blir de få nytillkommande, effektiva analgetika sannolikt långlivade. Kanske får de åldras med samma värdighet som lidokain, som i dag används mer än någonsin – 65 år efter födelsen.
Analgetika som verkar selektivt mot subtyper av natriumkanaler ligger ännu längre bort men med tiden borde något företag lyckas. Andra mekanismer kan mycket väl hinna före.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna utöver anställningsförhållanden.