Sammanfattat
Fibromuskulär dysplasi är en icke-aterosklerotisk, icke-inflammatorisk angiopati som drabbar medelstora artärer. Oftast engageras njur- och karotisartärer, vilket kan leda till renovaskulär hypertoni respektive cerebral ischemi.
Vid njurartärstenos indikerar frånvaro av generell ateroskleros att stenosen kan vara orsakad av fibromuskulär dysplasi.
Screening kan utföras med ultraljud, kaptoprilrenografi, MR- eller DT-angiografi, men digital subtraktionsangiografi är fortfarande etablerad standardmetod för diagnos.
Vid njurartärstenos bör patienterna behandlas med sikte på blodtryck <140/90 mm Hg. Invasiv behandling aktualiseras när hypertonin inte kan kontrolleras medicinskt med rimligt antal läkemedel samt vid nedsatt njurfunktion.Då invasiv behandling är indicerad är perkutan transluminal angioplastik den dominerande behandlingsformen, med goda behandlingsresultat. Öppen kirurgisk behandling blir aktuell främst efter komplikationer till angioplastik.
Fibromuskulär dysplasi (FMD) är en icke-aterosklerotisk, icke-inflammatorisk angiopati i medelstora artärer, vilken beskrevs i njurartärer 1938 [1] och i karotisartärer 1964 [2]. Oftast engageras njurartärerna, vilket kan leda till renovaskulär hypertoni.
Epidemiologi
Symtomatisk renal FMD (Figur 1 a) anses förekomma hos 0,4 procent av befolkningen [3], men prevalensen av asymtomatisk FMD hos potentiella njurdonatorer är 4 procent [4, 5]. Sjukdomen diagnostiseras oftast i åldrarna 15–50 år men förekommer från barndomen [6, 7] upp till åtminstone 89 års ålder [8-10]. Den vanligaste mediala FMD-typen är mer än 4 gånger vanligare hos kvinnor [3, 4], medan den ovanligare intimala typen är vanligare hos män [3, 11]. Höger njurartär drabbas oftare än vänster. Bilateral renal FMD [12] och multipelt engagemang [13-37] (Tabell I) av framför allt karotis- (Figur 2 a) och koronarartärer är vanligt. FMD bör övervägas som orsak vid dissektion eller ocklusion av karotisartärer hos yngre patienter.
FMD ligger bakom 10 procent av fallen av renovaskulär hypertoni [38, 39], som i övrigt orsakas av främst ateroskleros. Jämfört med aterosklerospatienter är FMD-patienter yngre och har i mindre utsträckning aterosklerosens riskfaktorer och ateroskleros annorstädes. FMD är vanligare hos vita av europeiskt ursprung än hos asiater och svarta [39].
Patogenes
Att FMD är vanligare hos kvinnor [4] antyder betydelse av hormonella faktorer [40]. Antal graviditeter eller frekvens av p-pilleranvändning skiljer sig dock inte mellan FMD-patienter och kvinnor i övrigt [16, 40]. Kärlväggsischemi är också av betydelse [41]. Njurartärer och carotis interna har långa segment utan avgående grenar, och därmed få vasa vasorum. Artärerna sträcks vid rörelse och respiration, vilket kan skada vasa vasorum och leda till väggischemi och utveckling av FMD.
FMD är vanligare i höger njurartär [14], som är längre än vänster, vilket leder till ökad risk för renal ptos [42], som är vanligt vid FMD [43]. Vasospasm kan ge ischemi i vasa vasorum, och FMD förekommer tillsammans med Raynauds fenomen [17]. FMD är även associerad med rökning [40], och rökande FMD-patienter har mer uttalade förändringar än icke-rökande [44].
Renal FMD hos syskon och tvillingar [45] antyder betydelse av ärftlighet. FMD antas ärvas autosomalt dominant med varierande penetrans och symtom [46]. Association med polymorfier i angiotensinkonvertasallelen ACE-I [47] och autoimmun orsak har föreslagits, baserat på associationer med HLA-Drw6 [40]. FMD kan förekomma tillsammans med Ehlers–Danlos’ syndrom typ IV [48], feokromocytom [49], Marfans syndrom [50], Alports syndrom [51] och Takayasus arterit [52].
Differentialdiagnoser
Differentialdiagnoser förutom ateroskleros är typ 1-neurofibromatos [53, 54], Ehlers–Danlos’ syndrom, Williams’ syndrom och vaskulit. Dessa diagnostiseras genom associerade fenotypiska drag: hudlesioner vid typ 1-neurofibromatos [55]; akrogerisk dysmorfi, hudelasticitet och ledöverrörlighet vid Ehlers–Danlos’ syndrom [56]; ansiktsdysmorfi, aortastenos och avvikande beteende vid Williams’ syndrom [57]. Genetiska test kan också användas.
Eftersom FMD är en icke-inflammatorisk sjukdom, ingår inte anemi eller ökning av akutfasreaktanter i sjukdomsbilden. Eftersom storkärlsvaskulit kan förekomma utan ovanstående manifestationer, kan differentialdiagnos ibland behöva baseras på vävnadsprov [58].
Klassifikation
FMD klassificeras med avseende på främst drabbat artärväggslager [14, 59-61]. Mediala och perimediala fibroplasier utgör ca 95 procent och intimal fibroplasi ca 5 procent. Dessutom förekommer enstaka adventitiella fibroplasier.
Patofysiologi
Eftersom renal FMD ger lumeninskränkning, finns förutsättning för en tryckgradient, njurartärstenos. Renin–angiotensin–aldosteron(RAA)-systemet aktiveras, vilket leder till volymexpansion och hypertoni som underhålls av ökad endotelin(ET) 1-produktion, lokal RAA-aktivering, remodellering och oxidativ stress [62]. Hypertonin är därmed inte längre beroende enbart av RAA-systemet, utan även av vasokonstriktiva proliferativa effekter [63]. Inflammationsmediatorer som CRP (C-reaktivt protein), tumörnekrosfaktor α, interleukin-6, neopterin och vasokonstringerande ET-1 ökar vid renovaskulär hypertoni [64]. Dock är nivåerna av neopterin och ET-1 lägre vid FMD än vid aterosklerotisk njurartärstenos [64], indikerande att FMD-hypertoni är mer direkt reninberoende [65].
Fortsatt lumeninskränkning ledande till ischemisk nefropati [66] är ovanligare vid FMD än vid ateroskleros [3, 67], men data vid FMD [4, 68-72] är färre. Mellan 26 och 28 procent av dem med asymtomatisk FMD utvecklar hypertoni under 4 år [4, 5], och upprepade angiografier visar FMD-progression hos upp till 40 procent [6, 70]. FMD kan leda till minskad njurstorlek [72], njurfunktionsnedsättning [16, 65, 73, 74], totalocklusion [75], njurinfarkt [72, 76] och uremi [18, 77], men även till stenosregression [78].
Klinisk bild
Symtom som leder tankarna till renovaskulär hypertoni sammanfattas i Fakta 1 [79]. Renovaskulär hypertoni är den näst vanligaste sekundära hypertoniformen, och ses hos ca 2 procent av vuxna hypertonipatienter [80].
Vid njurartärstenos indikerar frånvaro av generell ateroskleros möjlig FMD-genes. Vid antingen höggradig stenos i singelnjure eller bilateral FMD, ofta med en njurartär ockluderad och den andra stenoserad, förekommer plötsliga lungödem, »flash pulmonary edema« [81-83]. Ibland hörs blåsljud i flankerna, och rutinlaboratorieprov kan avslöja njurskada eller hypokalemi.
Cerebrovaskulär FMD kan vara asymtomatisk eller ge ospecifik huvudvärk, tinnitus och yrsel, alternativt stroke eller transitorisk ischemisk attack (TIA) [3, 71]. FMD i mesenterialartärer kan ge bukangina, och FMD i extremitetsartärer kan orsaka extremitetsischemi [3].
Undersökningar för renal fibromuskulär dysplasi
Vid misstänkt njurartärstenos remitteras patienten vanligen till specialistsjukvården för någon av nedanstående screeningundersökningar. Prisuppgifterna avser regionpris 2008 vid Universitetssjukhuset MAS i Malmö.
Ultraljudsundersökning. Ultraljudsundersökning möjliggör bestämning av njurstorlek. Längdskillnad mellan njurarna >1,5 cm anses diagnostiskt för njurartärstenos och ses hos 60–70 procent av patienter med renovaskulär hypertoni [84]. Färgdoppler visualiserar ofta njurartärstenos, speciellt om denna är ostial [85]. Resistensindex, som ansetts predicera utgången av angioplastik och stentning vid aterosklerotisk njurartärstenos [86], har inte utvärderats vid FMD. Metodens svagheter är dess beroende av tränad undersökare och svårigheter att visualisera grenartärer eller accessoriska artärer respektive att visualisera kärl vid obesitas eller störande tarmgas [87]. Undersökningspris 1 548 kr.
Kaptoprilrenografi. Kaptoprilrenografi är en isotopundersökning, som värderar njurfunktionens angiotensin II-beroende. Positivt test innebär att 25–50 mg kaptopril oralt försenar och reducerar isotopupptag, förlänger transittid, fördröjer isotopexkretion och påverkar separatfunktion vid unilateral sjukdom [88]. Sensitivitet och specificitet minskar vid njursvikt, bilateral stenos, grenartärengagemang och vid singelnjure. FMD kan visualiseras med kaptoprilrenografi, men på grund av otillfredsställande sensitivitet och specificitet [89, 90] anses metoden inte som förstahandsval. Undersökningspris 4 143 kr.
MR-angiografi. MR-angiografi (MRA) kan användas för att noninvasivt utesluta signifikant njurartärstenos. Falskt positiva resultat är dock vanliga, och stenosgraden överskattas ofta [64, 90]. MRA visualiserar kärldiameter ned till 2–2,5 mm och har därmed begränsad upplösningsförmåga avseende distala och intrarenala artärer, varför den ifrågasatts för FMD-diagnostik [12, 71]. Gadoliniumtoxicitet gör att metoden bör undvikas vid svår njurfunktionsnedsättning. Undersökningspris 6 562 kr.
DT-angiografi. Datortomografisk angiografi (DTA) har ungefär samma sensitivitet och specificitet som MRA [90] men innebär strålningsbelastning och infusion av potentiellt nefrotoxisk kontrast. DTA avbildar både lumen och kärlvägg men har begränsad upplösning avseende distala och intrarenala artärer [12]. Undersökningspris 6 853 kr.
Utredningsgången vid misstänkt njurartärstenos måste anpassas till möjligheterna på aktuellt sjukhus, men specificitet och sensitivitet för de dyrare MRA och DTA är inbördes likvärdiga och bättre än vad de är för ultraljud och skintigrafi [89, 90]. MRA eller DTA används därför ibland som andrahandsundersökning efter positivt screeningfynd med ultraljud eller kaptoprilrenografi när stenosmisstanken är stark.
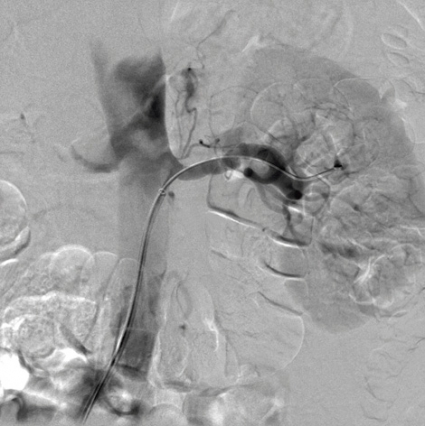
Angiografi. Då screeningundersökning stärkt misstanken om njurartärstenos eller när FMD-misstanken är stark och om det föreligger indikation för revaskularisering konfirmeras diagnosen med intraarteriell digital subtraktionsangiografi. Undersökningen är fortfarande etablerad standardmetod för diagnos av FMD [71]. FMD-lesionerna är i typiska fall trunkala eller distala, till skillnad från aterosklerotiska lesioner, som oftast är proximala eller ostiala [3]. Vid medial fibroplasi leder fibromuskulära insnävningar omväxlande med aneurysm till det klassiska »pärlbandsutseendet« vid angiografi (Figur 1 a) [12].
Tryckgradienter. Intraarteriell tryckmätning över stenosen rekommenderas [91] för att selektera patienter för invasiv behandling [92, 93], men konsensus saknas avseende vilken gradient som indikerar hemodynamisk signifikans. Vid FMD [18, 94] predicerar dock medeltrycksgradient ≥10 mm Hg gynnsamt svar på dilatation. Tryckmätningar kan även avslöja FMD hos patienter utan morfologiska tecken på njurartärstenos vid angiografi [94].
Undersökningar vid fibromuskulär dysplasi i karotisartärer
Ultraljudsundersökning av karotisartärer kan ge misstanke om cerebrovaskulär FMD [71]. MRA och DTA kan också användas, speciellt för värdering av eventuella samtidiga aneurysm [3]. Formella jämförelser av icke-invasiva diagnosmetoder har dock inte gjorts på denna indikation, och även vid cerebrovaskulär FMD rekommenderas angiografi (Figur 2 a) för definitiv diagnos [71].
Behandlingsval
FMD kan behandlas medicinskt, endovaskulärt och kirurgiskt. Randomiserade långtidsstudier saknas, och det är svårt att predicera blodtryckssvaret efter renal revaskularisering [80]. Invasiv endovaskulär eller kirurgisk behandling bör övervägas då hypertoni inte kan kontrolleras medicinskt, vid intolerans eller bristande ordinationsföljsamhet och vid nedsatt njurfunktion [71]. Under medicinsk behandling bör blodtryck och njurfunktion följas. Vissa rekommenderar dessutom regelbunden ultraljudsuppföljning av njurstorlek och revaskularisering om denna minskar med >1 cm [3].
Medicinsk behandling
Prevention. Vid aterosklerossjukdom ges acetylsalicylsyra och statin. Hos patienter med FMD och ingen eller varierande utbredning av samtidig ateroskleros får indikationen för sådan behandling evalueras individuellt. Den viktigaste medicinska åtgärden vid renal FMD är blodtryckssänkning.
Antihypertensiv behandling. Blodtrycksreduktion minskar kardiovaskular morbiditet och mortalitet [95], varför alla patienter med FMD-orsakad renovaskulär hypertoni bör erbjudas antihypertensiv behandling [79] med måltryck <140/90 mm Hg om det tolereras. Behandlingsriktlinjer [79] anger fem grupper av förstahandsmedel: ACE-hämmare, angiotensin II-antagonister, betablockerare, kalciumflödeshämmare och diuretika. Alla kan användas vid renovaskulär hypertoni orsakad av FMD. Vid bilateral stenos eller stenos i singelnjure bör dock RAA-systemet blockeras med försiktighet, eftersom njurfunktionen kan försämras på grund av dilatation av efferenta arterioler ledande till reducerat perfusionstryck efter stenosen. Detta kan reducera kapillärtrycket i glomeruli till under perfusionstryck [96]. Lätta, oftast reversibla S-kreatininstegringar är vanliga, och akut njursvikt har beskrivits [97].Endovaskulär behandling Öppen kirurgi var vanlig fram till början av 1990-talet. Härefter har perkutan transluminal angioplastik (PTA) successivt blivit dominerande invasiv behandlingsmetod i njurartärer (PTRA [perkutan transluminal renal angioplastik], Figur 1 a och b) [3, 71, 98] och karotisartärer (Figur 2 a och b) [3, 71]. Priset för renal angiografi med PTRA var 18 693 kr år 2008.Korttidsresultat. Publicerade serier omfattar >1 300 PTRA-behandlade patienter med renal FMD [8, 15, 17-37]. Kvinnor var 4,4 gånger vanligare än män, och 25 procent hade bilateral FMD. Resultaten är rapporterade i enlighet med »Guidelines for the reporting of renal artery revascularization in clinical trials« [99]. Ett lyckat behandlingsresultat (cure) definieras som diastoliskt blodtryck <90 mm Hg och systoliskt blodtryck <140 mm Hg utan antihypertensiv medicinering. Förbättring (improvement) definieras som diastoliskt blodtryck <90 mmHg och/eller systoliskt blodtryck <140 mm Hg med samma eller reducerat antal läkemedel eller som reduktion av diastoliskt blodtryck >15 mm Hg med samma eller reducerat antal läkemedel. Behandlingsvinst (benefit) definierad som »lyckat behandlingsresultat« eller »förbättring« [99] uppnåddes hos 55 procent [17] till 100 procent [28] hos ca 75–90 procent i de flesta serier. Bäst resultat ses vid FMD i huvudartären, medan blodtryckssvaret inte är lika uttalat vid PTA i grenartärer [18, 25].
Stentning. Eftersom stenosen vid renal FMD normalt är lokaliserad distalt i huvudartären, ger PTRA oftast goda resultat, och det finns då ingen indikation för stentning. Även med tanke på patienternas relativa ungdom bör stentning undvikas. Indikationer för stentning vid FMD är allvarliga komplikationer, tryckgradienter efter upprepade PTRA-försök och små njurartäraneurysm.
Komplikationer. Punktionshematom rapporterades hos 3–26 procent [8, 25, 26, 31], dissektion hos 1–7 procent [8, 18, 25] och ruptur hos 2–6 procent [18, 25, 37], främst vid komplexa stenoser. Vissa av dessa kan behöva stentas eller i enstaka fall opereras öppet. Grenartärocklusion sågs hos 1–5 procent [8, 18, 25], medan njurartärtrombos efter PTRA är ovanligt. Ocklusioner i huvudartären har inte rapporterats, men embolism till njure och nedre extremitet förekommer [25, 26].
Långtidsresultat. Uppföljningstider varierar mellan 6 [27] och 112 [30] månader. Bonelli [25] rapporterade 6 procent reinterventioner, medan i Malmö 34 procent behövde ny PTRA under 7 års uppföljningstid [18]. Oftast rörde det sig om planerad kontralateral PTRA eller planerad uppföljning inom 6 månader efter initialt suboptimal PTRA. Behov av reintervention är vanligare vid komplexa lesioner eller grenartärengagemang.
Ett fall med en 25-årig kvinna som framgångsrikt behandlats med PTRA beskrivs i Fakta 2.
Kirurgisk behandling
Öppen kirurgi aktualiseras efter PTRA-komplikationer som trombos, perforation eller dissektion som inte kan hanteras endovaskulärt. En annan möjlighet är då att använda stent eller stentgraft; behandlingsval avgörs av lesionens utbredning och flödessituationen. Kirurgi kan även övervägas efter upprepade misslyckade PTRA-försök eller restenoser efter PTRA samt vid större njurartäraneurysm.
Korttidsresultat. Resultat från >1 100 patienter har publicerats [13, 14, 74, 100-116]. Främst har aortorenal bypass [13, 73, 104, 105, 107, 109, 116], grenartärrekonstruktion [74, 102] eller autotransplantation [103, 104, 106, 114] utförts. Korttidsresultaten är utmärkta, men andelen som uppnår ett lyckat behandlingsresultat har minskat de senaste 10 åren på grund av högre ålder, längre hypertoniduration och mer komplexa lesioner, eftersom FMD i huvudartären numera PTRA-behandlas.
Komplikationer. Enstaka dödsfall har rapporterats efter FMD-kirurgi [74, 114, 116]. Total morbiditet efter kirurgi är 19–28 procent och utgörs främst av urinvägsinfektion och postoperativ pneumoni [13, 116]. Tidig postoperativ ocklusion ses hos 4–13 procent [13, 73, 111, 113, 116] och senare restenos hos 0–16 procent [13, 104, 113, 116]. Postoperativ njurfunktionsnedsättning är ovanlig [13, 73, 74, 101, 105, 114].
Pediatrisk njurartärstenos och artärdysplasi
Renovaskulär sjukdom är den vanligaste orsaken till hypertoni hos barn efter torakal aortakoarktation och parenkymatös njursjukdom [6] och orsakar 8–10 procent av fallen av sekundär hypertoni hos barn. Pediatrisk njurartärstenos förekommer vid FMD, anläggningsrubbningar, neurofibromatos typ 1, moyamoyasjuka, Takayasus arterit, Alagilles syndrom och Williams’ syndrom [6, 117-119]. FMD är vanligast i Nordamerika och Västeuropa, medan Takayasus arterit dominerar i Asien och Afrika [7].
Endovaskulär behandling hos barn. Resultat av PTRA vidFMD hos 230 barn och ungdomar har publicerats [7, 117, 120-133]. Könsfördelningen är jämn hos barn. Behandlingsvinst [99] har rapporterats hos ca 90 procent. Under 1–12 års uppföljning rapporteras restenos hos 27–33 procent [120, 128].
Öppen kirurgi hos barn. Öppen kirurgi har rapporterats hos 404 barn och ungdomar [6, 121, 132, 134-140]. I tidiga serier genomgick 40–50 procent av patienterna nefrektomi [136, 138, 139]; numera förordas aortorenal anastomos [6]. Långtidsuppföljning (1–10 år) visar behandlingsvinst [99] hos ca 95 procent och låg restenosfrekvens trots barnens fortsatta tillväxt.
Fibromuskulär dysplasi och aneurysm
Aneurysmutveckling är inte ovanlig vid FMD, men njurartäraneurysm har låg rupturrisk [105, 141]. Aneurysm >2 cm bör dock exkluderas från cirkulationen [74, 105, 116]. Embolisering [54, 142] och stent–graftbehandling [141, 143] har rapporterats, men merparten av fallen har rekonstruerats öppet.
*
Potentiella bindningar eller jävsförhållanden: Anders Gottsäter har deltagit i kliniska studier av blodtryckssänkande läkemedel samt haft avlönade föreläsnings- och konsultuppdrag åt flera läkemedelsföretag.