Sammanfattat
Prevalensen för celiaki har ökat kraftigt de senaste decennierna. I flera europeiska studier har man funnit en prevalens på 1:100.
Den tidigare beskrivna ökade malignitetsrisken bland patienter med denna sjukdom har i senare studier visat sig vara obetydlig eller endast lätt ökad.
Celiaki är en systemsjukdom som har koppling till flera andra organsystem än tarmen.
Trots att vi nu har serologiska test med hög sensitivitet och specificitet kvarstår krav på biopsi för säker diagnos.
Tvärtemot tidigare uppfattning tycks celiaki kunna debutera även i vuxen ålder.
Det finns nu hopp om att man ska finna medicinska behandlingsformer som alternativ till glutenfri diet.
Celiaki, glutenöverkänslighet, beskrevs av den engelske läkaren Samuel Gee redan år 1888. Den holländske barnläkaren Karel Dicke fann i slutet av 1940-talet att barn med symtom som vid celiaki förbättrades i samband med spannmålsbristen under andra världskriget. När tillgången på spannmål blev bättre efter krigsslutet försämrades barnen åter. Det är klarlagt att proteinet gluten i vete, råg och korn, eller mer exakt de proteinfraktioner kallade prolaminer som ingår i dessa sädesslag, är den utlösande faktorn. De tre sädesslagens prolaminer, gliadin (vete), sekalin (råg) och hordein (korn), är alkohollösliga och de mest toxiska fraktionerna av proteinet gluten. Alla tre går dock ofta under den gemensamma benämningen gliadin. Med glutenfria produkter avses i handeln produkter som är fria från prolaminer från vete, råg och korn.
Större medvetenhet om sjukdomen och förbättrade diagnostiska möjligheter kan vara orsaken till att vi under de senaste decennierna sett en kraftigt ökad prevalens i framför allt europeiska studier. Från att tidigare ha legat på cirka 1:300 har prevalensen ökat till cirka 1:100, enligt flera europeiska screeningundersökningar under det senaste decenniet [1, 2]. Bland barn är prevalensen lika för flickor och pojkar, 1:1, medan kvinnor drabbas dubbelt så ofta som män.
Diarré, steatorré, viktnedgång, trötthet och anemi är klassiska symtom vid celiaki som vi numera sällan ser. Hos vuxna finner man i dag ofta bara järn-, folat- eller B12-brist, eller symtom som vid funktionella mag–tarmbesvär. Många av de patienter som i dag diagnosticeras har utretts för ospecifika besvär, varvid man funnit positiva transglutaminas- eller gliadinantikroppar. I en studie fann man att 5 procent av patienter som uppfyllde Rom II-kriterierna för funktionell tarmsjukdom hade odiagnostiserad celiaki [3].
Bland patienter med dermatitis herpetiformis har ungefär 75 procent villusatrofi [4]. Celiaki kan vara en orsak till både manlig och kvinnlig infertilitet [5], liksom osteopeni och osteoporos [6, 7]. Isolerade förhöjda transaminaser har rapporterats hos 13–53 procent av vuxna med odiagnostiserad celiaki [8]. Detta fynd bör föranleda utredning avseende celiaki, men även isolerad stegring av alkaliska fosfataser i serum som uttryck för osteomalaci bör utredas. Patienter som är överviktiga kan också ha odiagnosticerad celiaki. I en studie i Nordirland som omfattade 371 patienter hade 39 procent ett BMI ≥25 medan endast 5 procent hade ett BMI <18,5 [9].Patogenes, genetik, immunologi och omgivningsfaktorer
Celiaki anses orsakas av en interaktion mellan genetiska-, immunologiska- och omgivningsfaktorer. Risken för en förstagradssläkting till en individ med celiaki att få sjukdomen är omkring 20 procent [10]. Konkordansen för enäggstvillingar är 70–75 procent [11]. Celiaki är associerad med HLA klass II-haplotyperna DQ2 och DQ8. Mer än 95 procent av patienterna med celiaki har någon av dessa haplotyper [12].
Gliadin framkallar en immunologisk reaktion i framför allt övre delen av tunntarmen, med infiltration av inflammatoriska celler i lamina propria och epitelceller. Gliadinreaktiva CD4-positiva T-celler i lamina propria känner igen gliadinpeptiderna som är bundna till HLA klass II-molekylerna DQ2 eller DQ8 på de antigenpresenterande cellerna. T-cellerna producerar då proinflammatoriska cytokiner, framför allt interferon-γ. Vävnadstransglutaminas är ett enzym i tarmslemhinnan som deaminerar gliadinpeptiden och därigenom ökar dess immunogenitet [13].
Amning och tidpunkten för introduktion av gluten i födan hos nyfödda tycks spela stor roll. Amning har en skyddande effekt [14]. Det har visat sig att risken för insjuknande i celiaki ökar om barnet börjar få gluten före 4 månaders ålder, en viss ökad risk föreligger även om man väntar med att introducera gluten mer än 7 månader [15].
Ett intressant fenomen inträffade i Sverige åren 1982–96. Efter det att åldern för introduktion av gluten ändrats från 4 till 6 månaders ålder ökade den kumulativa incidensen bland barn <2 år dramatiskt från 1 till nästan 4/1 000. Även mängden gluten i barnvälling ökades kraftigt. Då man antog att förändrade kostrekommendationer låg bakom den dramatiska ökningen ändrades dessa år 1996 till gradvis introduktion av gluten från 4 månaders ålder, det vill säga till en tidpunkt då de flesta barn fortfarande ammas [16]. Incidensen bland barn <2 år minskade då, men vissa data talar för att man bara förskjutit insjuknandet några år uppåt i åldrarna. De som insjuknade utvecklade dessutom en lindrigare, mer symtomfattig celiaki.
I början av 2000-talet har vi åter sett en uppgång i incidensen till 1994 års nivå bland barn <2 år, varför man diskuterar om även andra faktorer i omgivningen kan vara av betydelse för insjuknandet [17]. Infektioner med rotavirus i mag–tarmkanalen anses exempelvis kunna öka risken för insjuknande [18]. Ändrade diagnostiska metoder med införande av gliadin- och endomysieantikroppar har bidragit till att försvåra värderingen av skiftningarna i incidensen [17]. Prolaminerna är resistenta mot enzymatisk nedbrytning via proteaserna i ventrikel, duodenum och pankreas. Dessa peptider finns därför kvar och passerar genom tarmepitelbarriären vid tillstånd som ökar den intestinala permeabiliteten.Diagnostik och utredning
I regel sker screening med serologiska markörer. I dag finns knappast något skäl att använda gliadinantikroppar för screening då sensitiviteten för detta test är låg jämfört med sensitiviteten för transglutaminasantikroppar [19]. På senare år har man även ersatt bestämning av IgA-endomysieantikroppar, som är en arbetskrävande och kvalitativ metod, med bestämning av IgA-transglutaminasantikroppar, som är en snabbare, enklare och kvantitativ ELISA-metod med motsvarande sensitivitet och specificitet. Bestämning av transglutaminasantikroppar är nu den helt dominerande metoden med en specificitet i de flesta studier på >95 procent [19]. Sensitiviteten är hög för total villusatrofi, men betydligt lägre för mindre uttalade förändringar (Tabell I) [20, 21]. Det är viktigt att bestämma IgA samtidigt med antikroppsbestämning eftersom celiaki vid samtidig IgA-brist ger falskt negativa resultat. Patienter med selektiv IgA-brist har dessutom en 10-faldigt ökad risk att utveckla celiaki [22].
Trots synbarligen hög sensitivitet och specificitet för transglutaminasantikroppar blir det positiva prediktiva värdet, det vill säga proportionen patienter med positivt test som är korrekt diagnostiserade, vid celiakiscreening ganska lågt beroende på sjukdomens låga prevalens [23, 24]. Bestämning av deaminerade gliadinpeptidantikroppar i kombination med transglutaminasantikroppar har nyligen visat sig öka specificiteten. Ytterligare studier krävs dock för att bestämma dess plats inom diagnostiken [25].
En engelsk studie har visat att ett transglutaminasantikroppsvärde som är mer än 10 gånger den övre normalvärdesgränsen har ett positivt prediktivt värde på 100 procent, varför biopsier för diagnos i dessa fall inte anses nödvändiga [26]. Detta tycks gälla med få undantag för samtliga på marknaden förekommande analyskit [27]. Gastroskopi med biopsier från duodenum descendens får emellertid fortfarande anses som en obligatorisk undersökning för definitiv diagnos. Histologiskt kan man se ett helt spektrum av förändringar från total villusatrofi med krypthyperplasi till normala villi med endast lymfocytinfiltration i epitel och lamina propria (Figur 1–3).
Isolerad intraepitelial lymfocytos (IEL) är ett ospecifikt fynd som i cirka 10 procent av fallen kan vara tecken på begynnande celiaki. Fyndet kan också ses vid autoimmuna tillstånd, NSAID-medicinering, bakteriell överväxt till tunntarmen och Giardia-infektioner. Om lymfocyterna är >40/100 epitelceller är det sannolikt ett patologiskt fynd [28].
Tidigare har det ansetts att celiaki är en sjukdom som debuterar i de tidiga barnaåren. En studie från Finland talar dock för att sjukdomen kan utvecklas också i vuxen ålder [29]. Patienter som har positiva antikroppar men normal histologi löper stor risk att utveckla sjukdomen.
Hur ska man då handlägga patienter med positiv antikroppsbestämning och normal histologi respektive patienter med IEL? Ett sätt skulle kunna vara haplotypbestämning.
Majoriteten (>95 procent) av celiakipatienterna har antingen haplotyp HLA-DQ2 eller HLA-DQ8. Har man ingen av dessa genotyper är det högst osannolikt att man har eller kommer att få sjukdomen, varför ingen ytterligare åtgärd vidtas. Om patienten har en haplotyp som är förenlig med celiaki kan man välja en av två vägar. Har patienten besvärande symtom bör man rekommendera glutenfri kost, uppföljning av symtom och ny biopsi av tunntarmsslemhinnan. Om patienten är väsentligen besvärsfri görs ingen koständring men en ny gastroskopi om 1–2 år. Man ska dock komma ihåg att specificiteten för haplotypbestämningen är låg eftersom dessa haplotyper finns hos 20–30 procent av befolkningen, vilket begränsar värdet av ett positivt resultat [30].
Malignitetsrisk hos patienter med celiaki
Det är sedan länge känt att obehandlad celiaki innebär en ökad risk för utveckling av maligna tillstånd i mag–tarmkanalen. Det är också känt att denna risk avtar, för att sedan försvinna, efter behandling med strikt glutenfri kost [31]. I en relativt ny stor svensk studie undersökte man 12 000 patienter som hade vårdats på sjukhus för celiaki eller dermatitis herpetiformis avseende malignitetsutveckling. Man fann en 1,3 gånger ökad risk för patienter med enbart celiaki (95 procents CI 1,2–1,5), och en 1,2 gånger ökad risk för patienter med enbart dermatitis herpetiformis (95 procents CI 1,0–1,4). Den ökade malignitetsrisken avtog med tiden och skilde sig inte från den i normalbefolkningen efter 5–10 år [32].
Den 6-faldigt ökade risken i den svenska studien för den mest kända tumörsjukdomen lymfom är låg jämfört med fynd i andra studier, där man funnit en 15–100-faldigt ökad risk [32]. Dessa resultat är dock i regel från regionala centra dit patienter med svårare sjukdom remitterats.
I en stor brittisk populationsundersökning från en primärvårdsdatabas som omfattade 8 miljoner patienter fann man 4 732 patienter med celiaki under åren 1987–2002. Den totala risken för malignitet uppgick till 1,29 (95 procents CI 1,06–1,55) och för gastrointestinal malignitet till 1,85 (95 procents CI 1,22–2,81). Den största risken fanns under det första året efter diagnosen. Därefter fann man bara en signifikant ökning av risken för lymfoproliferativa sjukdomar [33]. I en engelsk populationsbaserad studie omfattande 869 patienter med biopsiverifierad celiaki som följts upp under 23 år kunde man inte påvisa någon ökad malignitetsrisk [34]. Den slutsats man får dra av dessa studier är att det sannolikt framför allt är patienter med svårare form av celiaki som löper ökad risk att utveckla malignitet och att risken för malignitet bland alla patienter med symtomgivande celiaki totalt sett är mycket liten. När det gäller patienter utan symtom finns inga belägg för att de skulle löpa ökad risk för malignitetsutveckling [5].
Fyra studier har visat en minskad risk för mammarcancer hos patienter med celiaki. Någon förklaring till detta samband har man inte funnit [35]. Tunntarmslymfom eller annan tarmmalignitet bör misstänkas om patienter som tidigare svarat bra på glutenfri kost på nytt får mag–tarmsymtom trots strikt diet.
Extraintestinala manifestationer av celiaki
Nedsatt bentäthet (osteopeni och osteoporos) ses relativt ofta hos patienter med celiaki. I en studie fann man att 7 procent av patienter med nedsatt bentäthet hade celiaki [36]. Det föreligger en lätt ökad risk för frakturer hos patienter med celiaki på grund av osteoporos, men denna ökade risk tycks vara begränsad till gruppen med »klassisk malabsorption« [35]. I en stor populationsundersökning fann man att risken för en patient att drabbas av en höftfraktur jämfört med normalpopulationen var 1/1 000 patienter och år. För närvarande saknas allmänna riktlinjer avseende om generell bentäthetsmätning med DEXA av nydiagnostiserade celiakipatienter är kostnadseffektivt [35].
Dermatitis herpetiformis är en hudmanifestation av glutenöverkänslighet. 10–30 procent av patienter med detta tillstånd har negativa transglutaminasantikroppar [37] och minst 60 procent saknar mag–tarmsymtom [37]. Hudförändringarna svarar bra på behandling med glutenfri kost.
Samband mellan celiaki och neurologiska tillstånd, till exempel cerebellär ataxi och neuropati, har också beskrivits, men huruvida dessa samband är kausala och om tillstånden förbättras efter insatt glutenfri kost är fortfarande oklart [38]. För att svara på den frågan krävs större prospektiva studier [39].
Man har också funnit ett samband mellan celiaki och kro
niska leversjukdomar som primär biliär cirros, primär skleroserande kolangit och kronisk autoimmun hepatit. Från Finland har rapporterats 3 patienter som remitterats för levertransplantation på grund av leversvikt, vilka samtliga förbättrades kraftigt efter påbörjad glutenfri kost sedan man konstaterat samtidig celiaki. Detta ledde till att planerade levertransplantationer kunde avblåsas [40]. En retrospektiv undersökning av 185 patienter som genomgått levertransplantation vid samma klinik visade att 8 (4,3 procent) hade celiaki [40].
Diabetes mellitus typ 1 och autoimmuna tyroideasjukdomar har också en ökad prevalens av celiaki, liksom patienter med Downs syndrom [41].
Det är också värt att känna till att celiaki är överrepresenterat vid lymfocytär kolit, och man bör ha detta tillstånd i åtanke om patientens symtom inte går fullständigt i regress efter insatt glutenfri kost [42].
Glutenfri diet – ännu enda behandlingen
Behandlingen av celiaki består av livslång glutenfri diet. Cirka 70 procent av patienterna upplever symtomatisk förbättring inom två veckor efter att de startat med glutenfri kost [43]. Man har på senare år visat att havre i kosten tolereras väl av celiakipatienter [44], sannolikt beroende på att prolamininnehållet är endast 1/5 av innehållet i övriga sädesslag. Detta har också inneburit en klar förbättring för celiakipatienterna då havre också ger ett viktigt tillskott av fiber i kosten [45]. Hos barn normaliseras vanligen tunntarmsslemhinnan, medan man bara finner en partiell restitution av slemhinnn hos hälften av de vuxna patienterna [46].
I en nyligen publicerad studie beskrevs 61 patienter som fått diagnosen celiaki som barn men som vid glutenprovokation några år efter diagnosen inte utvecklade symtom trots villusatrofi och som därför tilläts att återgå till normalkost. När man följde upp barnen i vuxen ålder fann man att 13 patienter hade spontanläkt med normala villi utan kliniska tecken på celiaki [47]. Detta visar att sjukdomen kan läka ut eller övergå i ett latent stadium hos vissa patienter, vilket skulle kunna innebära att man så småningom kan identifiera patienter som inte behöver livslång glutenfri diet. Detta väcker också frågan om alla asymtomatiska patienter som upptäcks vid serologisk screening behöver ha en glutenfri diet för att minska risken för framtida komplikationer. En prospektiv studie av den patientgruppen vore av stort värde.
Nyligen publicerades en studie där man kunde visa att om man behandlar med ett enzym (Aspergillus niger propylendoproteas) som bryter ned prolaminer når knappt något gluten duodenum [48]. Detta inger hopp om att man i framtiden ska finna medicinska behandlingsformer som alternativ till glutenfri diet.
Om patienten inte blir bra, vad gör vi då?
Om patienten inte blir bra är det första vi ska fråga oss om diagnosen är riktig. Giardiasis, Whipples sjukdom och tropisk sprue är andra sjukdomar som kan ge en histologisk bild som påminner om celiaki. Även bakteriell överväxt till tunntarmen har rapporterats i hög prevalens hos patienter som inte svarat på kostbehandling [49].
Refraktär celiaki innebär fortsatta symtom trots strikt glutenfri kost under 6–12 månader, enligt olika definitioner. Tillståndet är extremt ovanligt hos barn och ovanligt hos vuxna. Några riktigt säkra siffror angående prevalens går inte att hitta i litteraturen, men 2–5 procent har bedömts som rimligt [50]. Man bör ha i åtanke att i denna grupp finns patienter med enteropatiassocierat T-cellslymfom. Dessa kan identifieras med hjälp av en immunhistokemisk undersökning av formalinfixerade biopsier som visar en abnorm fenotyp av de intraepiteliala lymfocyterna [51]. I första hand ska emellertid dessa patienter ges förnyad kostrådgivning. Fortsatta symtom, trots att man inte kunnat påvisa kostfel eller T-cellslymfom, kan behandlas med steroider och/eller azatioprin [52]. Försiktighet med steroider bör dock tillrådas på grund av ökad risk för frakturer hos dessa patienter, som redan kan ha utvecklat osteopeni. Även cyklosporin [53] och infliximab [54] har visat sig vara verksamma vid refraktär celiaki.
Uppföljning av celiakipatienter
Hur ska man följa upp patienter som fått diagnosen celiaki? Räcker det med symtomfrihet och normaliserade transglutaminasantikroppar? Trots att de flesta patienter svarar på behandling med normalisering av symtom och serologiska test ser man ofta kvarstående histologiska förändringar i tarmslemhinnan, vilket visats i ett flertal studier [55]. I exempelvis en holländsk studie fann man histologisk remission hos 65 procent av patienterna efter 2 år och hos 85 procent efter 5 år [56]. En studie på Nordirland visade fullständig restitution av villi hos 40 procent av patienterna efter 12 månaders glutenfri kost [57].
Den allmänna uppfattningen är att felaktig diet är orsaken till att slemhinnan inte normaliseras. Det har föreslagits att man kan avstå från kontrollgastroskopi, eftersom klinisk förbättring och uppföljning med noggrann dietgenomgång är väl korrelerade med slemhinneläkning [58].
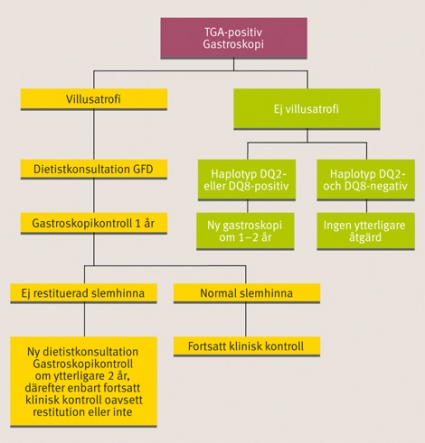
En alternativ uppföljning är att man gör en kontrollgastroskopi efter 1 år, då det kan vara motiverande för patienten att få veta om koständringen har gett resultat. Om tunntarmsslemhinnan inte har läkt får patienten en uppföljande kontakt med dietist för ny kostgenomgång, varefter kontrollgastroskopi görs på nytt om ytterligare 2 år. Om tunntarmsslemhinnan fortfarande inte skulle ha restituerats, men patienten är besvärsfri, görs ingen ytterligare biopsikontroll, utan vi rekommenderar endast årlig klinisk kontroll. I figur 4 och 5 ges förslag till uppföljning av patienter med misstänkt celiaki och som har antingen positiva eller negativa transglutaminasantikroppar.
Barnläkare kan på livsmedelsanvisning förskriva 3 månaders behov av glutenfria produkter i form av exempelvis glutenfritt mjöl, pasta och färdigbakat bröd för 120 kronor till barn upp till 16 års ålder, oavsett hur mycket de förbrukar. Efter 16 års ålder varierar bestämmelserna mellan olika landsting.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
De histologiska bilderna har ställts till förfogande av överläkare Johan Mölne, Klinisk patologi och cytologi, Sahlgrenska universitetssjukhuset, Göteborg.