Sammanfattat
Hepatit C-virusinfektion är en av de vanligaste orsakerna till levercirros och levercancer. I Sverige är ca 45 000 personer kroniska bärare av hepatit C (HCV). Av dessa riskerar ca 30 procent en för tidig död till följd av leversjukdom.
Med dagens behandling av HCV med interferon och ribavirin kan endast 40–50 procent av patienterna med den i västvärlden vanligast förekommande HCV-typen botas, med betydande biverkningar.
Inom en snar framtid kommer bättre behandling bestående av läkemedel (s k STAT-C) som direkt inhiberar virusets egna enzymer.
Eftersom HCV har en hög genetisk variationsgrad kommer med stor sannolikhet kombinationsterapi utnyttjas; dessutom finns naturliga/preexisterande resistensmutationer hos obehandlade patienter.
Resistensbestämning, både före start av HCV-behandling och under behandling, kommer troligen att behövas för att ge rätt behandling.
Dagens behandling mot hepatit C utgör en stor kostnad för sjukvården och medför oftast avsevärda biverkningar för patienten. Introduktionen av nya läkemedel med direkt verkan på hepatit C-virus via hämning av olika virusspecifika enzymer kommer sannolikt att innebära kortare behandlingstider och bättre behandlingsresultat, och därmed också förhoppningsvis lägre behandlingskostnader.
Denna översiktsartikel beskriver i huvudsak den problematik med terapiresistens som väntas uppträda när de nya läkemedlen börjar användas och hur detektion av resistensmutationer förväntas bli en del av rutindiagnostiken.
Vanlig orsak till levercirros och hepatocellulärt karcinom
Infektion med hepatit C-virus (HCV) är en av de vanligaste orsakerna till levercirros och hepatocellulärt karcinom. Man beräknar att det finns 175 miljoner HCV-bärare i världen, dvs en prevalens på 3 procent, med stora variationer mellan länder, t ex över 20 procent i Egypten där det sannolikt spridits med förorenade injektionssprutor vid tidigare behandling av bilharzios. I Sverige uppskattas prevalensen till närmare 0,5 procent, vilket motsvarar ca 45 000 personer.
En HCV-infektion blir i ca 75 procent av fallen kronisk, och upp till 30 procent av dessa fall utvecklar levercirros inom 20 år från smittotillfället. En del av dessa patienter riskerar därmed att behöva levertransplantation eller att dö i förtid till följd av sjukdomen.
Dagens standardbehandling av patienter med kronisk HCV-infektion introducerades för ca 10 år sedan. Den består av en kombination av pegylerat alfa-interferon, som ges som en subkutan injektion en gång i veckan, och ribavirin, som tas i tablettform dagligen [1, 2]. Inget av dessa läkemedel har dock någon känd specifik verkningsmekanism mot HCV, men förmodas främst dämpa infektionen genom att aktivera immunförsvaret.
Alfa-interferon frisätts normalt vid virusinfektioner och har en generell antiviral effekt. Ribavirin påverkar även cellens nukleotidpooler och kan möjligen fungera som ett mutagen och därmed skapa defekta HCV-virus, men detta har inte kunnat visas in vivo [3, 4].
Trots framgången med behandling med pegylerat interferon och ribavirin är det endast ca 50 procent av patienterna i västvärlden som kan botas. Positivt behandlingsresultat karakteriseras av utläkning av virusinfektionen (sustained virological response, SVR), definierad som icke-påvisbart HCV-RNA 6 månader efter avslutad behandling [5].
Dagens behandling har brister
Orsakerna till de modesta behandlingsresultaten är flera. För det första medför dagens kombinationsterapi avsevärda biverkningar – i varierande grad muskelvärk, depression, huvudvärk, yrsel, hosta, diarré, hjärtklappning och anemi – vilket leder till att en del patienter inte kan genomföra den ofta årslånga behandlingen. För det andra är en stor andel av patienterna infekterade med en genotyp av HCV, oftast typ 1, som har lägre känslighet för interferon.
HCV klassificeras i sex genotyper (1–6 samt subtyper), där genotyp 1 är vanligast i västvärlden (ca 70 procent, i Sverige ca 50 procent). Diagnostik av genotyp görs rutinmässigt innan behandling påbörjas för att anpassa dosering av interferon/ribavirin och behandlingstid [6]. Behandling med pegylerat interferon och ribavirin är effektiv för endast 40–50 procent av patienterna med genotyp 1 eller 4 vid 48 veckors behandling och för ca 80 procent med genotyp 2 eller 3 vid 24 veckors behandling.
Eftersom dagens behandling har brister, pågår intensiv forskning med att ta fram nya, mer effektiva läkemedel i tablettform som har specifik verkan mot HCV och som kan kombineras för att minska risken för resistensutveckling.
Nya läkemedel kan riktas mot flera angreppspunkter
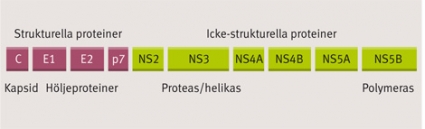
HCV är ett höljeförsett virus, som tillhör virusfamiljen Flaviviridae. HCV har ett positivt, enkelsträngat RNA-genom bestående av ca 9 600 baser, vilka kodar för ett stort polyprotein. Denna polypeptidkedja spjälkas av värdcellens enzymer och HCV-proteaser (främst NS3/NS4A, men även NS2) till 10 färdiga proteiner. De strukturella proteinerna bildar viruspartikelns skal och hölje, medan de icke-strukturella proteinerna med olika enzymatiska funktioner (proteas, helikas och polymeras) utgör virusets replikationskomplex [7] (Figur 1).
Följaktligen finns flera olika angreppspunkter mot HCV, på samma vis som för HIV-1 där olika läkemedel blockerar tre olika enzymer och två typer av ytproteiner.
De nya medlen mot HCV kallas allmänt för STAT-C (specifically targeted antiviral therapy for HCV). För närvarande finns mer än ett dussintal STAT-C-kandidater under utvärdering i kliniska prövningar [8-21]; två av dem genomgår fas III-prövning, sju fas II-prövning och de övriga fas I-prövning.
Läkemedelskandidaterna indelas i två grupper, proteashämmare och polymerashämmare, vilka inhiberar HCV:s egna enzymer: proteas (NS3) och polymeras (NS5B). Polymerashämmarna indelas sedan i ytterligare två typer: nukleosidanaloger och icke-nukleosidanaloger.
Första godkännande troligen under 2011
Det är fortfarande osäkert när de första medlen kommer att bli godkända av FDA och EMEA, men man förutser att det sker under år 2011.
Fas III-studier genomförs nu med den första generationens proteashämmare: telaprevir och boceprevir. De kliniska prövningarna har visat mindre biverkningar än behandling med interferon och ribavirin, med framför allt hudklåda för telaprevir och anemi och en upplevelse av obehaglig smak med boceprevir. I kombination med interferon och ribavirin kommer dessa biverkningar naturligtvis att adderas.
Den andra generationen proteashämmare är under utveckling; i fas II-studier befinner sig t ex MK-7009, TMC435 och ITMN-191. Generellt ligger proteashämmarna före polymerashämmarna i läkemedelsutvecklingen. Detta beror främst på de allvarliga biverkningar som observerats med nukleosidanalogerna. Proteashämmarna har dock en begränsning: till skillnad från polymerashämmare av typ nukleosidanalog, som kan hämma alla genotyper, uppvisar proteashämmaren en betydligt smalare specificitet.
Läkemedelsföretagen har därför prioriterat att utveckla läkemedel mot genotyp 1, som dels är den i västvärlden vanligast förekommande, dels är den som är svårast att behandla med interferon.
Emellertid har preliminära prekliniska studier visat att proteashämmaren TMC435 tycks ha aktivitet mot de flesta subtyperna av genotyp 1–6 [22].
Verkningsmekanismer hos olika STAT-C
Det HCV-proteas som fått störst uppmärksamhet som antiviral måltavla är lokaliserat i N-terminala delen av NS3. Detta är ett s k serinproteas, som behöver NS4A som kofaktor för att spjälka delar av HCV:s polypeptidkedja. Proteashämmarna fungerar som små peptidliknande substanser som blockerar denna klyvningsprocess.
HCV-polymeraset (NS5B) är ett RNA-beroende replikationsenzym som syntetiserar både den negativa och den positiva HCV-RNA-kedjan. De polymerashämmare som först utvecklades var nukleosidanaloger. De fungerar som analoger till RNA-polymerasets naturliga substrat ribonukleosidtrifosfater (NTP). För att nukleosidanalogen (N) i läkemedelsform ska kunna penetrera cellmembran måste den vara fri från laddade fosfatgrupper. I cellen omvandlas sedan nukleosidanalogen med hjälp av värdcellernas kinasenzymer till metaboliskt aktiv trifosfatform (TP), dvs en NTP-analog. När polymeraset inkorporerar NTP-analogen blockeras syntesen av viral RNA-produkt genom s k kedjeterminering.
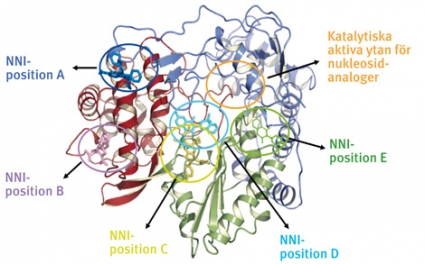
Eftersom den katalytiskt aktiva ytan utgör en mycket konserverad del av polymerasets aminosyrasekvens (Figur 2), har NTP-analogerna en mycket bred specificitet. Alla hittills framtagna nukleosidanaloger har följaktligen visat sig vara aktiva mot samtliga genotyper. Emellertid har kliniska prövningar med flera nukleosidanaloger avbrutits i fas II beroende på svåra hematologiska och gastrointestinala biverkningar.
Icke-nukleosidanalogers verkningsmekanism skiljer sig från nukleosidanalogernas genom att de binder sig till specifika fickor/positioner skilda ifrån polymerasets katalytiska yta. Denna interaktion ger en allosterisk effekt, som hämmar polymerasaktiviteten. Hittills har man funnit fem olika positioner på HCV-polymeraset (Figur 2), vilket är anmärkningsvärt, eftersom det finns endast en känd sådan ficka/position i HIV-1-polymeraset.
Jämfört med proteashämmare är icke-nukleosidanalogerna generellt mer specifika mot genotyp 1. Det finns till och med exempel på att de är subtypsspecifika, dvs hämmar endast subtyp 1 a eller 1 b.
Olika möjligheter mota resistens mot STAT-C-läkemedel
Möjligheten att kontrollera och undvika terapiresistens blir av stor betydelse om STAT-C ska kunna bidra till en förbättrad behandling av HCV. Tack vare nya verktyg i form av replikonsystem (ett cellkultursystem som möjliggör specifik replikation av viralt RNA utan att infektiösa virus bildas) har man under senare år kunnat selektera och undersöka resistensmutationer mot STAT-C-medel.
I kliniska prövningar med STAT-C-behandling har man påvisat terapiresistens på samma sätt som vid HIV-behandling. En HCV-infektion ger upp till 1 012 nya virioner per dag hos en obehandlad individ, och halveringstiden för virioner i plasma är 2–3 timmar [7]. Detta i kombination med ett »slarvigt« eget replikationsenzym (NS5B) gör att det alltid finns ett stort antal mutationer som kan selekteras med STAT-C-behandling.
Selektion av resistenta mutanter är speciellt markant vid monoterapi med proteashämmare eller icke-nukleosidanalog. Man har med replikonsystem (in vitro) och direkt i patientprov vid kliniska prövningar (in vivo) upptäckt ett flertal resistensmutationer. De förändringar av aminosyror som då uppkommer bildar bestämda mönster beroende på vilket STAT-C-läkemedel det gäller [8, 23]. Vi har sammanställt en tabell av olika STAT-C-kandidaters resistensmutationer, se webbplatsen
Ribavirin i monoterapi har rapporterats ge upphov till särskilda mutationer i NS5A- eller NS5B-genen. Det är dock osäkert om dessa mutationer bidrar till resistens, eftersom klinisk betydelse inte har kunnat bevisas och mutationerna inte resulterade i någon ökning av virus-RNA-nivåerna [24]. Inte heller interferon ger upphov till resistens beroende av utbyte av en eller ett par aminosyror i något virusprotein.
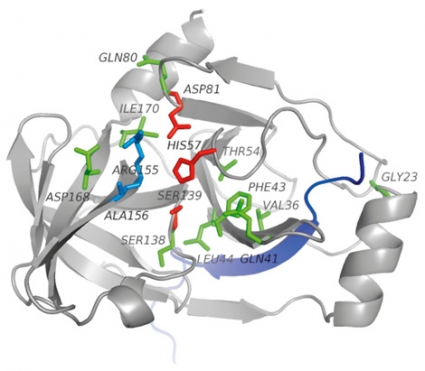
Resistens mot proteashämmare. Mutationer lokaliserade i NS3-proteasets katalytiska domän kan i replikonsystem leda till en hundrafaldig minskning av känslighet (ökning av resistens) mot proteashämmare. Ett fåtal specifika aminosyraförändringar (position 155, 156 och 168) orsakar korsresistens mot alla hittills framtagna proteashämmare (Figur 3).
Skillnader i resistensmönster har dock iakttagits för samma läkemedel i olika kliniska prövningar och i försök in vitro med replikonsystem. Dessa skillnader beror på att vissa resistensmutationer medför påtagligt nedsatt viral replikationsförmåga och därmed inte lika ofta uppkommer i in vivo-studierna [8]. Exempel på detta är vissa aminosyraförändringar i position 168 (t ex D168A).
Andra exempel är förändringar i position 36 och 80 som kan tillskrivas sekundära resistensmutationer med låg enskild resistens och vars huvudsakliga funktion sannolikt är att återställa replikationsförmågan. Generellt sett är dock mönstret för proteasresistens påfallande samstämmigt in vitro och in vivo.
Resistens mot nukleosidanaloger. De två kandidaterna R-7128 och R-1626 uppvisade i replikonsystem två olika mönster av resistens, där mutationer vid S282T och S96T är de mest betydelsefulla. Dessa resistensmönster har dock inte kunnat bekräftas i studier in vivo. En rationell förklaring är att dessa resistensmutationer associerade till polymerasets katalytiska yta medför en så starkt nedsatt viral replikationsförmåga att de inte överlever in vivo. Således kan man konstatera att nukleosidanaloger förefaller ha en hög genetisk barriär mot resistensutveckling [8].
Resistens mot icke-nukleosidanaloger. Dessa preparat kan med sina olika bindningsställen indelas i fem olika klasser, som uppvisar skilda resistensmönster (Figur 2). För närvarande finns bara uppgifter om resistensmutationer från in vitro-studier. Likväl kan man förvänta sig samma resistensmönster in vivo, eftersom icke-nukleosidanalogerna liksom proteashämmare har uppvisat en mycket låg resistensbarriär [25].
Naturlig/preexisterande resistens. HCV uppvisar en ännu högre grad av sekvensvariation än HIV, och detta innebär att det hos varje enskild HCV-patient sker en ständig uppkomst av virusvarianter, s k kvasispecies. Man har hos obehandlade HCV-patienter upptäckt en signifikant mängd preexisterande (naturliga) resistensmutationer mot olika proteashämmare [26, 27]. Många av dessa resistensmutationer påverkar inte virusets replikationsförmåga nämnvärt jämfört med vildtypsformen [28], och de kan därför hos enstaka patienter komma att utgöra den dominanta virusvarianten (nära 100 procent).
I ett patientmaterial av 573 obehandlade patienter med genotyp 1 (endast 1 a och 1 b) fann man en mängd kända resistensmutationer, bl a V36M eller R155K, med en prevalens av nära 2 procent [26]. En annan lika stor studie visade att hos upp till 5,5 procent av patienter med subtyp 1 a bar den dominanta virusvarianten på åtminstone en preexisterande resistensmutation mot proteashämmare [27]. När patienterna med särskilda preexisterande mutationer, t ex R155K, behandlades med telaprevir och interferon sviktade behandlingen; dessutom kunde det uppkomma ytterligare resistensmutationer (t ex V36M).
R155K är alltså ett exempel på ett aminosyraskifte som inte påverkar replikationsförmågan hos HCV nämnvärt. Vid kliniska prövningar med proteashämmare har mutationen R155K observerats endast hos patienter med subtyp 1 a. Detta kan förklaras av ett gynnsamt kodonskifte där endast en basförändring krävs vid subtyp 1 a till skillnad från 1 b, som behöver två basförändringar för att uppnå samma aminosyraförändring.
Naturliga resistensmutationer förekommer även i hög prevalens mot icke-nukleosidanaloger, eftersom deras bindningsställen inte är lokaliserade nära polymerasets katalytiska yta. När naturlig genetisk variation för kända mutationer av både proteas- och polymerasresistens studerades hos obehandlade patienter infekterade med subtyp 1 a fann man en så hög prevalens som 20 procent [29].
Därutöver: eftersom de flesta proteashämmare och icke-nukleosidanalogkandidaterna är specifika mot endast HCV-genotyp 1, förutsätts att övriga genotyper (typ 2–6) har en nästan 100-procentig inbyggd »naturlig« resistens (med okända mutationer) mot dessa STAT-C-läkemedel.
Individuell HLA-beroende selektion. Under det kroniska infektionsförloppet bidrar det adaptiva immunsystemet till selektion av genetiska varianter som är »resistenta« mot individens specifika immunförsvar, s k immunflykt. I höljeproteinet E1 har s k hypervariabla regioner identifierats, vilka utgör epitoper för neutraliserande antikroppar. Immunologisk selektion för mutationer i regionen, kodande för de icke-strukturella proteinerna, sker huvudsakligen via det cellmedierade immunförsvaret [30].
För att det cellmedierade immunförsvaret ska aktiveras krävs presentation av antigenet via humant leukocytantigen (HLA). Jämförelser av patientgrupper med kronisk HCV-infektion har visat att HLA-typ är en bidragande faktor för selektion av genetiska varianter av viruset [31]. Med ett starkare selektionstryck under STAT-C-behandling för de »hot spots« i HCV-genomet där selektionen av resistens mot STAT-C och immunförsvar sammanfaller kan man förvänta ökad uppkomst av naturlig resistens. Detta har nyligen bekräftats i en studie där en bidragande faktor till förekomst av naturlig resistens mot proteashämmare och icke-nukleosidanaloger kunnat hänföras till en HLA-beroende selektion [29].
Strategier för att mota resistens vid STAT-C-behandling
Man bör vid planering av HCV-behandling ta lärdom av erfarenheterna från behandling av HIV-1-infektion, där genombrottet kom för 13 år sedan när kombinationsbehandling med läkemedel ur flera klasser infördes. Därefter har läkemedelsarsenalen utökats med fler läkemedel med olika verkningsmekanismer och med mindre biverkningar. En av de viktigaste strategierna för att styra behandlingen har varit att utveckla både metoder för att påvisa resistens och kunskap om hur resistensdata ska tolkas.
Resistensdata togs först fram med hjälp av cellkulturtest (rekombinant virustest), där relevanta delar av HIV-1 från patientisolat testades mot olika koncentrationer av läkemedel. Den dyra och arbetskrävande cellkulturmetoden har nu helt ersatts med DNA-sekvensering, och tolkning sker med algoritmer baserade på cellkulturdata. I dag finns kostnadsfri service för resistenstolkning via olika webbplatser, t ex
Strategin inom HIV-1-behandling är kombinationsterapi med minst tre läkemedel. Dessa väljs från olika klasser av läkemedel så att inte korsresistens uppstår, men man använder sig också av läkemedel inom samma klass, t ex två nukleosidanaloger, där resistensen är antagonistisk och motverkar korsresistens. En annan viktig faktor för framgångsrik HIV-behandling är följsamhet, dvs att patienten tar sin kombinationsbehandling dagligen utan uppehåll. På så sätt trycks virusnivåer ner så kraftigt att de knappt kan detekteras och chansen att terapiresistenta virus ska kunna selekteras är därmed extremt liten.
De nya STAT-C-medlen kommer med all sannolikhet att förbättra behandlingsresultaten vid HCV-infektion, framför allt för de mer svårbehandlade genotyperna. Samma strategi med läkemedelskombinationer som för HIV-1 kommer att tillämpas även vid behandling av HCV. Eftersom HCV till skillnad från HIV inte integreras i värdcellens arvsmassa, kan HCV-infektionen läka ut vid framgångsrik behandling, som alltså inte behöver bli livslång som nuvarande HIV-1-behandling.
Kombinationsbehandlingen kommer till att börja med sannolikt att innefatta pegylerat interferon, ribavirin och proteashämmare. Fas II-studier med telaprevir eller boceprevir i kombination med interferon och ribavirin visade för patientgruppen med genotyp 1 en ökning av utläkningsfrekvensen jämfört med konventionell interferon-/ribavirinbehandling, från ca 50 procent till ca 70 procent [32, 33]. Vid studier med telaprevir, interferon och ribavirin blev det ytterligare bekräftat att ribavirin har en betydelsefull antiviral effekt, även om dess verkningsmekanism är okänd [32].
I en fas II-studie visade sig ribavirin i kombination med interferon ge högre utläkning än behandling med telaprevir i kombination med interferon. Om man vill undvika att använda interferon, som måste ges i subkutan injektion och har de svåraste biverkningarna, krävs det sannolikt flera STAT-C-medel av olika klasser för att uppnå effektiv kombinationsbehandling.
Eftersom de nu aktuella proteashämmarna uppvisar liknande resistensmönster, finns det behov av flera STAT-C-medel med olika verkningsmekanismer och skilda resistensprofiler. Därmed står det klart att de nya HCV-läkemedel som först introduceras på marknaden inte kommer att få den dominerande ställning som tidigare förutspåddes. Om de nukleosidanaloger som står näst i tur inte klarar säkerhetskraven, finns det fler kandidater under utveckling. Därutöver finns klassen icke-nukleosidanaloger som har många bindningsalternativ, vilket innebär en möjlighet för bredare kombinationsbehandling även om risken för resistens är större med dessa substanser.
Ett sätt att minska risken för STAT-C-resistens har åskådliggjorts i fas II-studier med boceprevir [33]. Där inkluderades en behandlingsarm med enbart interferon och ribavirin under de första 4 veckorna, »inledande«-behandling, före insättning av boceprevir. Behandlingen fortsatte sedan med boceprevir i kombination med interferon och ribavirin under resterande behandlingstid. Med denna inledningsstrategi reducerades virusnivån före tillägget av boceprevir, vilket resulterade i mycket lägre resistensutveckling än om boceprevir inkorporerats i kombinationsbehandlingen redan från starten.
För att reducera biverkningar är det önskvärt att minska användningen av interferon eller ribavirin i kombinationsbehandling. En grupp patienter som behöver förbättrad behandling är de som inte svarar på interferonbehandling (non-responders) (oftast genotyp 1). Hos dem är det verkligen motiverat att använda flera STAT-C-preparat tillsammans med ribavirin för att minska risken för resistens.
Eftersom HCV inte integreras i värdcellen har det spekulerats över om det går att »rensa bort« resistens efter utsättandet av STAT-C-behandling, men man ska inte ha för stora förhoppningar om detta. Några grundliga studier har inte gjorts av hur länge resistens mot HCV-behandling kvarstår. Det finns en uppenbar risk att viruset kan förvärva resistensmutationer, t ex R155K, som inte nedsätter dess replikativa förmåga, vilket medför att resistensen består även efter utsättande av läkemedlen.
Med tanke på att HCV inte integreras i cellen finns det ändå gott hopp om att resistensutveckling kan kontrolleras och patienten botas. De kliniska studier som hittills gjorts med proteashämmare i kombination med interferon/ribavirin pekar i den riktningen. Dock får man ha i åtanke att dessa studier har gjorts under kontrollerade former, där följsamhet till behandling har beaktats.
Dagens rutindiagnostik för konventionell HCV-behandling [34] omfattar bl a PCR-kvantifiering av virus och genotypbestämning för att kunna anpassa doseringen av interferon/ribavirin efter genotyp samt att med hjälp av viruskvantifiering monitorera effekten av behandlingen och bestämma behandlingstiden.
Med de nya STAT-C-medlen kommer diagnostiken sannolikt att utökas med DNA-sekvensering av relevanta HCV-gener och tolkning av resistens under behandling. Eftersom prevalensen av naturlig resistens är signifikant och kostnaden för resistensbestämning med modern metodik förväntas bli låg, är det troligt att bestämning av en »nollsekvens« kommer att utföras redan före start av behandling. I framtiden kanske även typning av individuellt HLA kan bli aktuellt.
Under alla omständigheter kan resistensbestämningen kompliceras av att flera olika STAT-C-medel måste beaktas. Tillkommer dessutom nya läkemedel mot de olika genotyperna/subtyperna (förutom genotyp 1) kompliceras resistensmätningen ytterligare.
Ny behandling kräver ökad kompetens
Sammanfattningsvis ger hittillsvarande kliniska STAT-C-prövningar förhoppningar om att många fler HCV-infekterade ska kunna botas, med kortare behandlingstid och mindre biverkningar, under förutsättning att terapiresistensen kan bemästras.
Introduktion av STAT-C-medel kommer därför att ställa krav på utvidgad kompetens vid infektionskliniker och virologiska laboratorier.
*
Potentiella bindningar eller jävsförhållanden: Bo Öberg äger aktier i Medivir AB och är en av grundarna av detta bolag.