Den organiserade cytologiska screeningen för att förebygga livmoderhalscancer infördes i slutet av 1960-talet i Sverige och har inneburit att antalet cancerfall minskat med över 50 procent. För närvarande drabbas färre än 500 kvinnor varje år av livmoderhalscancer, men cirka 140 av dessa överlever inte sin sjukdom [1].
När den organiserade screeningen infördes var orsaken till livmoderhalscancer okänd. I dag vet man att en kronisk infektion med onkogent (högrisk) humant papillomvirus (HPV) är en förutsättning för att sjukdomen ska utvecklas. I överensstämmelse med det kan HPV-DNA påvisas i så gott som alla fall av cervixcancer och även i de olika precancerösa förstadierna [2, 3]. Med denna kunskap som bas diskuteras nu HPV-test som ett komplement, eller till och med ett alternativ, till den befintliga cytologiska screeningen [4]. Fördelen med HPV-test är i första hand att de har en högre sensitivitet än cytologisk undersökning och därför kan identifiera fler kvinnor som löper risk att senare utveckla cancer.
Med stöd av Socialstyrelsen utförs en kontinuerlig kvalitetsgranskning av den organiserade gynekologiska screeningen [5]. Kvaliteten har också utvärderats i en nationell studie [6]. I dessa arbeten framgår tydligt att screeningen har två dominerande svagheter. Den ena är en otillfredsställande täckningsgrad genom att ett antal kvinnor inte kommer till barnmorskemottagning för provtagning [6, 7]. Orsakerna till det har analyserats vetenskapligt men någon enkel åtgärd för att förbättra situationen har inte gått att finna [8]. Nära 65 procent av alla fall av livmoderhalscancer i Sverige, cirka 300 fall per år, drabbar kvinnor som väljer att inte delta i screeningen [6].
Den andra svagheten är att den cytologiska analysen inte har en helt tillfredsställande sensitivitet. Omkring 25 procent av alla kvinnor med livmoderhalscancer har fått besked att det senaste cellprovset var normalt [6]. För att ytterligare minska frekvensen livmoderhalscancer i landet är det uppenbart att täckningsgraden måste förbättras och att HPV-test med hög sensitivitet måste införas i den primära screeningen.
Hälso- och sjukvårdsförvaltningen i Uppsala läns landsting har uppmärksammat den organiserade screeningens brister och stöder sedan år 2005 ett projekt där kvinnor som inte deltagit i den organiserade screeningen erbjuds att utföra självprovtagning i hemmet [9-11]. Provet analyseras på laboratorium med avseende på förekomst av högrisk-HPV. En del av de hittills erhållna resultaten redovisas i detta arbete.
Material och metod
Den gynekologiska hälsokontrollen i Uppsala län styrs liksom i de flesta län i Sverige av ett dataprogram (SymPathy, TietoEnator AB, Malmö). I detta register kan de kvinnor (23–60 år gamla) som omfattas av den organiserade screeningen studeras. Till den aktuella studien gjordes i början av år 2008 ett slumpmässigt urval i länet av 3 000 kvinnor, 30–58 år gamla, som inte deltagit i den organiserade gynekologiska hälsokontrollen på över 6 år. Bland dessa kunde 184 avföras på grund av utflyttning eller tidigare utförd hysterektomi. Resterande 2 816 kvinnor fick ett informationsbrev och ett erbjudande om att gratis beställa ett kit för självprovtagning i hemmet (Qvintip self-sampling device, Aprovix AB, Uppsala). En detaljerad beskrivning av hur provtagningen går till och uppgift om metodens validitet har redovisats i tidigare publikationer [9-11].
De inkomna proven (vaginalsekret) analyserades för påvisande av högrisk-HPV med Hybrid Capture-teknik (HC2) (Qiagen, Solna, Sverige). HPV-analysen identifierar 13 typer av högrisk-HPV (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 och 68). De kvinnor som var infekterade med högrisk-HPV fick meddelande om detta i ett brev till hemmet. Samtidigt gavs information om att vidare utredning skulle erbjudas på Akademiska sjukhusets kvinnoklinik. Vid denna undersökning utfördes cervixbiopsi och cervixsekret samlades in för cytologi och förnyad HPV-analys.
Resultat
Acceptansen bland kvinnorna för att utföra provtagning i hemmet var 40 procent (1 114 av 2 816). Av de 1 114 kvinnor som utförde självprovtagning i hemmet var 74 positiva för högrisk-HPV (6,6 procent). HPV-prevalensen sjönk betydligt med åldern, men var hög hos de unga kvinnorna (11,1 procent) (Tabell I).
Av de 74 HPV-positiva kvinnorna undersöktes 65 av läkare på kvinnoklinikens mottagning (varav två vid annat sjukhus) med cytologiprov, HPV-test och portiobiopsi. Tre kvinnor vände sig till sin lokala barnmorskemottagning som tog prov för cytologi och HPV-test men ingen portiobiopsi. Sex kvinnor har inte infunnit sig för vidare undersökning.
Vid den kompletterande utredningen som utfördes 2–9 månader efter självprovtagningen i hemmet var 73 procent fortfarande positiva för högrisk-HPV medan 27 procent var HPV-negativa. Av de HPV-positiva kvinnorna visade 42 procent (18/43) morfologiska CIN2–3-förändringar, 23 procent (10/43) CIN1-förändringar, medan 35 procent (15/43) visade normal eller benign bild. Ingen kvinna med CIN2–3-förändringar var HPV-negativ (Tabell II). Det förekom ingen tydlig åldersskillnad. CIN2–3-förändringar påvisades hos 30 procent (8/27) av de kvinnor som var 40 år eller äldre och hos 35 procent (13/37) av kvinnorna som var under 40 år.
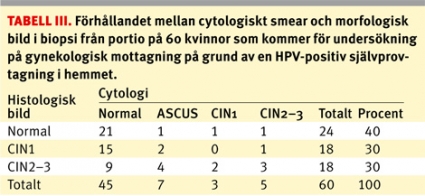
Cytologiprov togs på 60 kvinnor i samband med portiobiopsi. Av dessa hade 75 procent (45/60) normal cytologi, 17 procent (10/60) hade ASCUS–CIN1-förändringar och 8 procent (8/60) hade CIN2–3-förändringar. Av 18 kvinnor med morfologiska CIN2–3-förändringar i en vävnadsbiopsi visade den cytologiska undersökningen normal bild i 50 procent (9/18) av fallen, ASCUS–CIN1-förändrinar i 33 procent (6/18) av fallen och CIN2–3-förändringar i 17 procent (3/18) av fallen (Tabell III).
DIskussion
Den gynekologiska hälsokontroll, som infördes i slutet av 1960-talet, har under åren blivit föremål för relativt omfattande vetenskapliga undersökningar. Dessa har av naturliga skäl till största delen berört förhållanden som gäller för de kvinnor som deltar i screeningen. Under senare år har det blivit alltmer uppenbart att den mindre grupp kvinnor som inte deltar utgör ett större problem än vad deras antal motsvarar. Screeningen innehåller uppenbart en inbyggd snedfördelning som innebär att kvinnor med låg relativ risk att utveckla livmoderhalscancer kommer för provtagning, medan de kvinnor som löper högre risk att få cancer uteblir [6, 7]. Detta resonemang stöds av undersökningen, som visar att nära 65 procent av alla cancerfall drabbar den andel kvinnor som inte deltar [6] och att HPV-prevalensen är betydligt högre bland kvinnor som inte omfattas av screeningen [12].
Omkring 40 procent av de kvinnor som inte deltagit i den gynekologiska cellprovstagningen i Uppsala län accepterade att utföra självprovtagning i hemmet. Självprovtagning verkar därför ha förutsättningar att bli en betydelsefull åtgärd för att öka deltagarfrekvensen och på sikt även sänka cancerfrekvensen. Stöd för detta påstående finns i en ännu inte publicerad studie i Uppsala län där 2 000 kvinnor erbjöds självprovtagning i hemmet medan 2 000 kvinnor (kontrollgrupp) erbjöds cellprovstagning på barnmorskemottagning inom ramen för den ordinarie gynekologiska cellprovstagningen. I båda grupperna var kvinnorna 40–60 år gamla och hade inte deltagit i cellprovstagning på över 6 år. De två grupperna var slumpmässigt randomiserade. I kontrollgruppen tog 9 procent cellprovs och i den andra gruppen utförde 34 procent självprovtagning i hemmet inom ett år. Benägenheten att utföra självprovtagning i hemmet kan dock variera och liksom täckningsgraden i den gynekologiska hälsokontrollen uppvisa betydande regionala skillnader [5].
En HPV-analys har betydligt högre sensitivitet än cytologisk screening när det gäller att påvisa precancerösa cellförändringar på portio [4]. Det är rimligt att påstå att HPV-analysen har en sensitivitet på omkring 95 procent. Varför har då inte HPV-analyser ersatt cellprovstagning, som har en betydligt lägre sensitivitet? Förklaringen anses vara att HPV-infektioner är mycket vanliga och att många kvinnor har en övergående infektion och inte drabbas av cellförändringar. Denna uppfattning grundar sig dock på bristande kunskap om HPV-prevalensen hos medelålders och äldre kvinnor. Hos kvinnor över 40 år är det emellertid ungefär lika många eller färre som är HPV-positiva än som har cellförändringar (Tabell I) (13). Det innebär att HPV-testet hos dessa kvinnor har både högre sensitivitet och högre specificitet än cellprovstagning [14]. I takt med att HPV-analyser nu blir billigare och betingar ungefär samma kostnad som cellprovstagning finns det argument för att använda högrisk-HPV-test i primärscreeningen för att förebygga livmoderhalscancer hos medelålders och äldre kvinnor.
Den cytologiska screeningens begränsade sensitivitet är välkänd [5, 15]. Detta förhållande är uppenbart i vårt material. Endast hälften av de kvinnor som i HPV-testet hade morfologiskt verifierade precancerösa cellförändringar (CIN2–3) på livmodertappen visade cellatypi vid den cytologiska screeningen (Tabell III), och den andra hälften hade normal cytologi. Vår studie tyder på att hälften av de kvinnor som hade precancerösa cellförändringar på portio inte blivit diagnostiserade vid en cytologisk hälsoundersökning. Eftersom den cytologiska diagnostiken visar stora regionala variationer kan dock denna effekt variera beroende på var i landet man befinner sig.
I den retrospektiva nationella studien anges att omkring 25 procent av alla fall av livmoderhalscancer drabbar kvinnor som går på regelbundna kontroller men får besked att cellprovset är normalt, vilket på nationell nivå sannolikt motsvarar över 100 fall av livmoderhalscancer per år [6].
Konklusion
Denna studie tyder, liksom flera tidigare, på att ett erbjudande om självprovtagning i hemmet och HPV-test till de kvinnor som inte deltar i den organiserade gynekologiska cellprovskontrollen kan öka deltagandet och minska frekvensen cervixcancer. Att erbjuda medelålders och äldre kvinnor som deltar i screeningen en högrisk-HPV-analys som alternativ till primär cellprovstagning kan sannolikt minska frekvensen livmoderhalscancer ytterligare. Allmän vaccination mot HPV-infektion kommer sannolikt att ha en motsvarande eller ännu större effekt, men den kommer inte att kunna registreras förrän om 20–30 år [16].
*
Potentiella bindningar eller jävsförhållanden: Erik Wilander är minoritetsägare i Aprovix AB, Uppsala. Arbetet har varit föremål för etisk granskning (diarienummer 2004:M-202 och 2009/001).