Sammanfattat
Hjärttransplantation har utförts i Sverige sedan 25 år.
Cirka två tredjedelar av alla hjärttransplantationer i Sverige har genomförts i Göteborg.
Våra resultat är helt jämförbara med resultaten vid andra stora centra runt om i världen.
Överlevnaden är i dag ca 90 procent efter 1 år, 60 procent efter 10 år och 30 procent efter 20 år. Överlevnaden för barn är väsentligt bättre.
Långtidsmorbiditeten är i dag inte högre än tidigare trots att vi transplanterar äldre och sjukare patienter, med samtidigt mekaniskt stöd, med samtidig njurtransplantation eller retransplantation.
Resultaten efter retransplantation är goda för selekterade patienter. Retransplantation bör alltid övervägas för alla yngre och medelålders som drabbas av graftsvikt.
Hjärttransplantationsvården står inför en strukturomvandling i och med att Rikssjukvårdsnämnden beslutat att denna vård ska klassas som rikssjukvård.
Det är allmänt känt att den första lyckade hjärttransplantationen i världen utfördes av Christiaan Barnard 1967 i Sydafrika [1]. Mindre känt är att kirurgerna Norman Shumway och Richard Lower vid Stanforduniversitetet i Kalifornien knappt tio år dessförinnan hade påbörjat experimentella arbeten med hjärttransplantation på hund. De genomförde framgångsrikt hjärttransplantation på hund, med azatioprin och kortikosteroid som immunsuppression, där majoriteten av hundarna överlevde 1–3 månader [2]. Lower flyttade till Medical College of Virginia, dit sedermera Barnard sökte sig som »clinical fellow« för att lära sig den experimentella hundmodellen [3]. Barnard flyttade sedan hem till Groote Schuur-sjukhuset i Kapstaden, Sydafrika, och förberedde sig och teamet genom att göra ett stort antal experimentella hjärttransplantationer. Den första lyckade hjärttransplantationen på människa genomfördes av Barnard och hans team den 3 december 1967.
Under det följande året genomfördes sammanlagt mer än 100 hjärttransplantationer på ett tiotal kliniker runt om i världen, men behandlingen kom fort i vanrykte då flertalet patienter dog, i främst avstötningar (rejektioner) eller infektioner. Under resten av 1960-talet och 1970-talet fortsatte främst Stanfordgruppen att utveckla metoden, och ettårsöverlevnaden förbättrades från 22 till 65 procent mellan 1968 och 1978. Inte minst viktigt var att gruppen formulerade definitioner av donator- och recipientkriterier samt utvecklade metoden för transvenös endokardiell myokardbiopsi som ett instrument för att diagnostisera rejektioner [4]. Norman Shumway har i efterhand kommit att kallas för »hjärttransplantationens fader« trots att han inte genomförde den första lyckade proceduren på människa.
Det är nu 25 år sedan den första svenska hjärttransplantationen genomfördes i Göteborg av Göran William-Olsson och hans team. Professorerna Finn Waagstein och Göran William-Olsson hade en mycket viktig roll under de första åren. Vi har tidigare skrivit om våra tidiga resultat [5, 6], men nu rapporterar vi vår samlade 25-åriga erfarenhet av hjärttransplantation.
Material och Metoder
Patienter
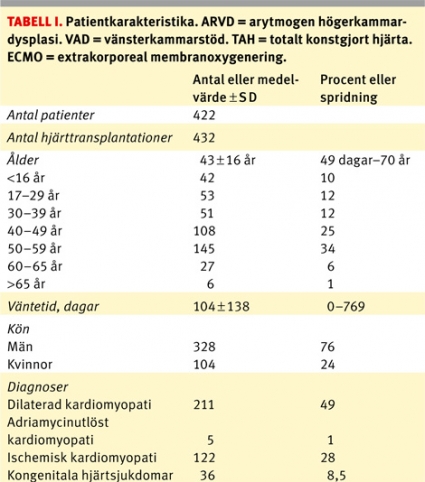
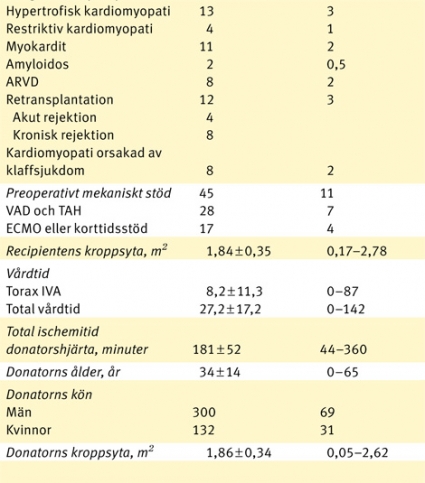
Mellan 21 juni 1984 och 31 december 2008 har 458 patienter genomgått transplantation med hjärta, antingen endast hjärta (n = 422) eller kombinerad hjärt–lungtransplantation (n = 36) i Göteborg. Denna rapport baserar sig dock endast på de 422 patienter (medelålder 43 ± 16 år, medianålder 47 år, spridning 49 dagar–70 år) som genomgått sammanlagt 432 hjärttransplantationer i Göteborg. För patientkarakteristika, se Tabell I. Vi rapporterar data till det nordiska transplantationsregistret och till International Society of Heart and Lung Transplantation (ISHLT) på årlig basis, och denna information samt data ur journalhandlingar ligger som underlag för denna retrospektiva analys.
När vi undersökte långtidsöverlevnaden grupperade vi barnen (<16 år) för sig och de vuxna enligt följande tidsintervall: 1984–1993, 1994–2003 och 2004–2008. Inga patientdata saknades, så uppföljningen blev komplett avseende överlevnad. Stängningsintervallet, intervallet under vilket överlevnaden kontrollerades, var 1–31 januari 2009 med en medeluppföljningstid på 87,0 ± 74,2 månader (median 70,7, intervall 1–256 månader).
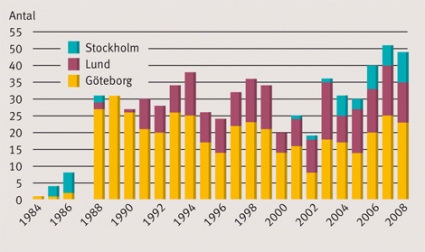
Mellan 1984 och 2008 har det i Sverige genomförts 675 hjärttransplantationer med fördelningen Göteborg 432, Lund 198, Stockholm 45 (Figur 1) [7]. Således har 64 procent av alla hjärttransplantationer i Sverige genomförts i Göteborg. Tretton transplantationer gjordes med hjärtan donerade från andra länder före 1988, då Sverige fick en ny lag gällande dödsbegreppet.
Donerade hjärtan till våra patienter har kommit från följande regioner: Göteborg inklusive Västra Götaland 92 (21 procent), Umeå 53 (12 procent), Linköping 32 (7,5 procent), Stockholm/Uppsala 113 (26 procent), Malmö/Lund 34 (8 procent), Norge 55 (13 procent), Danmark 18 (4 procent), Finland 14 (3 procent), Island 2 (0,5 procent), övriga Europa 16 (4 procent) och oregistrerade 3 (1 procent).
Avancerad hjärtsviktsvård
Alla patienter som blir föremål för en hjärttransplantationsutredning har dessförinnan genomgått försök med eller behandlats med hjärtsviktsmediciner. All annan medicinsk och kirurgisk behandling har övervägts eller prövats innan patienten har accepterats för att sättas upp på väntelista för hjärttransplantation.
Indikation för hjärttransplantation har varit hjärtsviktsklass NYHA IIIb–IV (hjärtsviktssymtom vid minimal ansträngning eller i vila) eller okontrollerbara arytmier. Alla patienter har genomgått hjärtkateterisering för att utesluta allvarlig pulmonell hypertension. Lungkärlsresistansen ska i princip ligga under 3 Woodenheter (WE, 240 dyn × s × cm) med eller utan dilatation. Vi har haft en dilaterad pulmonell vaskulär resistans (PVR) på 3,5 WE som övre gräns för att accepteras för hjärttransplantation. Vid högre värden kan ett vänsterkammarstöd (left ventricular assist device, LVAD) övervägas, vilket ofta får hög lungkärlsresistans att gå i regress, varefter patienten kan bli transplantabel.
Vidare anses följande vara relativa kontraindikationer: malignitet de senaste fem åren, diabetes mellitus med komplikationer, pågående rökning, uttalad social problematik eller förväntad dålig ordinationsföljsamhet. Under senare år har allt fler patienter med nedsatt njurfunktion (glomerulär filtrationshastighet, GFR, mätt med 51Cr-EDTA-clearance eller iohexol-clearance under 40 ml/min × 1,73 m2) övervägts för kombinerad hjärt- och njurtransplantation.
Under åren 1984 till och med 2008 har sammanlagt 565 patienter varit listade vid 585 tillfällen på vår väntelista för hjärttransplantation med följande utfall: genomgången hjärttransplantation 432 (74 procent), avlidna på väntelistan 83 (14 procent), avförda på grund av förbättring 22 (4 procent) eller försämring 41 (7 procent) samt aktiv väntelista 7 (1 procent). De som avlidit på väntelistan hade varit listade 113 ± 139 dagar (median 62) jämfört med dem som transplanterats, som hade väntat 104 ± 138 dagar (median 51).Kirurgisk procedur
Alla patienter har opererats via median sternotomi och med hjälp av hjärt–lungmaskin. Metoden var initialt att sy in hjärtat med s k biatrial teknik, där man sydde donatorhjärtats högra förmak till recipientens högra förmak strax proximalt om atrioventrikulärplanet. Denna teknik ersattes under mitten av 1990-talet av s k bikaval teknik, där donatorns vena cava inferior och superior i stället sys mot recipientens motsvarande anatomiska strukturer. Denna teknik minskar risken för trikuspidalinsufficiens och resulterar i en enda, från graftet fungerande sinusknuta.
Över tiden har populationen patienter som blir föremål för hjärttransplantation förändrats. I början var det kirurgiska ingreppet nästan alltid okomplicerat, men detta har förändrats, och patienterna har i dag oftast genomgått en tidigare hjärtoperation, oftast kranskärlskirurgi. För att förbättra möjligheterna att överleva till transplantation har allt fler patienter sedan mitten av 1990-talet försetts med s k implanterbart pumpstöd, vilket komplicerat procedurerna rent kirurgiskt.Anestesi och intensivvård
Allmän kunskapsutveckling och mångårig lokal erfarenhet och forskning inom toraxanestesiologi och intensivvård har successivt förbättrat omhändertagandet av hjärttransplanterade. Framför allt har behandlingen av postoperativ högerkammarsvikt och den kroniska hjärtinsufficiensens sekundära manifestationer i form av pulmonell hypertension och njurinsufficiens utvecklats. Ändamålsenliga sätt att administrera moderna, effektiva inotropa och/eller vasodilaterande farmakologiska medel har resulterat i anmärkningsvärt goda resultat. Vidare har utveckling av teknisk utrustning och därmed associerad kunskap resulterat i lättillgänglig och effektiv monitorering av hjärtfunktion samt diagnostik av komplikationer med ultraljud och analys av cerebral oxygenering [8-11].Immunsuppression och akut rejektion
Alla patienter som genomgår organtransplantation måste medicineras med immunhämmande medel i syfte att undvika rejektion. Vi har sedan programmet startade använt trippelbehandling med en kalcineurinhämmare (ciklosporin eller takrolimus), en antimetabolit (azatioprin eller mykofenolatmofetil) och en kortikosteroid. De flesta patienter har även behandlats med antitymocytglobulin (ATG) tidigt postoperativt för att förhindra tidig rejektion.
Akut rejektion har i första hand behandlats med hög dos kortikosteroid under tre dagar och i andra hand med olika antikroppar. För att så tidigt som möjligt diagnostisera en rejektion, där patienten ibland kan vara helt asymtomatisk, genomförs sammanlagt 14 transvenösa perkutana myokardbiopsier under det första året efter transplantation. Statiner används i lägre doser än för icke-transplanterade för behandling av hyperlipidemi efter hjärttransplantation och har i flera studier visats minska antalet cellmedierade och humorala rejektioner.Kronisk rejektion eller graftvaskulopati
Kronisk rejektion är ett generellt problem efter all organtransplantation och en process som leder till ateroskleros av kranskärlen. Orsaken är inte klarlagd, men ett antal riskfaktorer är kända, såsom den immunsuppressiva medicineringen, rejektioner, cytomegalovirus (CMV)-infektioner, hypertoni, hyperlipidemi och diabetes. Kronisk rejektion i ett hjärta diagnostiseras rutinmässigt med koronarangiografi. Intrakoronart ultraljud är dock att föredra, framför allt i oklara fall, eftersom graftvaskulopati engagerar hela koronarkärlsväggen, medan segmentella stenoser ofta inte förekommer som vid sedvanlig koronarsjukdom.
Kriterier för kronisk rejektion är antingen fokal stenos, >50 procent, i ett kranskärl och/eller småkärlssjuka med mycket smala kranskärl perifert. Vid kronisk rejektion får patienten inte angina pectoris eftersom det transplanterade hjärtat är denerverat. Koronarangiografi görs därför årligen från och med första årskontrollen till fem år efter hjärttransplantation som screening och därefter på ordination, eftersom stressekokardiografi kan utföras utan kontrast för att undvika belastning på njurarna.
Malignitet
Patienter som utsätts för immunsuppression löper på lång sikt risk för att utveckla malignitet. Den vanligaste är hudtumörer, och som en del i den årliga kontrollen bör patienterna träffa en hudläkare. Transplanterade patienter kan också drabbas av lymfomliknande tillstånd, inkluderande plasmacytom, som kallas post transplant lymphoproliferative disorder (PTLD). PTLD är i dag mindre vanligt än tidigare.
Infektioner
Immunsupprimerade patienter är känsliga för opportunistiska infektioner, framför allt svamp, men även för reaktivering av latenta virus i den egna kroppen, primär infektion av t ex Pneumocystis carinii och Toxoplasma gondii eller virus från det donerade organet. CMV är relativt vanligt förekommande, så patienternas plasmatitrar mäts regelbundet för eventuell behandling i förebyggande syfte. Obehandlad primär CMV-infektion var tidigare ofta letal men kan även resultera i accelererad kronisk rejektion.
Retransplantation
I selekterade fall kan yngre patienter accepteras för ytterligare en transplantation. Under många år har inställningen till retransplantation varit ytterst restriktiv. Indikationer för retransplantation har varit tidig akut terapiresistent rejektion eller kronisk graftvaskulopati med hjärtsvikt hos yngre patienter utan övrig allvarlig organpåverkan. Vi har blivit alltmer liberala med retransplantation och har mest haft goda erfarenheter av denna policyförändring.
Statistik
Tidig mortalitet definieras som död inom 30 dagar efter kirurgi. Kontinuerliga variabler redovisas som medelvärde ± SD. Observerad överlevnad i form av aktuarieöverlevnad hos patienterna analyserades med hjälp av s k life table-teknik (Kaplan–Meier). Kurvorna är konstruerade med dataprogrammet Statistica (version 6.0). Skillnader i överlevnad mellan grupper analyserades med Cox–Mantels log-rank-test.
Resultat
Tidiga resultat
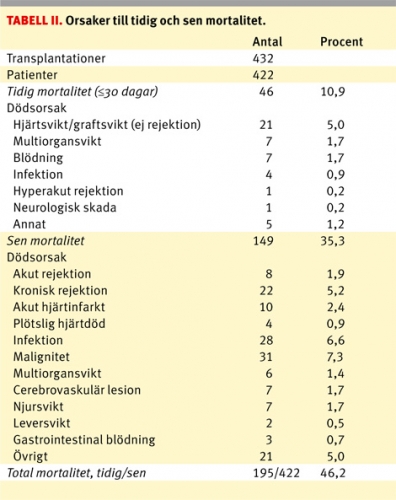
Den tidiga mortaliteten för hela populationen, dvs mortalitet inom 30 dagar, och mortaliteten inom 1 år är 46/422 (10,9 procent) respektive 70/411 (17 procent). Aktuarisk överlevnad vid 30 dagar är 89 ± 1 procent för hela populationen. För orsaker till tidig mortalitet, se Tabell II. Tolv patienter har genomgått retransplantation, två primärt opererade i England och övriga tio i Göteborg, där endast 1/12 (8 procent) avlidit inom 1 år efter retransplantation. Tio patienter har opererats med samtidig njur- och hjärttransplantation (två av dessa var retransplantationer), där 2/10 patienter avlidit inom 30 dagar. Mekaniskt kort- eller långtidsstöd har använts hos 45 (11 procent) patienter för att klara väntetiden fram till transplantation. Antalet patienter som genomgått behandling för en rejektion under första året är 68 procent. För vårdtider se Tabell I.
Långtidsresultat
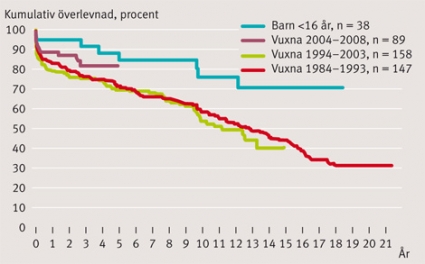
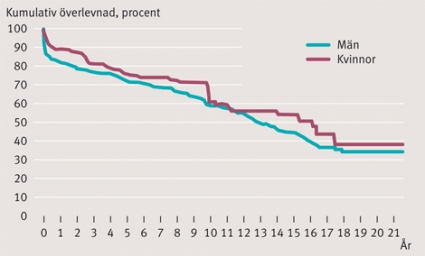
Långtidsöverlevnaden är vid 1, 5, 10, 15 och 20 år: 83 ± 2 procent, 73 ± 2 procent, 59 ± 3 procent, 44 ± 3 procent respektive 30 ± 4 procent i hela patientpopulationen. Överlevnaden för patienter transplanterade den senaste femårsperioden (2004–2008) är vid 1 och 3 år: 90 ± 3 procent respektive 81 ± 6 procent. Aktuarisk överlevnad redovisas med Kaplan–Meier-kurvor uppdelat för vuxna efter olika tidsintervall och för barn (Figur 2) och även för kön (Figur 3). Ingen skillnad i överlevnad noterades mellan män och kvinnor över tiden (P = 0,3). Överlevnaden för barn under 16 år var vid 1, 5, 10 och 15 år: 95 ± 4 procent, 85 ± 7 procent, 76 ± 9 procent respektive 70 ± 14 procent. För orsaker till sen mortalitet, se Tabell II.
Under åren har sammanlagt 33/422 (7,8 procent) patienter drabbats av PTLD vid 35 tillfällen, varvid 14 har behandlats framgångsrikt. Av dessa har sammanlagt 16/33 (48 procent) avlidit till följd av PTLD. Ytterligare 27/422 (6,4 procent) har drabbats av solitära tumörer med cancer i följande organ: lunga 11, prostata 3, bröst 3, ventrikel 3, esofagus 1, gallgång 1, sarkom 1, lever 1, testis 1, tonsill 1, skelett 1 och oklar spridd sjukdom 1. Av dem som drabbats av solitär cancer har 13/27 (48 procent) avlidit till följd av denna sjukdom. Hudcancer i olika former har 42/422 (9,9 procent) patienter fått behandling mot.
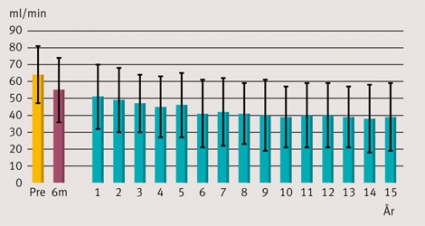
Patienter över 16 år som transplanterades fram till och med 1996 hade i genomsnitt en njurfunktion, mätt med GFR, på 64,1 ± 15,3 ml/min, och gruppen som transplanterats de senare tolv åren hade ett GFR i genomsnitt på 63,3 ± 18,0 ml/min (P =0,64). Åtta patienter har efter hjärttransplantationen genomgått separat njurtransplantation på grund av progredierande njurinsufficiens. Patienternas GFR, exkluderat barn 16 år och yngre, har efter hjärttransplantation utvecklats över tiden enligt Figur 4.
Diskussion
Behandling av svår hjärtsvikt innefattar komplicerade bedömningar som kan resultera i att patienten till slut rekommenderas hjärttransplantation och sätts upp på väntelista för detta. Vi har tidigare visat att de patienter som inte accepteras för transplantation, antingen på grund av kontraindikation eller för att de är kliniskt »för bra«, i mer än 20 procent av fallen kommer att avlida i sin grundsjukdom [12]. Modern hjärtsviktsbehandling har gått framåt snabbt, men behandlingen för den riktigt svåra hjärtsvikten, både farmakologisk och interventionell med implantation av biventrikulär pacemaker och annan kirurgisk behandling, har blivit alltmer komplex.
När ingenting annat fungerat vid terminal hjärtsvikt är och förblir hjärttransplantation den etablerade standardbehandlingen (gold standard) i alla behandlingsprogram runt om i världen. När våra patienter väl blivit uppsatta på väntelistan har 74 procent transplanterats efter i medeltal 113 dagar; dessvärre har även 14 procent på väntelistan avlidit. Över åren har dödligheten bland patienter på väntelistan minskat då vi fått tillgång till kompletterande metoder som mekaniskt stöd, vilket möjliggjort överlevnad fram till transplantation för de allra svårast sjuka patienterna.
God överlevnad i långtidsjämförelser
Överlevnaden efter hjärttransplantation i Göteborg är helt i paritet med vad andra etablerade institutioner redovisar vid långtidsuppföljningar [13-15]. Våra resultat framstår som minst lika goda vid jämförelse med ett av de största programmen i USA, det vid Columbiauniversitetet i New York, som utfört mer än 1 000 hjärttransplantationer och rapporterat en överlevnad vid 5 och 10 år på 66 respektive 45 procent [13]. Samtidigt kan man konstatera, återigen vid jämförelse med Columbiauniversitetet, att vi varit konservativa och inte accepterat äldre (över 65 år) recipienter i den utsträckning man gjort på vissa andra ställen, vilket naturligtvis delvis kan förklara våra goda resultat.
Överlevnaden bland patienterna som transplanterats i Göteborg är för övrigt helt jämförbar med den som redovisas från Nantes i Frankrike (75, 58 respektive 42 procents överlevnad efter 5, 10 respektive 15 år) [16] samt även i paritet med den som rapporteras från Cleveland (54 och 42 procents överlevnad efter 10 respektive 15 år) [15]. I vår rapport är överlevnaden vid både medellång och lång uppföljning bättre än vad det stora ISHLT-registret redovisar; till skillnad från vårt material har i detta register medelåldern successivt ökat, och i dag är nästan 25 procent av dem som årligen inrapporteras över 60 år [17]. Dessutom innehåller vårt patientmaterial även 36 barn, något som ISHLT-registret redovisar separat. Vi har inte opererat lika många äldre patienter som vissa andra program, men våra patienter genomgår väsentligt mer komplicerade kirurgiska ingrepp (långtidsimplanterbara vänsterkammarstöd, retransplantationer, samtidig hjärt- och njurtransplantation osv) än förr.
Resultaten efter retransplantation i vår population är lika goda som resultaten bland förstagångstransplanterade, varför patienter som tidigare transplanterats och drabbats av kronisk rejektion liberalt kan accepteras för ny hjärttransplantation. Trots att vi i dag även accepterar äldre donatorer i större utsträckning har vi sammantaget, tack vare förbättrad kirurgi, anestesi och intensivvård, bättre resultat än decennierna dessförinnan. Att acceptera äldre och sjukare patienter för hjärttransplantation medför naturligtvis en förhöjd risk för sämre resultat, men andra har visat att även äldre recipienter kan genomgå hjärttransplantation med endast marginellt sämre resultat än yngre patienter [18, 19]. Data från organdonationsmyndigheten i USA, United Network for Organ Sharing (UNOS), visar att patienter över 60 år har 70-procentig 5-årsöverlevnad och därmed inte bör nekas denna behandlingsmöjlighet [20].
Långtidskomplikationerna minskar
Överlevnaden efter hjärttransplantation har förbättrats kontinuerligt under de senaste decennierna, och det finns nu även registerdata som visar att långtidskomplikationerna minskar över tiden. Kronisk rejektion eller graftvaskulopati, svår njursvikt och malignitet förekommer alla mer sällan under senare år än tidigare [17]. Risken under de första sju åren efter hjärttransplantation att utveckla svår njursvikt är associerad med följande preoperativa riskfaktorer: diabetes mellitus, ålder, kreatinin och hypertoni [17].
Vi har i denna rapport visat att njurfunktionen hos hjärttransplanterade över tiden, mest uttalat under första året, går ned med ca 30 procent. Ett antal patienter har på grund av njursvikt genomgått njurtransplantation långt efter hjärttransplantationen. Under senare år har vi även genomfört samtidig hjärt- och njurtransplantation när patienterna redan före transplantation haft avancerad njursvikt. Orsakerna till njursvikt efter hjärttransplantation är relaterade till flera faktorer, där den främsta anses vara den immunhämmande behandlingen, främst kalcineurinhämmare, som alla patienter behandlas med. Då den immunhämmande behandlingen förbättrats är detta säkert en av orsakerna till att njursviktsproblematiken i dag är mindre än tidigare.
Även PTLD och andra maligniteter förekommer mindre ofta hos patienter transplanterade under senare perioder, troligen relaterat till mindre aggressiv immunsuppression. Riskfaktorer för att utveckla malignitet har befunnits vara patientens ålder men även centrumets storlek. Patienter som transplanterats på centrum med stor volym har signifikant lägre risk att utveckla malignitet över tiden [17].
Rikssjukvård och fördelar med högvolymcentra
Socialstyrelsen har under 2008 genomfört en rikssjukvårdsutredning och beslutat att hjärttransplantation och lungtransplantation i framtiden ska bedrivas som rikssjukvård [21]. Det finns data som visar att centrumvolymen har signifikant betydelse för mortaliteten inom en rad andra kirurgiska subdiscipliner såsom lung-, cancer-, esofagus-, karotis- och pankreaskirurgi [22-26]. Inte bara dödligheten påverkas av ett centrums volym utan högvolymcentra har också kortare sjukhusvårdtid [27], lägre grad av återinläggning på grund av komplikationer [28] och lägre kostnad [29, 30].
Vid UNOS, som samordnar all organdonation enligt strikta regler och som för viss statistik gällande organtransplantation, kan man nu även påvisa en skillnad mellan hög- och lågvolymcentra när det gäller hjärttransplantation. UNOS-registret är inte läkarstyrt och inte behäftat med den partiskhet som enstaka institutioner som bedriver likartad verksamhet kan misstänkas för och får därför anses som en mer tillförlitlig källa. UNOS data har analyserats från åren 1996 till 2006, med minst ett års uppföljning från mer än 140 centra i USA, och inkluderar mer än 14 000 hjärttransplantationer. Man kunde påvisa en signifikant bättre 30-dagsöverlevnad vid stora centra än vid små [31]. Då exkluderades ändå retransplantationer och barn.
Man konkluderade även att patienter opererade på centra som utförde mindre än tio hjärttransplantationer per år hade dubbelt så hög risk att avlida inom 30 dagar. I en multivariat logistisk regressionsanalys visade man att vid centra med mer än 40 hjärttransplantationer per år hade patienterna endast 5 procents risk att avlida inom 30 dagar, och författarna rekommenderade därför att man borde revidera uppfattningen att det räcker med en centrumstorlek på tio procedurer per år för att bli ackrediterad enligt amerikanska regler [32]. I Storbritannien har man nyligen minskat antalet hjärttransplantationscentra till sex med en population som är ca 60 miljoner, dvs ett centrum per 10 miljoner invånare. Slutligen kan poängteras att i det största registret, ISHLT-registret, dit även vi i Sverige rapporterar, med mer än 80 000 hjärttransplantationer inrapporterade, har man med en linjär regressionsanalys visat att patienter opererade vid små centra har signifikant högre 1-årsmortalitet [17].
Framtidens utmaningar
Sverige står inför förändringar inom hjärttransplantationsvården, då denna verksamhet kommer att bli rikssjukvård från och med 2010. Framtiden tillhör de enheter som lyckas höja den här kunskapen ytterligare en nivå, men forskning och klinisk utveckling är inte bara kostsam utan också känslig för små volymer, det senare även styrkt av Vetenskapsrådets sammanfattning i underlaget till att rekommendera hjärttransplantation som rikssjukvård [33]. Nya metoder behöver utforskas och värderas både experimentellt och kliniskt i framtiden, såsom användningen av nya immunsuppressiva läkemedel, användningen av hjärtdöda donatorer (non-heart-beating-donors), xenotransplantation, inducerad toleransutveckling och innovationer rörande organoptimering – bara för att nämna några. Andra transplantationsassocierade metoder som vissa avancerade mekaniska pumpstöd, exempelvis systemet med totalt konstgjort hjärta (total artificial heart, TAH) som vi nu implanterat i två patienter, kräver stora ekonomiska och utbildningsmässiga insatser.
Den gemensamma nämnaren för dessa och andra framtidsområden är att denna utveckling är kostsam, och om vi i Sverige ska kunna delta behöver vi kraftsamla både ur ett kostnadsperspektiv men kanske ännu mer ur ett bemanningsperspektiv, då detta kräver en stor samlad kritisk massa av kunskap och kompetens. Kostnadseffektiviteten för jourlinjer, vilket alla transplantationsenheter behöver ha dygnet runt året om, blir sämre med låg volym. Utbildningsaspekterna är kanske ännu viktigare, då det är svårt att på ett säkert sätt utbilda nya yngre kolleger i att utföra alla moment som är nödvändiga runt den transplanterade patienten på ett lågvolymcentrum.
Utan tvivel står transplantationsvårdens framtid inför många svårigheter, där vi av nödvändighet behöver utföra dessa procedurer inte bara billigare utan också på fler äldre patienter, med bättre resultat och med mer marginella organ som vi lär oss optimera på olika sätt. Naturligtvis får man för de äldre recipienterna använda äldre donatorer, vars hjärtan vi i dag oftast inte använder för att undvika för stor åldersskillnad mellan recipient och donator, med tanke på långtidsresultaten. Långtidsöverlevnad är dock något relativt, där hög överlevnad efter 10 och 20 år är ett viktigt krav för en yngre patient, medan en hygglig överlevnad ur ett 5- och 10-årsperspektiv kan vara fullt tillräckligt för en 70-åring med svår hjärtsvikt och dålig livskvalitet. Redan i dag blir många förvånade över hur bra resultaten är efter hjärttransplantation, men vi tror att det finns ytterligare stor förbättringspotential för denna behandlingsmetod!
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Patientkoordinatorerna Ulla Nyström, Katarina Karlsson och Ulrika Lorentzon har från verksamhetens början bidragit med insamling av patientdata.