Sammanfattat
Monoklonala immunglobuliner (M-komponenter) i serum/urin är ett karakteristikum vid de maligna blodsjukdomarna multipelt myelom och Waldenströms sjukdom (makroglobulinemi). M-komponenter kan även förekomma vid andra B-cellslymfom.
MGUS (monoklonal gammopati av oklar signifikans) karakteriseras av närvaro av M-komponent utan samtidig förekomst av någon av de ovan nämnda sjukdomarna. MGUS är i de flesta fall ett godartat tillstånd men är förknippat med en risk för transformation till malign sjukdom på ca 1 procent per år. Risken är bestående.
Riskfaktorer för transformation är hög koncentration av M-komponenten, Ig-klass annan än IgG och avvikande kappa/lambda-ratio vid bestämning av fria lätta immunglobulinkedjor i serum.
Information till patienten och planering av uppföljning bör individualiseras med hänsyn till prognostiska faktorer, ålder och interkurrenta sjukdomar.
Riktlinjer för handläggning av patienter med nyupptäckta M-komponenter och uppföljning av patienter med MGUS har nyligen utarbetats av en arbetsgrupp från Nordic Myeloma Study Group och UK Myeloma Forum. Artikeln sammanfattar dessa rekommendationer.
Störningar i den normala plasmacellsutmognaden i benmärgen, vilket leder till abnorma kloner av celler, är ett fenomen som ses i ökande frekvens med stigande ålder. Identifikationen av en sådan onormal cellklon underlättas av att den nästan alltid producerar ett mycket specifikt immunglobulin, som när koncentrationen når en viss nivå manifesterar sig som ett smalt band vid elektroforetisk separation av proteinerna i serum (och i vissa fall i urin), en s k M-komponent. I vissa fall markerar M-komponenten (oftast i hög koncentration) närvaron av en malignt prolifererande klon, såsom vid myelom och Waldenströms sjukdom (makroglobulinemi).
Incidensen av dessa tillstånd är i Sverige ca 6/100 000 respektive <1/100 000 och år. Flertalet patienter hos vilka en (oftast liten) M-komponent påvisas har dock ingen proliferativ sjukdom, även om en sådan senare kan utvecklas. Dessa tillstånd kallades tidigare i svensk nomenklatur »benigna« eller »essentiella« M-komponenter [1], men i dag används vanligen det internationellt vedertagna begreppet »monoclonal gammopathy of undetermined significance« (MGUS) (monoklonal gammopati av oklar signifikans) [2].
Som exempel kan anges att bland 930 patienter med nyupptäckta M-komponenter i Malmö under perioden 1975–1989 blev den primära diagnosen MGUS hos 72 procent, myelom 19 procent, Waldenströms sjukdom 2 procent, annan lymfoproliferativ sjukdom 6 procent och amyloidos hos 1 procent [3].Initial bedömning ofta i primärvården
Den årliga incidensen av MGUS är inte känd, men screeningstudier visar att prevalensen i totalbefolkningen ligger på ungefär 1 procent och stiger kraftigt med ökande ålder. Hos personer 70 år och äldre är siffran 3 procent [4], och hos ännu äldre har prevalenser på över 10 procent beskrivits [5]. Nyare data från en populationsbaserad prospektiv studie i USA [6] talar starkt för att myelom alltid föregås av ett MGUS-stadium, som i de flesta fall inte har diagnostiserats. Det stora flertalet patienter med MGUS kommer däremot aldrig att utveckla myelom (se nedan).
Utredning och diagnostik av patienter med M-komponenter sker ofta mot bakgrund av att ett onormalt band iakttagits vid en serumelektrofores, som utförts som led i utredning av misstanke om andra sjukdomar, hög SR eller hälsokontroll. I några få fall finns redan primärt misstanke om hematologisk malignitet. I flertalet fall sker den initiala bedömningen inom primärvården eller hos andra icke-hematologiska specialister. För korrekt handläggning är det viktigt att de läkare som konstaterar närvaron av en M-komponent har kännedom om hur långt de själva ska bedriva den primära diagnostiken, vilka patienter som bör remitteras direkt till hematolog för vidare utredning och hur patienter med små, till synes oskyldiga M-komponenter fortsättningsvis ska följas upp.Nordisk–brittisk arbetsgrupp
I början av 2007 tillsattes en gemensam arbetsgrupp med representanter från Nordic Myeloma Study Group (NMSG) och UK Myeloma Forum (UKMF) med målsättning att utarbeta riktlinjer för utredning av patienter med nyupptäckta M-komponenter och uppföljning av MGUS. Arbetet är en uppföljning av de riktlinjer, som grupperna tillsammans tidigare publicerat rörande diagnostik och behandling av myelom [7]. Efter knappt två års arbete kunde grupperna tidigare i år enas om ett gemensam dokument, som nyligen publicerats i British Journal of Haematology [3] och som också är tillgängligt på webbadressen ‹http://www.bcshguidelines.com/pdf/MGUS_Guidelines_Final_090209.pdf›.
Vi har ingått som svenska representanter i denna arbetsgrupp och vill här lämna ett sammandrag av riktlinjerna, avpassat framför allt för läkare som primärt handlägger denna typ av patienter, i flertalet fall allmänläkare.Att skilja MGUS från myelom och annan malign sjukdom
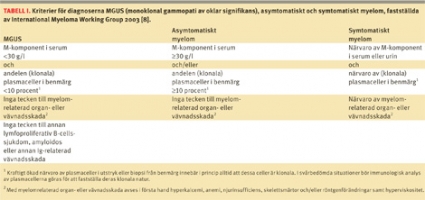
Nyligen har modifierade kriterier för diagnoserna symtomatiskt respektive asymtomatiskt myelom samt MGUS fastställts av en internationell arbetsgrupp [8] (Tabell I). För att uppfylla kriterierna för MGUS krävs sålunda att M-komponenten i serum inte överstiger 30 g/l, att andelen plasmaceller i benmärgsutstryk är mindre än 10 procent och att symtom på proliferativ plasmacellssjukdom (myeloma-related organ or tissue impairment, ROTI) saknas. Det får heller inte finnas tecken till annan lymfoproliferativ B-cellssjukdom, amyloidos eller annan Ig-relaterad vävnadsskada.
I typfallet har patienter med små M-komponenter MGUS; vid myelom, Waldenströms sjukdom och andra lymfoproliferativa sjukdomar är däremot M-komponentens koncentration vanligen hög. Undantag finns dock: såväl vid myelom som vid t ex solitära plasmocytom och AL-amyloidos (A = amyloid, L = lätt kedja) kan M-komponenten i serum vara mycket liten eller till och med saknas helt. Diagnosen är då beroende av andra avvikande laboratoriefynd och/eller symtom hos patienten (Fakta 1). M-komponenten är vid myelom nästan alltid av typ IgG eller IgA, i sällsynta fall av typ IgD, IgE eller IgM.
Waldenströms sjukdom karakteriseras av M-komponent i serum typ IgM och samtidigt en infiltration i benmärgen av lymfoplasmacytoida celler, som har en karakteristisk immunfenotyp. M-komponentens koncentration är ofta hög (>30 g/l), men fall av lägre nivå är inte ovanliga. Vid andra lymfoproliferativa sjukdomar (t ex kronisk lymfatisk leukemi och vissa typer av maligna lymfom) kan också en M-komponent, vanligen av typ IgM, förekomma.
Även vid en rad andra sjukdomar finns fynd av M-komponenter beskrivna, t ex vid reumatoid artrit och andra bindvävs-, hud- och leversjukdomar. Handläggningen i de fall M-komponenten är förenad med närvaro av annan sjukdom skiljer sig dock i princip inte från vad som rekommenderas för patienter med MGUS.
På senare tid har laboratoriemetoder som mäter koncentrationen av fria lätta immunglobulinkedjor i serum introducerats (FLC [free light chains]). En abnorm kappa/lambda-ratio kan betraktas som en surrogatmarkör för produktion av monoklonala lätta kedjor. Vissa metodologiska svårigheter föreligger dock, och metoden är ännu inte etablerad på samtliga sjukhus i landet. FLC-ratio är ett tänkbart alternativ till urinelektrofores vid screening, men vid fynd av abnorm ratio bör urinen alltid undersökas med elektrofores och immunfixation.
Mot bakgrund av den information som erhålls vid denna primära utredning bör ställning tas till om patienten bör remitteras till specialist (hematolog) för vidare utredning eller kan behållas för lokal kontroll. Även om vi i Fakta 2 anger distinkta gränser för när patienten bör remitteras, måste också stor individuell hänsyn tas till bl a patientens ålder, övriga hälsotillstånd och också till behandlande läkares erfarenhet av liknande fall. Vid osäkerhet om handläggningen rekommenderas alltid samråd med hematolog eller hematologiskt inriktad invärtesmedicinare.
I vissa situationer bör man vara speciellt vaksam, t ex där fyndet av en M-komponent är förenat med närvaro av nedsatt njurfunktion (viktigt att utesluta amyloidos), där en patient med inflammatorisk sjukdom och »anemia of chronic disease« också har en M-komponent (viktigt att säkerställa orsaken till värk/smärtor i skelettet) eller där osteoporos/osteopeni med eller utan kotkompression är förenad med närvaro av M-komponent (viktigt att detaljstudera skelettet för att utesluta myelom).
Gemensamma svenska riktlinjer för hur patienter ska utredas vid misstanke om myelom har nyligen utarbetats av Svensk förening för hematologi/diagnosgrupp myelom och är tillgängliga på ‹http://www.sfhem.se/Filarkiv/EJ-SFH-AeGDA-Dokument/Nationella-riktlinjer/(offset)/10›.
Risken för att MGUS utvecklas till malign sjukdom (myelom)
Närvaron av MGUS innebär att patienten löper ökad risk att utveckla en malign blodsjukdom (vid M-komponent typ IgG, IgA, IgD, IgE vanligen myelom; vid M-komponent typ IgM oftast Waldenströms sjukdom) jämfört med friska jämnåriga individer. I ett stort material av MGUS från Minnesota kunde Kyle och medarbetare [9] fastställa att risken var 10 procent vid 10 år, 21 procent vid 20 år och 26 procent vid 25 år. Grovt sett kan man räkna med att risken för malign transformation är 1 procent per levnadsår och oförändrad över tiden.
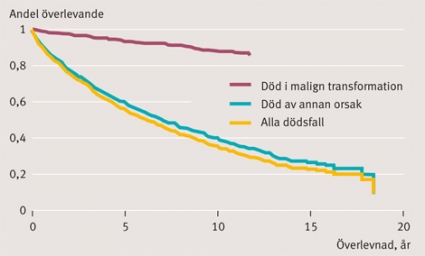
Eftersom medianåldern vid diagnosen av MGUS är hög, kommer flertalet patienter aldrig att utveckla någon malign transformation. Gregersen och medarbetare [10] fann i en kohort danska patienter (n = 1 324) med MGUS en reducerad överlevnad; transformation till myelom eller Waldenströms sjukdom svarade dock för endast 20 procent av den ökade mortaliteten, och flertalet patienter dog av sjukdomar ej relaterade till M-komponenten (Figur 1).
Ett antal faktorer påverkar risken för att det hos en patient med MGUS ska utvecklas en malign sjukdom. Sålunda är risken för myelomutveckling större hos patienter med M-komponent av typ IgA än av typ IgG [9]. Koncentrationen av M-komponenten vid diagnostillfället har ännu större betydelse för transformationsrisken (Tabell II). Ju högre koncentration av M-komponenten, desto större risk. Graden av plasmacellsinfiltration i benmärgen har också viss betydelse: patienter med 6–9 procent plasmaceller har högre risk än de med 0–5 procent. Däremot har – möjligen något förvånande – andra faktorer, såsom fyndet av klonala cytogenetiska avvikelser, inte visat sig ha någon prognostisk betydelse.
Studier på Mayoklinikens stora MGUS-material har nyligen visat att kvoten kappa-/lambda-kedjor (FLC-ratio) har stor prognostisk betydelse [11]. En abnorm FLC-ratio indikerar högre risk för malign proliferation. Rajkumar och medarbetare har därför föreslagit att patienter med MGUS bör stratifieras vad avser risk för transformation med hänsyn till typ av M-komponent, M-komponentens koncentration och FLC-ratio (Tabell III). Patienter i högriskgruppen bör följas med speciell vaksamhet. Studier pågår också av om man medikamentellt kan påverka/fördröja övergången till proliferativt myelom hos dessa patienter.
Uppföljning av patienter med MGUS
Målsättningen med uppföljning av patienter med MGUS är att så tidigt som möjligt upptäcka tecken på malign transformation, i synnerhet innan skelettdestruktioner och njurinsufficiens uppträder och så tidigt att patienten tål aktiv behandling. Som tidigare påpekats är risken oförändrad över tiden och minskar alltså inte trots att patienten kanske gått med sin M-komponent oförändrad i ett decennium eller mer.
Förloppet vid transformationen kan växla: det kan ske en långsam eller snabb ökning av M-komponenten, antingen direkt efter diagnos eller efter en längre tids stabil nivå. Ofta, men inte alltid, signaleras den maligna progressionen samtidigt av andra fynd som skelettsmärtor, lytiska skelettförändringar, anemi, njurpåverkan, ökning av M-komponenten i urinen, splenomegali och lymfkörtelförstoring. Hos en fraktion av patienterna sker detta trots att M-komponentens koncentration i serum är oförändrad. Vid skelettsmärtor bör konventionell röntgen eller datortomografi alltid utföras, inkluderande axialskelett.
Hur tätt man än lägger uppföljningskontrollerna av en patient med MGUS kan tecken på progression uppträda under mellantiden. Det är därför av största vikt att patienten är välinformerad och själv kan ge akt på eventuella tecken till att sjukdomen ändrar karaktär. På sätt och vis kan man säga att patienten själv spelar den viktigaste rollen för uppföljningen. Det är förstås en grannlaga uppgift att ge patienten tydlig och förståelig information om tänkbara framtida förlopp av tillståndet utan att samtidigt oroa och skapa en alltför påträngande självobservans. Vår uppfattning är dock att det lönar sig att redan vid diagnosen ge utförlig information till patienten och gärna vid tillfälle upprepa denna.
Principerna för uppföljning skiljer sig egentligen inte åt, antingen patienten följs inom primärvården eller hos hematolog eller annan specialist (Fakta 3). Risken för transformation är som tidigare sagts liten om den är av typ IgG och <15 g/l respektive av typ IgA och <10 g/l. Det stora flertalet hör till denna kategori.
Det finns inga publicerade riktlinjer på vilka man kan basera rekommendationer om frekvensen av kontroller. Den tidigare nämnda arbetsgruppen har stannat för ett intervall på 3–4 månader första året och därefter glesare. Det är dock viktigt att individualisera kontrollerna med hänsyn till bl a ålder och närvaro av andra sjukdomar. Hos patienter med reducerad förväntad överlevnad på grund av mycket hög ålder eller samtidig allvarlig annan sjukdom kan det ibland vara berättigat att helt avstå från kontroller.
Hos patienter med större M-komponenter och där man haft möjlighet konstatera närvaro av en abnorm FLC-ratio eller där signifikant Bence Jones’ proteinuri föreligger bör man vara särskilt observant och i varje fall inledningsvis följa patienten oftare. Upprepad bestämning av FLC-ratio under uppföljningen har dock inget visat prognostiskt värde.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.