Sammanfattat
Behandling av cancerpatienter med nya riktade terapier medför krav på implementering och kvalitetssäkring av behandlingsstyrande molekylärpatologiska analyser.
30–40 procent av alla patienter med kolorektalcancer har en mutation i genen KRAS.
Mutationen resulterar i ett ständigt aktivt protein, som gör tumören resistent mot anti-EGFR-behandling med t ex cetuximab (Erbitux) och panitumumab (Vectibix).
Därför måste KRAS-mutationsstatus fastställas innan eventuell behandling med dessa läkemedel inleds.
Ett svenskt projekt för kvalitetskontroll beskrivs, där histologisk bedömning av kolorektaltumörvävnad samt metoder för DNA-extraktion och KRAS-mutationsanalys har utvärderats.
Känsligheten i KRAS-analyserna har också utvärderats genom att jämföra erhållen mutationsfrekvens för respektive mutationsanalys i det totala antalet analyserade kolorektalcancerfall i Sverige.
Kostnaden för riktade terapier inom cancervården har ökat kraftigt de senaste åren. Terapierna består av antingen antikroppar riktade mot receptorer på cellytan eller intracellulära tyrosinkinasinhibitorer med syfte att hindra tumörcellens okontrollerade cellsignalering. Riktad terapi i kombination med traditionell cytostatikabehandling har använts med goda resultat på ett flertal tumörtyper under de senaste åren, med paradexempel som imatinib (Glivec) vid kronisk myeloisk leukemi och trastuzumab (Herceptin) vid vissa typer av bröstcancer. Specifikt för de riktade terapierna är att de bör föregås av en genetisk karakterisering av patientens tumör för att förutsäga individens respons. Adekvata, kvalitetssäkrade och behandlingsstyrande test är därför viktiga och kommer att få allt större betydelse då nya riktade terapier är på väg in i klinisk rutinbehandling.
Nätverk för klinisk validering
Många av de behandlingsstyrande testen för främst solida maligniteter utförs av laboratorier inom den nya gren av patologin som kallas molekylärpatologi. Under de senaste åren har antalet genetiska analyser på formalinfixerad paraffininbäddad vävnad ökat med exempel som FISH-analys av HER2 och mutationsundersökningar av cKIT, PDGFRA och nu senast även KRAS. Samspelet mellan traditionell histopatologisk granskning och molekylärpatologisk analys är viktigt och innebär en interaktion mellan patologen, som gör ett urval av vilken vävnad som ska analyseras, och molekylärgenetikern, som utför analysen på DNA extraherat från utvald tumörvävnad. Resultaten tolkas därefter ofta gemensamt av de specialiserade yrkeskategorierna, vilket ställer krav på organisatorisk samlokalisation (varje patologenhet bör ha tillgång till molekylärgenetisk apparatur och kompetens).
I den här artikeln beskrivs arbetet inom ett nybildat nationellt nätverk för klinisk molekylärpatologi med att validera mutationsstatusanalys av KRAS-genen. Analysen utförs inför eventuell riktad terapi med monoklonala antikroppar vid metastaserande kolorektalcancer. Liknande kvalitetsgrupper för HER2-analyser vid bröstcancer (HER2-analysgruppen) har under det senaste decenniet med stor framgång arbetat med kvalitetskontroll av analyser och formulering av nationella riktlinjer för FISH-analyserna [1].
Kolorektalcancer och anti-EGFR-terapi
Kolorektalcancer är efter prostata- och bröstcancer den vanligaste formen av cancer i Sverige. År 2007 registrerades runt 6 000 nya fall, vilket utgör drygt 11 procent av all rapporterad tumörsjukdom [2]. I dag finns det två godkända riktade terapier mot kolorektalcancer på marknaden. De två preparaten, cetuximab (Erbitux) och panitumumab (Vectibix), är båda monoklonala antikroppar och verkar genom att binda till och blockera receptorn epithelial growth factor receptor (EGFR).
EGFR är en tillväxtfaktorreceptor vars aktivitet leder till intracellulär signalering, som resulterar i tumörcellsproliferation, minskad apoptos, ökad metastasbildning och aktivering av tumörrelaterad angiogenes [3]. De båda anti-EGFR-preparaten reducerar risken för tumörprogression och förbättrar den progressionsfria överlevnaden samt livskvaliteten hos patienter med behandlingsrefraktär kolorektalcancer [4-6]. Det är dock bara hos en mindre grupp av patienter, 8–23 procent, som man kan se behandlingsrespons av cetuximab [4, 5] eller panitumumab [6].
KRAS-mutationer i kolorektalcancer
Mutationer i EGFR förekommer sällan i kolorektalcancer, till skillnad från i lungcancer [7], och har därför lågt värde som behandlingsstyrande markör. Nedströms EGFR i den intracellulära signaleringskedjan finns proteinet KRAS. Specifika mutationer i KRAS leder till att proteinet aktiveras oberoende av stimulering av receptorn.
Enligt litteraturen är KRAS muterad i kodon 12 eller 13 i 30–40 procent av alla kolorektalcancrar, och mer än 3 000 fall av KRAS-mutationer har hittills rapporterats till Sangerinstitutets databas [7]. De flesta mutationerna som har beskrivits är lokaliserade i exon 2, kodon 12 (ca 82 procent) och 13 (ca 17 procent), men mutationer har också påvisats i kodon 59, 61 och 146. Flera studier har visat att mutationer i kodon 12 och 13 starkt korrelerar med resistens mot cetuximab eller panitumumab [8, 9]. Därför har den europeiska läkemedelsmyndigheten, European Medicines Agency, EMEA
Vidare rekommenderar EMEA att utvärdering av mutationsstatus för KRAS ska utföras av ett erfaret laboratorium med validerad testmetod [10]. Noterbart är att den kliniska betydelsen av KRAS-mutationer i kodon 61 eller 146 ännu inte är fullständigt klarlagd men att indikationer finns att även dessa mutationer ger resistens mot anti-EGFR-behandling [11].
Metod
Ett första steg för att nationellt kvalitetskontrollera KRAS-analyserna togs hösten 2008 genom ett samarbetsprojekt inom det svenska nätverket för klinisk molekylärpatologi. Projektet samordnades från Sahlgrenska universitetssjukhuset i Göteborg, och de molekylärpatologiska laboratorierna i Umeå, Uppsala, Örebro, Göteborg och Malmö bidrog med kolorektaltumörvävnad för DNA-extraktion och KRAS-analys.
Syftet med studien var att histologiskt granska kolorektaltumörvävnader och jämföra hur olika patologer bedömer relevant tumörområde för den molekylärpatologiska analysen. Dessutom har olika extraktionstekniker av DNA från den formalinfixerade paraffininbäddade tumörvävnaden utvärderats. Slutligen har även en jämförelse gjorts av resultaten från tre oberoende analysmetoder för detektion av KRAS-mutationer. Studien kallades följaktligen HEMRAS (Histologi, Extraktion, Mutation RAS) och kan ses som en mindre pilotstudie avseende kvalitetskontroll.
Nio molekylärpatologiska laboratorier deltog i studien (Umeå, Uppsala, Stockholm, Linköping, Örebro, Göteborg, Helsingborg, Malmö och Lund). I studien analyserades material från tio olika kolorektaltumörer från formalinfixerat paraffininbäddat material (FFPE). Inledningsvis utvärderade en gastrointestinalt inriktad patolog materialet enligt WHO:s klassifikation för differentieringsgrad [12] samt angav hur stor andel viabla tumörceller som fanns i preparatet och markerade lämpligt tumörområde för eventuell makrodissektion (Histologi). Därefter utfördes en DNA-extraktion från FFPE-material, där samtliga laboratorier använde den rutinmetod som finns uppsatt på respektive enhet (Extraktion). Slutligen analyserades proven för mutationer i KRAS-genen med gängse detektionsmetod för respektive laboratorium (Mutation).
Följande DNA-extraktionsmetoder utvärderades: QIAamp DNA FFPE Tissue Kit, QIAamp DNA minikit och Qiagen EZ1 (robot). Metoder för mutationsanalys var Sangersekvensering (ABI), pyrosekvensering (QIAGEN) och TheraScreen K-RAS-mutationsanalys (DxS), en metod baserad på realtids-PCR (för teknisk beskrivning av respektive metod, se Fakta 1).
Resultat
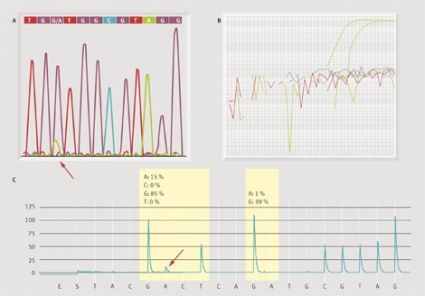
Vad gäller histologisk bedömning och DNA-extraktion bedömdes samtliga tio kolorektalcancervävnader likvärdigt av patologerna. Alla laboratorier extraherade DNA av bra kvalitet (optisk densitet, OD, 1,8–2) oberoende av vald teknik. Ingen påvisbar skillnad kunde hittas mellan QIAamp DNA FFPE och QIAamp DNA mini-metoderna, dock uppvisades ett lägre DNA-utbyte med det automatiserade Qiagen EZ1-systemet (3–10 gånger lägre utbyte). Alla deltagande laboratorier påvisade samma förändringar i KRAS-kodon 12 eller 13 i samtliga tio prov oberoende av använd analysmetod (Sangersekvensering, pyrosekvensering eller TheraScreen). Se Figur 1 för exempel på resultat med de olika teknikerna.
Känsligheten i KRAS-analyserna har utvärderats genom att jämföra uppnådd mutationsfrekvens för respektive teknik med det totala antalet analyserade kolorektalcancerfall (416) i Sverige. Sammanställning av data från de nio deltagande laboratorierna redovisas i Tabell I.
Diskussion
Huvudfrågan för HEMRAS-studien, om den analys av KRAS-mutationsstatus som utförs av de svenska molekylärpatologiska laboratorierna är pålitlig, kan angripas på flera sätt. Ett sätt är att undersöka samstämmigheten mellan svaren i det aktuella utskicket, ett annat att analysera om de ingående laboratoriernas mutationspanorama stämmer överens med varandra och med den mutationsfrekvens som rapporterats i tidigare studier.
Samstämmighet och pålitliga resultat
Vad gäller de tio analyserade proven i denna studie kan konstateras att samma mutationsstatusresultat uppnåddes oavsett laboratoriebedömning av tumörområde eller vald metod för snittning, DNA-preparation och mutationsanalys. Det är givetvis klokt med en viss försiktighet vad gäller slutsatser utifrån ett så begränsat antal prov, men resultaten stämmer väl överens med den slående samstämmighet vad gäller mutationsfrekvens som fanns såväl mellan olika laboratorier som mellan olika analysmetoder. Att mutationsfrekvensen i de 416 undersökta fallen som rapporteras i denna studie stämmer så pass väl med uppgifter från de 3 158 undersökta tumörerna i Sangerinstitutets databas CGP, 37 procent för bägge materialen, stärker ytterligare bilden av en pålitlig analys [7].
Enligt vår bedömning ger samtliga utvärderade metoder för mutationsanalys ett pålitligt resultat. Vid val av analysmetod finns alltså utrymme för att väga in de egenskaper som ändå skiljer metoderna åt: sensitivitet och pris. Den allelspecifika PCR-metoden från DxS anges detektera 1 muterad cell mot en bakgrund av 100 analyserade celler, vilket förstås ökar möjligheten att få ett pålitligt svar även från ett suboptimalt material. Realtids-PCR kräver för de flesta molekylärbiologiska laboratorier heller inga nyinvesteringar i apparatur. Å andra sidan är reagenskostnaden betydligt större än för pyro- och Sangersekvensering.
Pyrosekvensering är också relativt känslig, i storleksordningen 1 muterad cell mot en bakgrund av 10–20 celler kan detekteras [13], och dessutom kvantitativ och snabb. Kostnaderna för reagens är lägre, men metoden är etablerad hos färre laboratorier och kan därmed innebära investeringskostnader vad gäller apparatur. Sangersekvensering slutligen är den mest flexibla och reagensmässigt billigaste metoden och ger dessutom mest information. Metoden är dock mer tidskrävande och ställer, på grund av lägre detektionskänslighet, högre krav på det histologiska grundarbetet, vilket också kan leda till totalt högre arbetskostnader.
Kunskapen räcker tyvärr inte
Räcker då kunskap om KRAS-mutationsstatus för att förutsäga möjligheterna att framgångsrikt behandla med anti-
EGFR-terapi? Svaret är tyvärr nej. Även om en aktiverande mutation i KRAS mycket starkt talar mot behandlingssvar [8, 14] bär bara 30–40 procent av de patienter som inte svarar på anti-EGFR-terapi på en sådan mutation. Det finns i dag en hel del som talar för att bakgrunden till den resistens som ses hos patienter utan aktiverande mutationer i KRAS är andra genetiska förändringar i de gener som kodar för proteiner i signalvägarna nedströms EGFR.
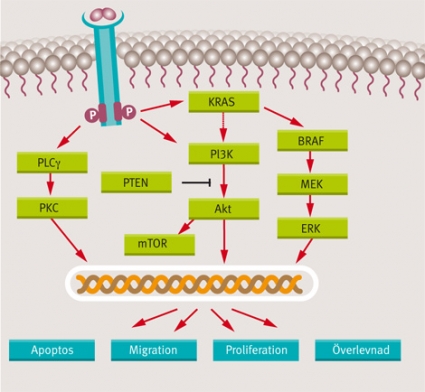
Stöd från retrospektiva studier finns t ex för en betydelse av mutationer i BRAF, precis nedströms KRAS, och i PIK3CA-genen, som kodar för ett protein av central betydelse i den andra huvudsignalvägen aktiverad av tyrosinkinasreceptorer, PI3K/AKT-signalvägen [15, 16] (Figur 2). Därutöver finns resultat från mindre studier som talar för betydelsen av förlust av PTEN, ett protein som normalt ska hämma aktiviteten av just PI3K [17, 18]. Det finns alltså ett flertal retrospektiva studier, men ännu saknas en motsvarighet till de större, prospektiva studier som kraftigt bidragit till KRAS nuvarande position som ledande behandlingsprediktiva faktor vid anti-EGFR-terapi mot kolorektalcancer [8, 9, 14, 19].
Nästa steg i kvalitetsarbetet
Hur ser nästa steg i kvalitetsarbetet ut? Nationella eller regionala kvalitetskontrollutskick finns i dag i ett flertal europeiska länder. För enheter som så önskar finns också ett tyskt program med tio tumörprov per omgång, öppet även för utländska laboratorier (QuIP, Deutsche Gesellschaft für Pathologie e.V.). Den europeiska patologföreningen, European Society for Pathology, har också sammanfattat beskrivningar och rådgivande slutsatser från ett konsensusmöte i samband med föreningens internationella kongress i Barcelona 2008. Dessa slutsatser sammanfattades i en beskrivande och rådgivande artikel hösten 2008 [10]. Som ett tredje steg startas nu en europeisk supportsida, och ett europeiskt kvalitetssäkringsprogram har sjösatts.
Konklusion
I takt med att fler riktade terapier introduceras så kommer kvalitetsarbete liknande detta att framgent vara en naturlig del av svensk rutinsjukvård. Den molekylära patologin är väletablerad inom sjukvården i Europa och på frammarsch inom svensk sjukvård, och vi som är aktiva inom fältet vill slutligen poängtera vikten av samverkan mellan sjukvårdens olika specialiteter och kompetenser, som i detta fall patologi, onkologi och genetik, för att tillsammans kunna erbjuda bästa möjliga individanpassade behandling för den enskilda patienten.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Deltagande laboratorier i kvalitetsutskicket: Karolinska universitetssjukhuset, enheten för patologi/cytologi, Mehran Ghaderi och Johan Lindholm; Universitetssjukhuset i Linköping, Klinisk patologi, Martin Hallbeck; Helsingborgs lasarett, Klinisk patologi, Patrick Joost; Universitetssjukhuset i Lund, forskningsenheten onkologen, Mats Jönsson. Medarbetare vid Sahlgrenska universitetssjukhuset i Göteborg, Klinisk patologi och cytologi, Pushpa Saksena, Carina Karlsson, Lisbeth Gustafsson och Carola Andersson; Akademiska sjukhuset i Uppsala, sektionen för klinisk patologi och cytologi, Johan Botling, Patrick Micke, Monica Lindell och Karolina Edlund; Universitetssjukhuset i Örebro, enheten för patologi, Sune Eriksson, Gabriella Lillsunde-Larsson och Anna-Lena Ohlsson; Norrlands universitetssjukhus i Umeå, Klinisk genetik, Irina Golovleva; Universitetssjukhuset i Malmö, Klinisk patologi, Malin Goldman, Malgorzata Tomaszewska, Christer Halldén och Britta Halvarsson.