Sammanfattat
Antivirala medel mot herpes simplex har uttalad behandlingseffekt på virusförökning i cellkulturer och hos djur med primär herpesinfektion.
Behandling av patienter med recidiverande herpesmunsår med olika typer av antivirala medel har dock resulterat i begränsad förkortning av sårläkningstid som enda behandlingsvinst.
Nya data pekar på att immunförsvaret spelar större roll för patologin vid recidiverande herpesmunsår än man tidigare trott.
Effekten av antivirala medel i djurmodell för recidiverande herpesinfektion var liten, medan effekten av en kombination av antivirala medel och immunmodulerande medel var god.
Tidigbehandling av patienter med recidiverande herpesmunsår med antivirusmedel i kombination med immunmodulerande medel har i fas 3-studier visat att utbrott av munsår kan förebyggas hos vissa patienter.
Recidiverande herpes simplex-virusinfektioner är utomordentligt vanliga tillstånd som orsakas av två herpesvirus som infekterar människan (herpes simplex-virus typ 1 och typ 2 [HSV 1 och HSV 2]). Aciklovir, som var det första virusspecifika antivirala medlet som fick spridd användning, utvecklades mot dessa virus under tidigt 1980-tal. Aciklovir och andra antivirala medel visade uttalad antiviral effekt både vid testning i cellkultur och vid behandling av virusinfekterade djur. Den kliniska effekten i människa var däremot liten och den kliniska nyttan begränsad. Senare forskning har visat att det är interaktionen mellan virus och immunförsvar som begränsar den kliniska nyttan av antivirusmedel vid behandling av recidiverande herpes simplex-infektioner.
Denna översiktsartikel beskriver och diskuterar de kliniska fas 3-studier som publicerats avseende testning av antivirala medel på den vanligaste herpes simplex virus-infektionen, herpes simplex-virusinducerade munsår (herpesmunsår). Vidare diskuteras interaktionen mellan virus och immunförsvar i ett läkemedelsutvecklingsperspektiv.
De slutsatser som har framkommit kan i framtiden visa sig vara giltiga också för ett antal andra kroniska virusinfektioner.
Herpes simplex-virusinfektioner är mycket vanliga
Herpes som begrepp kan spåras tillbaka till antiken, och det anses att Hippokrates använde begreppet först [1]. Herpes simplex-virus typ 1 och typ 2 är två av de herpesvirus som smittar människan. HSV 1 infekterar framför allt oralt, medan HSV 2 företrädesvis infekterar genitalt.
Denna översiktsartikel behandlar framför allt de orala infektioner som orsakas av HSV 1 hos individer med normalt immunförsvar. Som virus betraktat är HSV 1 utomordentligt framgångsrikt, och uppemot 80–90 procent av befolkningen över 50 år har antikroppar mot HSV 1 som bevis på genomgången infektion [2].
Efter en primär infektion i och ibland omkring munhålan etablerar viruset latens i sensoriska nervganglier, framför allt i trigeminusgangliet [2, 3]. Hos en stor del av dessa individer reaktiveras det latenta viruset vid upprepade tillfällen och transporteras via sensoriska neuron till munslemhinna där det orsakar ett munsårsrecidiv. Uppemot en tredjedel av alla reaktiveringar är asymtomatiska, dvs virus kan detekteras på läppen utan att några som helst kliniska symtom finns [4]. Emotionell stress, sjukdom och solexponering anses vara de viktigaste orsakerna till reaktivering [5].
Mellan 30 och 45 procent av den vuxna befolkningen rapporterar att de vid något tillfälle haft ett munsår som av patienten misstänkts vara herpesorsakat [6]. Antalet munsår per år är dock sämre dokumenterat. Den bästa studien gjordes av Axell och Liedholm vid Lunds universitet, i vilken 20 333 individer undersöktes [7]. Matematisk modellering utförd vid Harvarduniversitetet utgående från detta material visade att omkring 8,6 procent av en befolkning har 3 eller fler herpesmunsår per år och att totalt omkring 600 000 episoder av munsår förekommer varje år i en population av 1 miljon individer [6].
Modelleringen har utgått från att frekvensen av herpesmunsår inte förändrats efter det att studien utfördes, men den har använt 2009 års uppskattning av befolkningens storlek. Eftersom andra rapporter visar högre frekvenser, kan dessa siffror vara en konservativ uppskattning. Slutsatsen blir att även om herpesmunsår är ett självläkande tillstånd är de vanligt förekommande, och hos en betydelsefull andel av befolkningen är de frekvent återkommande.
Behandling med antivirusmedel har begränsad effekt
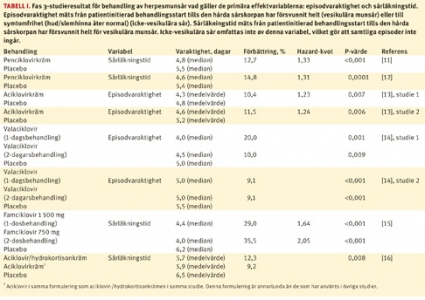
Innan antivirusmedel testades i kliniska studier gjordes ett antal försök på herpes simplex-virusinfekterade cellkulturer och djur. Resultaten från djurstudierna antydde en möjlig klinisk förbättringspotential på minst 50 procent [8-10]. Det var utifrån denna förbättringspotential som de första kliniska studierna designades under slutet av 1970-talet. Resultaten antydde en 10–15-procentig läkningstidsförkortning som enda behandlingseffekt och var naturligtvis en stor besvikelse. Eftersom studierna var designade med avseende på en betydligt större behandlingseffekt, var de för små för vetenskapliga slutsatser. De första rapporterna med tillräckligt stora studiematerial kom först 15 år senare. Se Tabell I och II för sammanfattning av alla fas 3-studier av recidiverande herpesmunsår.
Ett munsår genomgår ett antal olika faser (Fakta 1) [2]. Såret genomgår oftast stadierna i nämnd ordning, men vissa faser kan vara så korta att de inte registreras. Ett herpesrecidiv indelas i två typer: vesikulär episod eller sår och icke-vesikulär episod. Ett vesikulärt sår innehåller minst något av stadierna vesikulär, sår/mjuk sårskorpa och/eller hård sårskorpa. Epidermis är alltid skadat i ett vesikulärt sår. Motsatsen till ett vesikulärt sår är en icke-vesikulär episod, som enbart innehåller någon eller några av de tre första stadierna (prodromal-, rodnads- och/eller svullnadsstadium) och inte de stadier som förknippas med vesikulärt sår. Epidermis är alltid oskadat vid en icke-vesikulär episod.
I samtliga genomförda fas 3-studier har läkningstid mätts från tiden för patientens självbeslutade behandlingsstart till bortfall av hård sårskorpa för vesikulära sår och till symtomfrihet för icke-vesikulära episoder (hud/slemhinna åter normal).
I det första stora fas 3-programmet jämfördes penciklovirkräm med motsvarande placebo [11, 12]. Patienterna instruerades att starta behandling inom en timme efter första symtom, men behandlingsstart vid alla stadier tilläts.
Resultaten visade överraskande att omkring 15 procent av de placebobehandlade herpesrecidiven resulterade i icke-vesikulära episoder. Möjliga föreslagna orsaker var att placebokrämen kunde ha en egen effekt, men den mer sannolika orsaken var att dessa recidiv var predestinerade att bli asymtomatiska episoder.
Eftersom maximala virusnivåer på hud och slemhinnor endast förekommer under de första 24 timmarna efter symtomdebut [17] ansågs det viktigt att behandla så snart som möjligt efter symtomdebut. I senare studier med valaciklovir och famciklovir instruerades patienterna att börja behandlingen vid de tidigaste prodromalsymtomen; patienter som fått kliniska symtom skulle inte börja behandla alls utan vänta till nästa episod [14, 15]. Denna instruktion resulterade i att omkring 35 procent av de placebobehandlade patienterna utvecklade icke-vesikulära episoder. Eftersom dessa studier var med oralt studieläkemedel, var det mindre sannolikt att frånvaron av sår orsakades av en placeboeffekt [6].
Dessa resultat visar tydligt att instruktionen till patienterna påverkar resultatet och att man måste ta hänsyn till detta vid tolkning av fas 3-data.
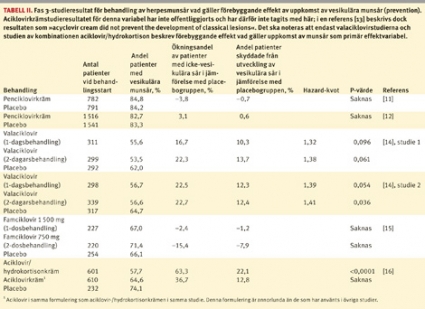
De tre kliniskt viktiga egenskaper som är betydelsefulla vid bedömning av fas 3-studier av herpesmunsår är förekomst av vesikulärt sår, läkningstid och det vesikulära sårets storlek. Bara en av fas 3-studierna har mätt sårstorlek, vilket gör att det saknas jämförande data på denna variabel att diskutera.
Alla behandlingar med aciklovir som aktiv substans och penciklovirkräm resulterade i en förkortad läkningstid på ungefär 10–15 procent, dvs 0,5–0,8 dagars förkortad läkningstid, som enda behandlingseffekt (Tabell I). Resultaten var alltså liknande oberoende av om behandlingen givits oralt som valaciklovir eller lokalt som aciklovir- och penciklovirkräm och oberoende av patientinstruktion om behandlingsstart. En av valaciklovirstudierna rapporterade 20-procentig läkningstidsreduktion, men det ska observeras att medianläkningstidens längd i denna studie bara bedömdes till närmaste halva dygn. Valaciklovir ger ökad biotillgänglighet av aciklovir och därmed högre aciklovirkoncentration i blodet.
I fas 3-studierna startades valaciklovirbehandling enbart under prodromalstadiet. Trots denna tidiga behandling och trots att aciklovirnivåerna i hud sannolikt var betydligt högre än vid aciklovirkrämbehandling [6], var de kliniska behandlingsresultaten jämförbara mellan oralt valaciklovir och aciklovirkrämbehandling (Tabell I och II).
Studierna med penciklovirkräm och famciklovir skiljer sig från de övriga, eftersom den primära effektparametern var läkningstid för vesikulära sår från patientinitierad behandlingsstart till förlust av hård sårskorpa. Detta medför att den primära effektparametern bara inkluderar en delmängd av alla patienter som börjat behandling. Det påverkar dock inte utvärderingen av penciklovirkrämstudien i någon större utsträckning, eftersom andelen patienter med vesikulära sår var jämförbar mellan behandlingsgrupp och placebogrupp (84,8 procent respektive 84,2 procent, Tabell II). Dock blir utvärderingen av famciklovirstudien problematisk, eftersom fler patienter i de två famciklovirbehandlingsgrupperna utvecklade vesikulära sår än i placebogruppen (67,0 procent och 71,4 procent respektive 66,1 procent, Tabell II). Det ska dock noteras att famciklovir 1 500 mg givet som enkeldos gav en läkningstidsförkortning på hela 1,8 dygn (29,0 procent) i denna studie [15].
Data visade sammanfattningsvis att tidig episodisk behandling av recidiverande herpesmunsår med antivirala medel resulterade i en begränsad läkningstidsförkortning som den huvudsakliga terapeutiska effekten. Vidare kunde inte uppkomst av herpesmunsår förhindras med statistiskt säkerställd effekt, även om gynnsamma trender fanns i valaciklovirstudien (Tabell II).
Immunförsvaret bidrar till den kliniska bilden
Antivirusmedels begränsade effekt på recidiverande herpes simplex-virusinfektioner stod klar under början av 1990-talet, men orsaken var oklar. Eftersom antivirusmedel hade visats ha utmärkt effekt på primära herpes simplex-virusinfektioner hos djur, var de kliniska resultaten hos människa överraskande, och intresset fästes på immunförsvarets eventuella roll.
Med en primär infektion menas första gången som en människa blir infekterad med ett herpes simplex-virus. Eftersom immunförsvaret inte tidigare träffat på viruset tar det omkring 2 veckor innan viruset är helt eliminerat från hud och slemhinnor [2, 3, 8]. Efter det att viruset är eliminerat läker herpessåret snabbt [2, 3, 8]. Eftersom herpes simplex-virus utsöndras under lång tid på hud och slemhinnor var det inte överraskande att antivirala medel som aciklovir kunde ge en klinisk behandlingseffekt för primär genital herpes simplex-virusinfektion som närmade sig 50 procents reduktion vad gäller sårläknings- och virusutsöndringstid [18]. Dessa resultat var förväntade, eftersom djurmodeller för primära herpes simplex-virusinfektioner visade liknade resultat [8-10].
Recidiverande herpes simplex-virusinfektioner inträffar däremot i närvaro av ett immunförsvar som har träffat viruset förut och som därigenom är kapabelt att ge ett omfattande och direkt svar mot viruset. Virusutsöndringen begränsas därför mycket snabbare vid en recidiverande infektion än vid en primär infektion, och inom 48–72 timmar från symtomdebut kan virus ofta inte längre detekteras i hud och slemhinnor [2, 17]. Även om virus försvinner snabbt kvarstår symtomen under ytterligare 1 vecka. Ett typiskt vesikulärt herpes simplex-virusrecidiv tar omkring 10 dagar att läka [2, 3, 17].
Det är uppenbart att det i denna situation är svårt för ett antivirusmedel att ytterligare förbättra immunförsvarets effektiva elimination av herpes simplex-virus. Det är vidare uppenbart att det är nödvändigt att behandla mycket tidigt efter symtomdebut. De tidiga kliniska studierna antydde en möjlig reduktion av läkningstiden på endast 10–15 procent [19-22]. Som nämnts tidigare är många herpesrecidiv asymtomatiska. Dessa faktorer sammantagna stödde idén om immunförsvarets kritiska roll för patologin vid recidiverande herpes simplex-virusinfektioner.
Djurmodell utvecklas för att testa kombinationsbehandling
Hypotesen var att virusförökningen i hud och slemhinnor orsakade en immunreaktion som i sin tur, under vissa förutsättningar, bidrog till eller var kritisk för patologin vid recidiverande herpes simplex-virusinfektioner. Det blev då rationellt att utreda förutsättningarna för kombinationsbehandling, varvid herpes simplex-virusförökningen skulle behandlas med antivirala medel och immunreaktionen skulle modifieras med immunmodulerande medel. Svårigheten var dock att det saknades en relevant djurmodell för recidiverande infektioner, eftersom alla tillgängliga djurmodeller utnyttjade primära infektioner.
Genombrottet kom genom användningen av en existerande zosteriform djurmodell i vilken herpes simplex-virus (HSV) inokulerades i halshuden på möss [23]. Efter 4 dagar har viruset transporterats via nerver till motsvarande öra på musen. Efter omfattande experimenterande gick det att visa att det var möjligt att ge dessa möss ett komplett anti-HSV-immunförsvar genom överföring av immunceller från andra möss som tidigare immuniserats med herpes simplex-virus.
Denna överföring av immunceller skedde 2 dagar efter injektion av herpes simplex-virus i halshuden, vid en tidpunkt då virus var under transport i nerver och därmed skyddade från immuncellerna. Resultatet var att virusförökningen i musörat skedde under närvaro av anti-HSV-specifika immunceller, vilket också är fallet vid kliniska recidiverande herpes simplex virus-infektioner. Det visade sig vidare att virusförökningen var kortvarig och immunreaktionen kraftig med utbredd inflammation. Slutligen hade antivirusmedel som aciklovir, foskarnet och penciklovir bara en begränsad effekt på 10–15 procent [24].
En relevant djurmodell fanns därmed för att studera recidiverande herpes simplex-virusinfektioner. Ett större antal antivirusmedel testades i kombination med medel med immunmodulerande effekter. Resultaten visade att alla testade antivirala medel var likvärdiga, medan det skilde stort mellan de olika testade immunmodulerande medlen [24]. Kortikosteroider var tydligt bättre än de övriga testade grupperna, och inom gruppen kortikosterioder var hydrokortison bäst [24].
Resultaten antydde att en klinisk förbättring på runt 50 procent var möjlig att nå med en kombination av antivirusmedel och hydrokortison. Det var dock omöjligt att från djurmodellsresultat förutspå vilka kliniska parametrar som skulle påverkas mest: incidens av herpessår (om herpessår utvecklades över huvud taget), läkningstid eller sårstorlek.
Kliniska resultat med kombinationsbehandling
Efter det att de första prekliniska resultaten från den nyutvecklade djurmodellen blivit kända påbörjades klinisk utvärdering av kombinationshypotesen. Spruance och McKeough studerade 29 pilotpatienter som utvecklade herpes simplex-virusrecidiv efter exponering för ultraviolett ljus (UV) [25]. Patienterna behandlades så snart som möjligt efter symtomdebut med oralt famciklovir 500 mg × 3 och randomiserades därutöver till lokal behandling med 0,05-procentig fluocinonidgel (potent kortikosteroid) eller placebo.
Den kombinerade behandlingen med potent kortikosteroid och famciklovir resulterade i att 41 procent av patienterna inte utvecklade vesikulära herpessår jämfört med 8 procent i placebogruppen.
En kräm för lokal kombinationsbehandling innehållande 5 procent aciklovir och 1 procent hydrokortison utvecklades för behandling av recidiverande herpes simplex-virusinfektioner [26]. Denna kräm studerades i en studie där 380 patienter exponerades för UV-ljus [27]. Huvudresultatet från denna dubbelblindade randomiserade studie visade att 29 procent färre patienter i behandlingsgruppen utvecklade vesikulära herpessår jämfört med placebogruppen. Det sammantagna resultatet antydde att den viktigaste effekten av kombinationsbehandling var prevention av vesikulära herpesmunsår.
Denna slutsats fick nyligen ytterligare stöd från en studie av 42 patienter med recidiv av herpesmunsår [28]. Dessa patienter randomiserades dubbelblindat till antingen högdos oralt valaciklovir (2 000 mg × 2 under 1 dygn) tillsammans med potent lokalt applicerad kortikosteroid (0,05-procentig klobetasolgel (× 2 under 3 dygn) eller matchande placebo. Kombinationsbehandlingen resulterade i att 50 procent inte utvecklade vesikulära herpessår jämfört med 16 procent i placebogruppen.
Kombinationshypotesen testades nyligen i stor fas 3-studie i vilken 2 437 patienter med recidiverande herpesmunsår randomiserades dubbelblindat (Tabell I och II) [16]. Denna studie har granskats av den amerikanska läkemedelsmyndigheten FDA (Food and Drug Administration) [29]. Studien utfördes vid 51 studiecentrum i USA och 4 i Kanada under 2006–2007. Patienterna var 18 år eller äldre och hade en anamnes med minst 3 episoder av herpesmunsår under det föregående året. Patienterna instruerades att påbörja behandling med studieläkemedel 5 gånger per dag under 5 dagar vid första symtom på ett herpesutbrott. De instruerades också att inte starta behandling om förloppet progredierat till ett stadium av svullnad eller etablerat herpesmunsår utan att då vänta på nästa episod.
Av de 2 437 randomiserade patienterna utvecklade 1 443 symtom på en episod och påbörjade därmed behandling. De fördelade sig mellan behandlingsgrupperna: aciklovir/hydrokortisonkräm (n = 601), aciklovirkräm (n = 610) och placebokräm (n = 232). Det bör observeras att färre patienter randomiserades till placebogruppen. Samma nyutvecklade krämbas användes i alla tre behandlingarna.
Resultaten visade att 42 procent i gruppen som fick kombinationsbehandling inte utvecklade vesikulära herpesmunsår jämfört med 35 procent i aciklovirkrämgruppen och 26 procent i placebogruppen (Tabell II). Därmed visade kombinationsbehandling en förebyggande effekt på utvecklingen av herpesmunsår i jämförelse med såväl aciklovirkräm (P = 0,014) som placebokräm (P < 0,0001). De vesikulära munsår som utvecklades trots kombinationsbehandlingen uppvisade förkortad läkningstid jämförbar med de sår som behandlades med aciklovirkräm enbart.
Preventionseffekten av aciklovirkrämen i jämförelse med placebokrämen är överraskande, eftersom de tidigare fas 3-studierna med den godkända aciklovirkrämen (Zovirax-kräm) inte visade någon antydan till preventionseffekt [13]. Orsaken är möjligtvis att en annan krämbas än i Zovirax användes i alla behandlingsgrupperna i kombinationsstudien. Denna nya krämbas utvecklades för att optimera aciklovirleverans till de områden i huden där förökning av herpes simplex-virus sker. Publicerade data pekar på att aciklovir penetrerar hud bättre från denna nyutvecklade krämbas än från andra krämbaser [26].
Samtliga fas 3-studier av behandling av herpesmunsår har bedömt förebyggande effekt av uppkomst av vesikulära munsår (prevention) även om denna variabel inte varit primär effektparameter [6]; Tabell II sammanfattar dessa data.
Det bör noteras att ökningsandelen av läkemedelsbehandlade patienter med icke-vesikulära sår i jämförelse med placebogruppen är en variabel som är direkt beroende av hur stor andel av placebopatienterna som utvecklade icke-vesikulära episoder. Som beskrivits ovan varierar denna andel mellan 15 procent och 35 procent mellan de olika studierna, vilket gör att det är vanskligt att jämföra resultat mellan studierna vad gäller förebyggande effekt. Bättre är att studera den andel av patienterna som utvecklade vesikulära munsår i placebogruppen för att sedan bedöma hur stor andel som undviker vesikulära sår i behandlingsgrupperna; Tabell II visar resultat med båda metoderna.Nytt sätt att behandla recidiverande herpesmunsår
Kombinationskrämen innehållande aciklovir/hydrokortison är en ny behandlingsprincip, som visar att det är möjligt att tidigbehandla herpesmunsår för att få en bättre klinisk effekt och därmed förhindra att vesikulära herpesmunsår utvecklas. Denna behandling har godkänts av FDA och ett flertal europeiska läkemedelsmyndigheter, däribland den svenska, under hösten 2009.
Den generella idén att en vävnadsskada som orsakas av en mikroorganism kan begränsas med en kortikosteroid under skydd av en effektiv behandling av mikroorganismen ifråga är en idé som kan finna sin användning också inom andra infektionsområden.
*
Potentiella bindningar eller jävsförhållanden: Johan Harmenberg äger aktier i Medivir AB och är konsult åt Medivir AB. Spotswood Spruance är konsult åt Medivir AB.