Sammanfattat
Låga D-vitaminnivåer är i epidemiologiska studier associerade med ökad morbiditet och mortalitet, framför allt i fråga om hjärt–kärlsjukdom.
Vitamin D är ett hormon med många olika funktioner utöver de mest kända inom mineralmetabolismen.
FGF23 är ett relativt nyupptäckt hormon som hämmar aktiveringen och stimulerar nedbrytningen av vitamin D i njurarna.
Vid njursvikt minskar vitamin D-aktiveringen sekundärt till ökade FGF23-nivåer. Detta leder till en ond spiral med rubbningar i mineralmetabolismen och utveckling av sekundär hyperparatyreoidism, vilket i sin tur anses vara en av de viktigaste orsakerna till den kraftigt förhöjda risken för hjärt–kärlsjukdom hos patienter med nedsatt njurfunktion.
Vitamin D är av kliniskt intresse inte enbart vid osteoporos, utan flera epidemiologiska studier har den senaste tiden visat att låga nivåer av vitamin D är associerade med ökad förekomst av kardiovaskulär sjukdom [1, 2]. Kronisk njursvikt medför en kraftigt ökad risk för hjärt–kärlsjukdomar. Även lindrig njursvikt är en klart underskattad riskfaktor för både ischemisk hjärtsjukdom och stroke. En tänkbar delförklaring till detta är den vitamin D-brist som uppstår vid njursvikt sekundärt till ökande nivåer av ett antivitamin D-hormon, FGF23. Denna artikel fokuserar framför allt på lindrig till måttlig njursvikt och medföljande låga nivåer av vitamin D.
Vitamin D, ett klassiskt steroidhormon
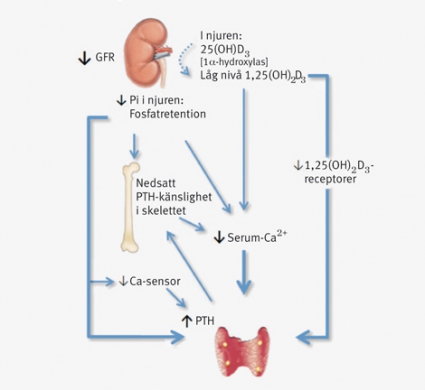
Kalcitriol, 1,25(OH)2D3 (1,25-dihydroxikolekalciferol), är den aktiva metaboliten av vitamin D, ett klassiskt steriodhormon som bildas i njuren och sedan cirkulerar i kroppen där det utövar sin effekt via den nukleära vitamin D-receptorn (VDR) [2]. Vitamin D är intimt förknippat med kalciumhomeostasen (Figur 1), men VDR finns uttryckt i ett stort antal olika celltyper, bland annat endotel, glatt muskulatur och myokardiet [2]. Man har visat på flera pleiotropa effekter av vitamin D, inklusive reglering av renin, insulinproduktion, cytokinfrisättning från lymfocyter, kalciumflöde i hjärtmuskelceller samt proliferation av glattmuskelceller och kardiomyocyter [1, 3, 4]. 25-hydroxylerat vitamin D, 25(OH)D3, är den metabolit som bör användas för mätning av vitamin D-nivåer (Figur 1). Man har ännu inte nått konsensus om vilken nivå av 25(OH)D3 som är optimal. I Sverige har gränsen för brist ansetts ligga vid 25 nmol/l (10 ng/ml), och suboptimala nivåer anges till 25–75 nmol/l (10–30 ng/ml) [5]. Låg solexponering är sannolikt den enskilt viktigaste faktorn för vitamin D-brist hos friska individer (Tabell I). Överviktiga, äldre och människor med mörk hud bildar också mindre av aktivt vitamin D vid samma solexponering än andra grupper [3, 6].
Fibroblast growth factor-23
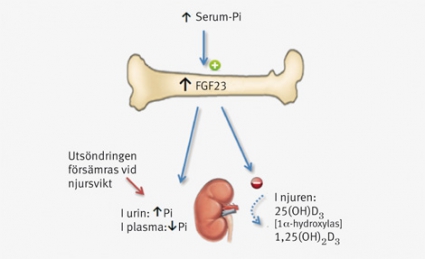
Fibroblast growth factor-23 (FGF23) är ett relativt nyupptäckt cirkulerande hormon som bildas i skelettet, framför allt av osteocyter och osteoblaster. FGF23 reglerar både syntes och nedbrytning av vitamin D samt återresorption av filtrerat fosfat i njurarna [7]. FGF23 bidrar därmed till att minska nivåerna av både 1,25(OH)2D3 och fosfat i serum. Vid normal fysiologi föreligger ett omvänt förhållande mellan FGF23 och 1,25(OH)2D3, och FGF23 kan betraktas som ett antivitamin D-hormon. Ytterligare ett protein, Klotho, krävs för att FGF23 ska kunna aktivera FGF23-receptorn och påverka vitamin D-metabolismen [8].
FGF23-nivåerna i serum är kompensatoriskt kraftigt förhöjda vid kronisk njursvikt på grund av en minskad förmåga att utsöndra fosfat via njurarna [9]. Flera studier har visat att förhöjda nivåer av FGF23 vid njursvikt är associerade med ökad mortalitet hos hemodialyspatienter [10] och en ökad progresstakt vid måttligt nedsatt njurfunktion [11]. Av intresse i detta sammanhang är att FGF23-nivåerna hos friska individer, även inom det normala referensområdet, är associerade med ett flertal kardiovaskulära förändringar som endoteldysfunktion, vänsterkammarhypertrofi och ateroskleros [12-14]. Det är i nuläget inte studerat om FGF23 har direkt skadliga effekter på hjärta och kärl eller om dess koppling till kardiovaskulära riskfaktorer medieras via en sänkning av vitamin D-nivårerna.
Vitamin D-brist associerat med kardiovaskulär sjukdom
Risken för kardiovaskulär sjukdom och hypertoni ökar med avståndet från ekvatorn, vilket samtidigt korrelerar med brist på vitamin D [1, 2]. En stor amerikansk studie av över 15 000 individer (NHANES III) påvisade ett omvänt samband mellan nivåer av 25(OH)D3 och förekomsten av diabetes, hypertoni, hypertriglyceridemi och övervikt [4]. Framingham Offspring-studien har kommit fram till liknande resultat, där risken för en allvarlig kardiovaskulär händelse i form av stroke, hjärtinfarkt eller insjuknande i hjärtsvikt var signifikant högre hos dem med vitamin D-brist [1]. Hos de patienter som hade värden under 38 nmol/l och som dessutom hade hypertoni var risken fördubblad [1].
Vitamin D-brist vid kronisk njursvikt
Nedsatt organfunktion vid njursvikt leder till kronisk brist på aktiverat vitamin D och därmed till sjunkande kalciumnivåer. Detta ger en kompensatorisk ökning av nivåerna av paratyreoideahormon (PTH), så kallad sekundär hyperparatyreoidism, som upprätthåller nivåerna av kalcium genom ökad mobilisering av kalcium från skelettet och ökad reabsorption i njurarna (Figur 2). Förhöjda PTH-nivåer bidrar till hypertoni och vänsterkammarhypertrofi samt till kalcifiering av kärl, myokardiet och hjärtklaffar och korrelerar med ökad risk för kardiovaskulära händelser [2].
Risken för kardiovaskulär sjukdom är kraftigt ökad bland patienter med njursvikt, och sådan sjukdom och är den vanligaste dödsorsaken hos patienter med terminal njursvikt [15]. Njursjukdom i stadium 3 eller högre har visats vara en lika stark riskfaktor för hjärt–kärlsjukdom som diabetes. Denna intima koppling mellan hjärt–kärlsjukdom och njursjukdom kallas vanligen för det kardiorenala syndromet [16].
Det nationella registret över patienter med ischemisk hjärtsjukdom (Swedeheart, tidigare Riks-HIA) är unikt i sitt slag i världen med sin höga täckningsgrad och stora antal inkluderade patienter (enbart år 2008 registrerades 59 796 vårdtillfällen). Tyvärr registreras inga njurfunktionsparametrar utöver kreatinin. Man kan dock se att cirka 26 procent av alla hjärtinfarktpatienter har förhöjda nivåer av serumkreatinin (>100 μmol/l för kvinnor och >115 μmol/l för män). Hos dessa patienter ökar ettårsdödligheten till närmare 40 procent, jämfört med 5 procent hos njurfriska icke-diabetiker. Samtidigt har patienter med njursvikt en högre prevalens av traditionella riskfaktorer för kardiovaskulär sjukdom som diabetes, hög ålder, hypertoni och dyslipidemi [17, 18]. Man har dock kunnat visa att dessa traditionella riskfaktorer inte förklarar den ökade risken för kardiovaskulär sjukdom vid njursvikt [17, 18]. Kopplingen mellan sjunkande njurfunktion och ökad risk för kardiovaskulär sjukdom kan åtminstone delvis förklaras av vitamin D-brist och störningar i mineralmetabolismen.
Evidens för vitamin D-behandling vid njursvikt
Indikationen för substitution med vitamin D och dess analoger vid njursvikt är i dagsläget profylax och behandling av sekundär hyperparatyreoidism hos patienter med kronisk njurfunktionsnedsättning stadium 3–5 samt dialyspatienter (Tabell II). I dessa grupper har man sett ett samband mellan vitamin D-substitution och minskad total dödlighet samt dödlighet i kardiovaskulär sjukdom även om randomiserade kontrollerade prövningar saknas [18].
Det finns i dag också skäl att tro att även en lindrigare njurfunktionsnedsättning kan leda till en kliniskt betydelsefull D-vitaminbrist.
Vitamin D-analogen parikalcitol har cirka 4 gånger lägre affinitet för vitamin D-receptorn än naturligt kalcitriol, och sänker PTH med sannolikt mindre risk för hyperkalcemi och hyperfosfatemi [19]. Detta kan möjligen vara kliniskt värdefullt, då både hyperkalcemi och hyperfosfatemi har ett samband med morbiditet och mortalitet hos patienter med njursjukdom [19]. I en historisk kohortutvärdering av dialyspatienter (n = 67 339) såg man att substitution med parikalcitol var associerad med färre episoder av hyperkalcemi, förhöjd kalcium–fosfatkvot och bättre överlevnad än kalcitriol [20]. Förvånande nog var överlevnaden i gruppen substituerade med parikalcitol oberoende av kalciumvärden och kalcium–fosfatkvot. Dessa fynd talar för att fördelarna i överlevnad vid vitamin D-substitution kan vara oberoende av dess påverkan på mineralmetabolismen, det vill säga vara beroende av andra vitamin D-effekter. Det bör dock påpekas att dessa studier var retrospektiva och/eller icke-randomiserade och att det saknas randomiserade jämförande studier med kalcitriol. En mindre, randomiserad interventionsstudie (n = 61) på dialyspatienter har också visat att parikalcitol minskar proteinutsöndringen [21]. Intressant är att behandling med våra i Sverige vanliga kombinationspreparat med både vitamin D och kalcium av patienter med nedsatt njurfunktion inte har något stöd i litteraturen, snarare är risken för hyperkalcemi i dessa fall något som överväger eventuell nytta.
De doser av vitamin D som rekommenderas av Livsmedelsverket till befolkningen i stort är 300–400 IU (7,5–10 µg) dagligen, med de högre värdena till äldre med sämre upptag. Uppskattningsvis krävs 1 000–2 000 IU dagligen för att täcka kroppens behov för de flesta människor [2], men att komma upp i nivåer på 1 000–2 000 IU per dygn utan supplement är svårt i ett solfattigt Sverige och omöjligt vintertid [22].
Rekommendationer för vitamin D-behandling vid njursvikt
I dag inleds vanligen behandling då PTH stiger över referensområdet, vilket hos en del patienter börjar ske redan vid en glomerulär filtrationshastighet (GFR) <60 ml/min. Sannolikt börjar vitamin D-nivåerna sjunka tidigare, och för patienter med hög risk för brist kan man mäta vitamin D-nivåerna i plasma direkt. Efter att behandling påbörjats bör plasmanivån av kalcium kontrolleras inom någon månad. Därefter bör man följa kalcium, PTH, fosfat och kreatinin åtminstone halvårsvis. Initialt bör man använda låga doser, exempelvis 0,25 µg varannan dag [23]. Fortsatt dosering sker vanligen med ledning av P-PTH och med beaktande av njurfunktionen. Även om det finns variationer i nationella och internationella behandlingsrekommendationer kan man grovt säga att vid måttlig njursvikt (GFR 30–59 ml/min) eftersträvas en nivå av P-PTH på 35–70 ng/l, vid GFR 15–29 ml/min eftersträvas P-PTH på 70–110 ng/l och vid terminal njursvikt är det önskvärt med ett P-PTH på 150–300 ng/l [23]. Vid hyperkalcemi bör vitamin D sättas ut temporärt och senare återinsättas i lägre dos. Aktivt vitamin D kan tillföras patienter med njursvikt i form av kalcitriol peroralt (Rocaltrol) eller som vitamin D-analogen alfakalcidol (Etalpha). Det senare läkemedlet kan ges peroralt eller intravenöst. Alfakalcidol genomgår aktivering i levern till kalcitriol och är för närvarande något billigare än Rocaltrol. Parikalcitol (Zemplar) är dyrare men kan vara ett alternativ vid problem med hyperkalcemi.Protektiv effekt av vitamin D vid kardiovaskulär risk
Inflammation är en av de viktigaste mekanismerna som leder till ateroskleros. Vitamin D hämmar inflammation genom att nedreglera genuttryck för utmognad av antigenpresenterande celler och ger ett förändrat utflöde av inflammationshämmande cytokiner [18]. Vitamin D-nivåer har visats korrelera inverst med nivåerna av CRP och matrixmetalloproteinas (MMP), som båda är associerade med kardiovaskulär sjukdom och ateroskleros [18]. Vitamin D hämmar också proliferation av glattmuskelceller och angiogenes [18]. Behandling med höga doser vitamin D har visats sänka CRP med cirka 40 procent [24]. I en liten studie på 7 hemodialyspatienter såg man nyligen att peroral vitamin D-behandling reducerade nivån av inflammatoriska cytokiner (IL-8, IL-6 och TNF) och påverkade inflammatoriska celler direkt [25].
Hjärtmuskelceller uttrycker vitamin D-receptorer och kalcitriol binder direkt till de kalciumkanaler som medierar kontraktilitet [26]. Hos hjärtsviktspatienter (New York Heart Association-klass ≥II) föreligger det ett omvänt samband mellan nivåerna av 25(OH)D3 och NT-proANP [26]. Några små och korta studier av dialyspatienter har här visat att behandling med vitamin D-preparat minskar vänsterkammarhypertrofi [18]. Det är således möjligt att vitamin D-brist kan spela en direkt roll i utvecklingen av vänsterkammarhypertrofi och även bidra till en försämring i hjärtsvikt.
Man har i några [2], men inte alla [22], populationsstudier sett att låg nivå av vitamin D är associerad med ökad förekomst av hypertoni. Sambandet är sannolikt starkast för patienter med etablerad hög kardiovaskulär risk, som diabetes och kronisk njursvikt [2]. Sambandet är oberoende av kalciumnivå, som i sig är associerad med lägre blodtryck [18]. PTH har också ett omvänt samband med blodtryck hos patienter med kronisk njursvikt [18]. Renin är en av de viktigaste faktorerna för kroppens reglering av blodtryck, och överaktivering bidrar till hypertoni och vänsterkammarhypertrofi. I djurexperiment har man visat att aktivt vitamin D hämmar syntesen av renin (på transkriptionsnivå) men också ger en direkt hämning av myocytproliferationen [18]. En stor randomiserad studie över kombinationsbehandling med vitamin D och kalcium av postmenopausala kvinnor med och utan hypertoni (n = 19 160 respektive n = 17 122) visade dock ingen blodtryckssänkande effekt och ingen effekt på utvecklingen av hypertoni [27]. Studien rapporterar dock inte njurfunktion. Det är således tänkbart att enbart de med nedsatt njurfunktion och påverkan på PTH-nivå vinner på behandling. Det är även tänkbart att enbart de med låga nivåer av plasmarenin påverkas positivt, vilket kan tyckas paradoxalt. Just detta har man dock sett i en svensk betydligt mindre (n = 39) och kortare (4 månader) studie [28].Framtida mål
Flera studier tyder på att brist på vitamin D kan vara en viktig oberoende riskfaktor för kardiovaskulär sjukdom. Man har även visat att vitamin D-behandling är associerad med minskad dödlighet vid måttlig till svår njursvikt med sekundär hyperparatyreoidism, men större randomiserade studier saknas. Samtidigt har stora grupper av populationen, enligt de definitioner som nu används, lindrig njurdysfunktion och samtidigt vitamin D-brist [3]. Vi behöver därför studier på vitamin D-behandling även vid lindrigare njursjukdom, där en minskning av risken för kardiovaskulär sjukdom kan få stor betydelse både hälsoekonomiskt och ur ett folkhälsoperspektiv.
*
Potentiella bindningar eller jävsförhållanden: Jonas Spaak har fått forskningsanslag av Abbott Scandinavia för delfinansiering av en prövarinitierad studie av parikalcitolbehandling vid måttlig njursvikt.
*
Författarna till artikeln är aktiva inom ett nybildat kliniskt forskningsnätverk, Karolinska kardiorenala temacentrum, där ett av huvudmålen är att förbättra omhändertagandet och behandlingen av patienter med akut ischemisk hjärtsjukdom och samtidigt nedsatt njurfunktion.