Sammanfattat
Svår sepsis och septisk chock är livshotande tillstånd som kräver omedelbart omhändertagande.
Dessa tillstånd måste prioriteras på liknande sätt som akut hjärtinfarkt eller multitrauma och snabbt identifieras både på akutmottagning och inom slutenvården.
Under det första vårddygnet kan tillståndet försämras hastigt, och även efter den initiala behandlingen ska patientens vitalparametrar följas, bedömas och stämmas av mot uppsatta behandlingsmål.
Fall av svår sepsis och septisk chock förekommer inom så gott som alla medicinska och kirurgiska specialiteter.
Det krävs ökad kunskap inom hela sjukvården om vikten av skyndsamhet vid misstänkt svår sepsis och ökad medvetenhet om hur skiftande den kliniska bilden kan te sig.
Svår sepsis och septisk chock är akuta tillstånd som kräver snabb handläggning (Fakta 1). Svår sepsis innebär en infektionsutlöst systemreaktion som leder till hypotoni, hypoperfusion (laktacidos) och/eller ett eller flera sviktande organsystem (respiratorisk, renal, hematologisk, cerebral eller hepatisk svikt). Septisk chock, som är den allvarligaste formen av svår sepsis, definieras som kvarstående hypotoni trots adekvat vätsketillförsel i kombination med tecken på hypoperfusion eller organdysfunktion.
För mer detaljerade kriterier för svår sepsis och septisk chock, se artikeln av Lars R Ljungström et al i detta nummer av Läkartidningen.
Vikten av snabbt omhändertagande
I en rad stora kohortstudier har visats att fördröjd eller inadekvat initial antibiotikabehandling leder till kraftigt ökad dödlighet vid sepsis.
En betydelsefull studie som illustrerar vikten av snabb och adekvat antibiotikabehandling vid septisk chock publicerades 2006 av Kumar et al [1]. De hade studerat 2 154 patienter med septisk chock och konstaterat att de första timmarna är avgörande för utgången. Om adekvat antibiotikabehandling gavs inom 1 timme från det att den septiska chocken konstaterats var överlevnaden 80 procent. Vid fördröjd antibiotikabehandling ökade mortaliteten med nära 8 procent för varje timme under de första 6 timmarna. Tid till insatt adekvat antibiotikabehandling var den viktigaste prediktorn för mortalitet.
Att förstå att en patient har en livshotande infektion kan vara svårt. Den kliniska bilden kan vara mycket varierande, och vikten av skyndsam handläggning är inte alltid uppenbar, och även i de fall där diagnosen misstänks tidigt blir behandlingen ibland inte optimal.
Vårdprogram för att förbättra initialt omhändertagande
Patienter med svår sepsis kan bli liggande i flera timmar utan adekvat behandling på grund av felprioriteringar på akutmottagningen, i väntan på onödiga prov och undersökningar, i väntan på bedömningar av kollegor inom andra specialiteter eller av andra organisatoriska skäl. I andra fall kan antibiotika ha ordinerats tidigt men på grund av hög arbetsbelastning eller logistiska skäl inte givits förrän långt senare. När man studerar följsamheten till evidensbaserade riktlinjer för omhändertagandet av patienter med livshotande infektioner blir man ofta förvånad över hur lång tid som i själva verket kan förflyta från ankomsten till akutmottagningen och till dess adekvat behandling är given [2-5].
I ett försök att förbättra det initiala omhändertagandet av patienter med allvarliga sepsistillstånd har en programgrupp på uppdrag av Infektionsläkarföreningen arbetat fram ett vårdprogram avsett som en vägledning för att snabbare uppmärksamma tillståndet, ställa diagnos och sätta in adekvat behandling. Vårdprogrammet berör i första hand vuxna patienter på akutmottagningar och vårdavdelningar – inte behandling av svår sepsis inom intensivvården.
Denna artikel är ett kort sammandrag av dokumentet, som finns tillgängligt i sin helhet på Infektionsläkarföreningens webbplats
Att misstänka svår sepsis
I typiska fall är diagnosen inte så svår att misstänka: anamnes med hög feber, frossa, kliniska tecken på t ex pneumoni eller pyelit och med påverkade vitalfunktioner. Det är lättare att det blir fel när man har en osäker anamnes och undersöker t ex en äldre, feberfri patient med takypné och påverkat medvetande.
Systematisk kontroll av vitalparametrar har blivit allt vanligare inom slutenvården under senare år. Många svenska akutmottagningar har infört s k triage, där man använder sig av vitalparametrar med angivna gränsvärden för att sortera patienterna till rätt prioritetsgrupp. Parallellt med detta införs på många sjukhus MIG (mobil intensivvårdsgrupp); uppgiften för MIG är att tidigt bedöma och medverka i behandlingen på vårdavdelningen av patienter med svikt i vitala funktioner.
De kriterier som används för triage och för att kontakta MIG varierar något, men gemensamt är fysiologiska förändringar inom andning, blodtryck, puls och medvetandegrad. Ett antal system för bedömning av vitalparametrar är i bruk; här kan särskilt nämnas BAS 90-30-90; en svensk modell för att identifiera svårt sepsissjuka patienter på akutmottagningar och vårdavdelningar. Modellen har lanserats av infektionskliniken i Skövde och fokuserar på förekomsten av antingen systoliskt blodtryck <90 mm Hg, andningsfrekvens >30/min eller syrgassaturation <90 procent.
Triagesystemen är inte specifikt designade för att identifiera patienter med sepsis, och specificiteten för svår infektion är låg. Systemen tjänar dock syftet att identifiera patienter med sviktande vitalfunktioner, varibland patienter med svår sepsis eller septisk chock kan finnas. Misstanke om sepsis bör finnas med från början som en differentialdiagnos vid bedömningen av en svårt sjuk patient. I Fakta 2 finns exempel på vanliga fallgropar som kan leda till att patienter med sepsis inte blir optimalt omhändertagna.
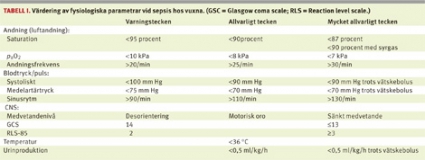
Tabell I redovisar programgruppens värdering av vilka vitalparametrar som utgör varningstecken för svår sepsis och septisk chock. Den är avsedd att vara ett stöd för vårdpersonal som bedömer patienter med misstänkt sepsis. Gruppens rekommendation är att dessa parametrar mäts och dokumenteras på alla patienter med misstänkt infektion, eller helt enkelt alla akutpatienter, dels vid ankomsten till sjukhus, dels vid upprepade tillfällen under det första vårddygnet. Det är angeläget att betona andningens centrala betydelse vid misstänkt sepsis, och påverkan på andningen är ett tidigt och vanligt tecken på svår sepsis. Andningspåverkan definierad som andningsfrekvens >20/min eller saturation <90 procent är prognostiskt ogynnsam för patienter med misstänkt sepsis [6].Identifiering av patienter med svår sepsis
Anamnesen är mycket viktig. Speciellt uppgift om bl a feber, frossa, diarré, smärta, fokala symtom m m liksom duration och frekvens ger viktiga ledtrådar. Om patienten inte kan redogöra för sig, kan det löna sig att söka kontakt med andra uppgiftslämnare i patientens närhet. Ett väl genomfört status med iakttagande av vitalparametrar kan ge en uppfattning om i vilket stadium av sjukdomen patienten befinner sig och vilken infektion som varit utlösande. Rekommenderad rutinprovtagning vid misstänkt svår sepsis framgår av Fakta 3. De erhållna svaren är pusselbitar, varningstecken och hjälp i bedömningen av patienten, men det finns inget enskilt blodprov som är diagnostiskt.
Vi vill speciellt betona vikten av arteriell blodgasanalys vid misstanke om svår sepsis eller septisk chock. Vid allvarliga septiska tillstånd ses som regel uttalad metabol acidos (basöverskott ≤–5 mmol/l), vilken i typfallet delvis kompenseras av ökad koldioxidutvädring och sänkt paCO2. Bestämning av laktat i artärblod utgör ett värdefullt komplement till blodgasanalysen. Ett förhöjt värde kan indikera otillräcklig vävnadsgenomblödning (hypoperfusion) och är ett allvarligt tecken. Laktatförändringen under de första 6 timmarnas sepsisbehandling har visat sig vara en stark prognostisk markör [7].
Innan antibiotika ges ska prov för minst en blododling (aerob + anaerob) tas och om möjligt prov för urinodling. Att säkra en urinodling får inte fördröja insättandet av antibiotika – vid svår sepsis eller septisk chock ges antibiotika direkt även om patienten inte kunnat lämna urinprov eller om man inte finner urin i blåsan vid katetrisering. Klinisk bedömning kan ge misstanke om fokus för infektionen, vilket styr övrig mikrobiologisk provtagning. Det är en fördel om även dessa prov tas innan antibiotika ges, men det är inte nödvändigt.
Behandling
Antibiotika. Antibiotika ska vid svår sepsis ges utan onödig fördröjning. För patienter som kommer in via akutmottagningen ska antibiotika ordineras och ges på akutmottagningen. För patienter där röntgenundersökningar anses behövas akut ska antibiotika ges innan. Antibiotikavalet bör grundas på de misstankar om diagnos och sannolikt infektionsfokus som framkommit vid anamnes och klinisk undersökning av patienten, och man har då att ta hänsyn till infektionens svårighetsgrad, underliggande sjukdomar, nyligen genomgången antibiotikabehandling, vårdtid på sjukhus och risk för multiresistenta bakterier.
I vårdprogrammet
Samtidigt som snabb identifiering och tidigt insatt antibiotikabehandling kan vara livsavgörande måste vi i möjligaste mån undvika onödig antibiotikabehandling, eftersom all antibiotikabehandling driver uppkomst, selektion och spridning av resistenta och svårbehandlade patogener. För patienter som inte uppvisar sviktande organfunktioner utan bara oklar feber eller CRP-stegring är det inte lika bråttom – där kan det i många fall vara klokt att avvakta resultaten från prov och undersökningar innan antibiotika sätts in.
Om man har satt in bred empirisk antibiotikabehandling på misstanke om svår sepsis, är det viktigt att man så snart man nått klinisk eller mikrobiologisk diagnos modifierar eller smalar av behandlingen; om infektion däremot har blivit en osannolik diagnos är det viktigt att antibiotikabehandlingen sätts ut. Adekvat mikrobiologisk diagnostik är därför en förutsättning. Att ordinera antibiotika vid misstänkt sepsis utan att först åtminstone ta prov för blododling är tyvärr alltför vanligt. Om patienten får adekvat empirisk antibiotikabehandling med korrekt dosering, sparas antibiotika och man slipper dubbla eller förlängda behandlingar i onödan.
Träffsäkerheten i det initiala antibiotikavalet är en fråga om kunskap. Det kan vara klokt att rådfråga infektionsspecialist vid osäkerhet [8, 9].
Behandlingstider ska hållas korta – vid t ex fekal peritonit där det underliggande kirurgiska problemet åtgärdats akut är längre antibiotikabehandling än 7 dagar inte motiverad. Om patientens tillstånd inte är tillfredsställande vid den planerade utsättningen av antibiotika, bör det föranleda en diagnostisk ansträngning snarare än en okritisk förlängning av antibiotikabehandlingen.
Vätska. Svår sepsis och septisk chock är associerade med både relativ och absolut hypovolemi. Adekvat tidig vätskebehandling är av största vikt vid handläggningen av patienter med sepsisorsakad hypotoni (systoliskt blodtryck <90 mm Hg eller medelartärtryck <65 mm Hg) eller hypoperfusion (P-laktat >3 mmol/l alternativt >1 mmol över övre normalgränsen eller basöverskott <–5 mmol/l) [10]. En initial vätskebolus ska ges utan dröjsmål, i tillräcklig mängd och tillräckligt snabbt: (500–)1 000 ml/30 min kristalloid vätska till vuxen [11]. Väljer man i stället kolloid lösning blir motsvarande infusionsmängder 300–500 ml/30 min. Vätskedeficit kan ofta uppgå till flera liter men är som regel svår att bedöma utifrån statusfynd vid den initiala kliniska undersökningen och akuta laboratorievärden. I stället är det patientens respons på vätsketillförsel som blir vägledande för hur mycket och hur snabbt vätskan ska tillföras. Vanligen ges för lite vätska och för sakta. Upprepad vätskebolus ska ges till dess cirkulationsmålen är uppfyllda. Utan tillgång till invasiv monitorering innefattar cirkulationsmålen adekvat blodtryck (systoliskt tryck >90 eller medelartärtryck ≥65 mm Hg), normaliserad diures (>0,5 ml/kg/h), god perifer cirkulation med normal hudfärg, hudtemperatur och kapillär återfyllnad samt framför allt sjunkande laktatnivå vid initialt förhöjda koncentrationer.
Syrgas. Syrgasbehandling är ofta indicerad vid svår sepsis. Vid måttlig hypoxi, SpO2 (syrgasmättnad mätt med pulsoximeter) 91–95 procent, inleds behandlingen med 2–3 l O2 via näsgrimma, medan uttalad hypoxi, SpO2 <90 procent, behandlas med 5–15 l O2 via ansiktsmask.
Målet för syrgasbehandlingen ska vara normaliserad saturation eller minst SpO2 >93 procent. Lägre värden får ofta accepteras hos patienter med underliggande lungsjukdom på grund av risken för koldioxidretention.
Övrigt. Ett viktigt behandlingsmål vid svår sepsis är att så snabbt som möjligt korrigera patientens laktacidos. Kliniska studier har inte visat några positiva effekter av bufferttillförsel vid laktacidos [12, 13]. Eftersom orsaken till den metabola acidosen är den septiska hypoperfusionen, normaliseras acidosen som regel när cirkulation och respiration stabiliserats. Det saknas evidens för att öka diuresen med diuretika hos patienter med septisk njurpåverkan.
Det finns ingen indikation för steroider till patienter på akutmottagning eller vårdavdelning med undantag av patienter med känd binjurebarksinsufficiens och steroidbehandlade patienter, vilka kan behöva en ökning av steroiddosen i samband med allvarliga infektioner. Enligt gällande konsensus ges hydrokortison till patienter med septisk chock med terapisvikt på vätskesubstitution och vasopressorbehandling; denna behandling är således aktuell endast på intensivvårdsavdelning.
Övervakning och uppföljning av den initiala behandlingen
Samhällsförvärvad septisk chock utvecklas som regel inom 24 timmar efter ankomst till sjukhuset, oftast redan inom 6 timmar [14]. Under den kritiska tidsperioden bör blodtryck, andningsfrekvens, saturation, hjärtfrekvens, medvetandegrad och urinproduktion följas minst en gång per timme under de första 3–6 timmarna. Syftet med övervakning av patienter med svår sepsis är att kontrollera om uppsatta behandlingsmål nås (Fakta 4), hitta de patienter som försämras och tidigt identifiera de patienter som kan bli i behov av intensivvård. Det är viktigt att observera trender i mätvärden snarare än ett enskilt mätvärde.
De patienter som är i riskzon för intensivvård bör initialt övervakas minst 1 gång/halvtimme och helst kontinuerligt. Patienter som inte har uppfyllt behandlingsmålen innan de lämnar akutmottagningen bör övervägas för intensivvård. Om flyttning till intensivvårdsavdelning inte sker, ska de vårdas på avdelning med kunskap om och erfarenhet av svårt sjuka infektionspatienter.
Senast 6 timmar efter identifiering och stabilisering bör patienten utvärderas [10] för att man ska kunna bedöma om behandlingsmålen är uppfyllda (Fakta 4). Blodgas med laktat kontrolleras om första provtagningen visade patologiska värden liksom vid behov övriga prov, t ex koagulationsprov. Fortsatt antibiotikadosering justeras för eventuell njurpåverkan. Man bör vidare ta ställning till om dränering av infektionsfokus är indicerad.
Intensivvård vid svår sepsis
Intensivvårdens uppgift är att behandla patienter med allvarlig akut svikt av vitala funktioner. Framför allt har man på intensivvårdsavdelning unika möjligheter att övervaka och behandla cirkulatorisk och respiratorisk svikt. Gränsdragningen för vilka sepsispatienter som bör erbjudas intensivvård är ofta svår, och bedömningen försvåras ytterligare av att högriskpatienter måste identifieras på ett tidigt stadium för att insatserna ska få optimal effekt. I Fakta 5 ges förslag på fynd som bör föranleda kontakt med intensivvårdsläkare.
I många fall av allvarliga infektioner är den kliniska bilden inte helt entydig, och ställningstagandet till intensivvård måste då grunda sig på en komplex värdering, som utöver direkta sepsissymtom också innefattar bedömning av infektionsfokus och hänsynstagande till underliggande sjukdomar och patientens immunologiska status. Bedömningen måste också ta hänsyn till kvaliteten på den vård som kan erbjudas patienten utanför intensivvårdsavdelning. Grundregeln är att man på akutintag och vårdavdelningar bör vara liberal med att tidigt kontakta intensivvårdsläkare för diskussion kring vårdinsatser och vårdnivå för patienter med misstänkt eller säkerställd svår sepsis/septisk chock.
Kvalitetsmål
Programgruppen har formulerat 8 kvalitetsmål (Fakta 6) för omhändertagandet av patienter med svår sepsis, vilka vi anser bör vara grundläggande i all akutsjukvård. Varje sjukhus måste ta ansvar för att dessa mål uppfylls och därmed också skapa de förutsättningar som är nödvändiga för att nå målen. Målen kan också ligga till grund för den kvalitetskontroll av sepsisvården som bör göras fortlöpande på varje akutsjukhus. Vårdprogrammet som refereras i denna artikel är avsett som en hjälp att uppnå dessa kvalitetsmål.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Samtliga författare har ingått i programgruppen som på Svenska infektionsläkarföreningens uppdrag utarbetat vårdprogrammet »Svår sepsis och septisk chock – tidig identifiering och initial handläggning«, som denna artikel baseras på. Dessutom har Magnus Brink, Göteborg; Peter Lanbeck, Malmö; Lars R Ljungström, Skövde; Gisela Otto, Lund; Jesper Svefors, Jönköping; och Tomas Vikerfors, Västerås, medverkat i programgruppen.