Sammanfattat
Undertrycksbehandling skapar en fuktig sårläkningsmiljö, dränerar överflödig vätska, minskar vävnadsödem, drar samman sårkanterna, stimulerar sårbädden mekaniskt och påverkar blodflödet i sårkanten samt stimulerar angiogenes och nybildning av granulationsvävnad.
Med ledning av ny kunskap om verkningsmekanismerna för undertrycksbehandling ges möjlighet att variera behandlingen så att varje patient erbjuds bästa möjliga sårläkning med minimalt antal komplikationer.
Vi ger exempel på hur val av undertrycksnivå, val av sårfyllnadsmaterial (skum eller gasväv) och val av vilket sätt undertrycket appliceras på (kontinuerligt, intermittent eller variabelt) påverkar behandlingen och därmed kan användas för att styra den.
Undertrycksbehandling av sår har förekommit i knappt 100 år. Den teknik som används i dag har sitt ursprung i Ryssland i början av 1970-talet [1-4]. Introduktionen i västvärlden skedde genom att ett antal patientfall och grundläggande djurexperimentella studier rapporterades av Morykwas och medarbetare under 1997 [5, 6], men också genom tidigare fallrapporter från bl a Fleischmann et al [7] och Chariker et al [8]. Sedan slutet av 1990-talet har användningen av tekniken ökat explosionsartat, eftersom effekten på sårläkning varit revolutionerande [9, 10].
Initialt benämndes behandlingen »VAC« (vacuum assisted closure), men eftersom detta är ett varumärke tillhörande ett specifikt företag (KCI) och det nu finns mer än 15 aktörer på marknaden, förekommer olika benämningar på terapin, bl a »topical negative pressure« (TNP), »vacuum therapy« och »subatmospheric pressure therapy«. Man har sedermera enats om samlingsbegreppet »negative pressure wound therapy« (NPWT) [11].
I dag används undertrycksbehandling flitigt vid behandling av svårläkta sår. Goda resultat har visats för bl a traumatiska ortopediska skador [12], mjukdelstrauma [13], plastikkirurgiska sår (hudtransplantat [14]), trycksår [15], venösa bensår [16], kärlkirurgiska sår, diabetesrelaterade fotsår [17] och brännskador [18] samt postoperativa infektioner efter abdominell kirurgi [19] och toraxkirurgi [20].
Behandlingsindikationerna varierar mellan olika kliniker. Generellt sett övervägs undertrycksbehandling vid svårläkta sår (s k hard-to-heal wounds), t ex vid stora mängder exsudat, vid besvärlig sårlokalisation där vanliga förband svårligen kan nyttjas och när en storleksminskning av såret krävs för att det ska kunna slutas [21, 22]. Dessutom lämpar sig tekniken väl för patienter där förbandsbyten är svåra att få till stånd, som hos barn [23, 24].
Innan behandlingen inleds debrideras såret, och sårhålan fylls med ett poröst material, vanligen gasväv [8] eller en speciell sorts »skum« (polyuretanskum med en öppen porstruktur). Därefter placeras en dränageslang ovanpå sårfyllnadsmaterialet, och hela såret täcks med ett tättslutande plastförband. Undertrycket appliceras sedan på ett kontrollerat sätt genom en vakuumpump. Pumpen är utformad för att tidigt kunna upptäcka eventuella komplikationer, t ex ocklusion eller luftläckage. Den vätska som dräneras från såret samlas upp i en för ändamålet avsedd behållare. Förbandet byts vanligen varannan eller var tredje dag [25].
Trots att långt över 1 000 artiklar publicerats inom området är tekniken ännu inte helt evidensbaserad [26], till stor del beroende på svårigheten att göra kontrollerade, randomiserade studier på en oerhört heterogen sårpopulation. I en SBU-rapport från 2009 ansågs det vetenskapliga underlaget vara otillräckligt för att kunna förorda undertrycksbehandling framför standardbehandling av svårläkta sår [27].
På grundval av de kliniska framgångarna har man ändå fortsatt att undertrycksbehandla svårläkta sår i stor utsträckning. Under de senaste åren har man med hjälp av djurförsök försökt klarlägga undertrycksbehandlingens biologiska effekter i sårbädden. Vår forskargrupp har haft en roll i dessa försök, och vi vill med denna artikel förmedla några av de senaste fynden och ge förslag på hur man skulle kunna optimera behandlingen med ledning av dessa.
Verkningsmekanismer
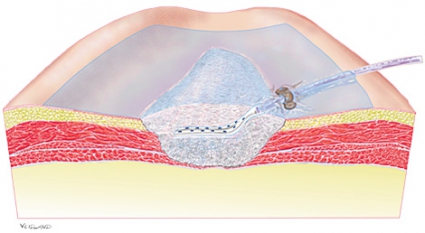
Det är numera känt att undertrycksbehandling (Figur 1)
• skapar en fuktig sårläkningsmiljö [28]
• dränerar överflödig vätska [5, 6, 29]
• minskar vävnadsödem [30]
• drar samman sårkanterna [5, 6, 29]
• stimulerar sårbädden mekaniskt [31-33]
• påverkar det lokala blodflödet i sårkanten [6, 34-36]
• stimulerar angiogenes [37, 38]
• stimulerar nybildning av granulationsvävnad [6].
Man tror inte att behandlingen påverkar bakteriemängden i såret [39, 40], men genom att såret innesluts och förbandsbytena blir färre undviker man möjligen kontamination från omgivningen och därmed sekundärinfektioner [41]. Detta kan vara nog så viktigt, eftersom de flesta sårinfektioner härstammar från den endogena bakteriefloran [42].
Trycköverföring och vätskedränage
Undertrycksbehandling bygger på att trycket fortplantas från vakuumpumpen till sårbädden via ett poröst sårfyllnadsmaterial (skum eller gasväv). Det kontinuerliga undertrycket leder till dränage av sårvätska och därmed minskar risken för vätskeretention i djupare delar av såret. I kroniska sår ansamlas nekrotiskt material som förändrar den biokemiska miljön [43] så att bakteriell kolonisering underlättas och sårläkning förhindras.
I dagsläget är det inte helt klarlagt huruvida det är de förhöjda nivåerna av olika inhibitoriska komponenter i sårvätskan, t ex metalloproteinaser, som fördröjer/förhindrar sårläkningen eller om detta bara är ett uttryck för andra förändringar som sker i ett kroniskt sår. En minskning av mängden metalloproteinaser är korrelerad med sårläkning, och dylika biokemiska förändringar ses vid undertrycksbehandling av sår [38, 44].
Sårläkningsmiljön, som bör vara fuktig, riskerar att torkas ut om förbandet inte är tättslutande, eftersom luft då sugs in.
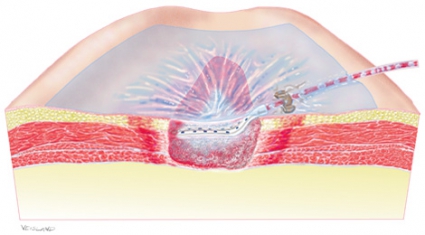
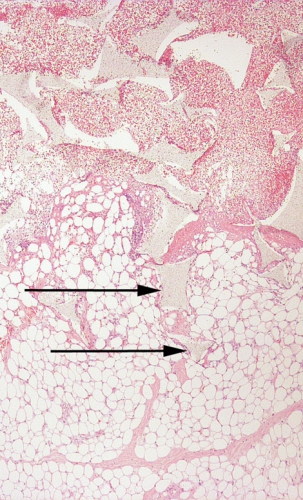
Eftersom undertrycket endast påverkar den vävnad som står i direkt förbindelse med sårfyllnadsmaterialet [45], är det viktigt att se till att alla delar av såret har kontakt med sårfyllnadsmaterialet – t ex måste en liten fistulering i sårbotten vara helt fylld med sårfyllnadsmaterial för att fullgod behandlingseffekt ska uppnås (Figur 2).
Ödemreduktion
Den inflammatoriska reaktionen i ett sår genererar ett vävnadsödem, som i sin tur leder till ökat interstitiellt tryck och därmed minskad genomblödning. Den lokala hypoxin i kombination med minskad näringsförsörjning minskar motståndskraften mot infektioner och fördröjer läkningen. Eftersom undertrycksbehandling komprimerar ytlig vävnad, anses det interstitiella ödemet minska [46].
Mekanisk påverkan
En av de viktigaste effekterna av undertrycksbehandling är att sårkanterna dras samman (makrodeformation) [31]. Sårvävnaden och sårfyllnadsmaterialet interagerar också på en mikroskopisk nivå (mikrodeformation) genom att sårbädden »sugs in« i porerna i fyllnadsmaterialet (skum eller gasväv) [33]. Dessa mekaniska effekter påverkar cellernas cytoskelett [33] och initierar en kaskad av biologiska effekter, som slutligen leder till bildning av granulationsvävnad och sårläkning [47]. Flertalet in vitro-studier har visat på vikten av att celler utsätts för mekanisk stress för att de ska kunna utvecklas och bibehålla en fenotyp som möjliggör nybildning av extracellulärmatrix [48-51]. När sårkanterna sträcks expanderar vävnaden, och därmed underlättas slutning av såret.
Lokalt blodflöde
Djurexperimentella studier har tydligt visat att undertrycksbehandling ger upphov till lokala blodflödesförändringar. Blodflödeseffekterna varierar beroende på såväl undertrycksnivån som avståndet från sårkanten [35]. Maximala blodflödesförändringar ses vid ca –80 mm Hg [52]. Väldigt höga undertrycksnivåer (–400 mm Hg) leder till minskat blodflöde [6]. Ytligt i sårvävnaden (0,5 cm från sårkanten) ses minskat blodflöde, medan genomblödningen ökar längre in i sårvävnaden (2,5 cm från sårkanten) [35, 36, 52]. Det minskade blodflödet stimulerar angiogenes [53] och nybildning av vävnad och har visats bero på att undertrycksbehandlingen komprimerar den ytliga vävnaden [46, 54].
Ökat blodflöde bidrar till förbättrad syresättning och näringsförsörjning av vävnaden samtidigt som antibiotikapenetration och bortförsel av slaggprodukter underlättas. Mekanismen bakom blodflödesökningen är ännu inte klarlagd, men det spekuleras över om undertrycket åstadkommer en dragkraft i vävnaden, vilket öppnar kapillärer och ökar genomblödningen.
Vi tror att denna kombination av minskning och ökning i blodflöde är gynnsam för sårläkningen.
Angiogenes och bildning av granulationsvävnad
Undertrycksbehandling utövar mekanisk påverkan på sårkanten med efterföljande lokala blodflödesförändringar, vilket skapar en gynnsam miljö både för celler att regenerera och för bildning av granulationsvävnad. Med granulationsvävnad avses den bindvävnad som tillsammans med små blodkärl utgör sårbädden. Bildningen av granulationsvävnad och angiogenes påskyndas med undertrycksbehandling [6, 37, 38, 55].
Optimeringsstrategier
Även om undertrycksbehandlingen i dess nuvarande form har revolutionerat sårvården, finns det utrymme för att förfina tekniken för att optimera sårläkningen och minska antalet komplikationer. Fundamentet för all undertrycksbehandling utgörs av en studie från 1997 av Morykwas och medarbetare [6]. Studien, i vilken man bl a fastställer att –125 mm Hg ska användas för undertrycksbehandling, baseras på försök på sex grisar.
På basis av de senaste årens forskning vet vi att man kan välja andra undertrycksnivåer, sårfyllnadsmaterial (skum eller gasväv) eller sätt att applicera undertrycket på (kontinuerligt, intermittent eller variabelt) för att styra behandlingen. Mycket av forskningen har gjorts på sår på grisar, och därmed har det varit osäkert huruvida resultaten är direkt överförbara till människor. Intressant nog har erfarna kliniker empiriskt kommit fram till liknande slutsatser, och kunskapen börjar nu sakta implementeras i patientvården.
Inom patientvården används undertrycksbehandling av sår inom flera discipliner (t ex plastikkirurgi, ortopedi och brännskadevård). Eftersom denna uppdelning inte låter sig göras i djurexperimentella studier, har vi fokuserat på kunskap om de biologiska effekterna på mjukdelarna i sårkanten – verkningsmekanismerna där är rimligen desamma oavsett om behandlingen sedan används inom ortopedi eller plastikkirurgi.
Undertrycksnivå
I dag används oftast en enda undertrycksnivå, –125 mm Hg, baserat på Morykwas’ studie från 1997 [6]. Vi vet dock att –80 mm Hg åstadkommer maximala effekter i sårkanten med avseende på sårkontraktion [56], mikrodeformation [31], lokalt blodflöde [52] och nybildning av granulationsvävnad [55]. Högre undertrycksnivåer (–125 mm Hg) behövs förmodligen bara vid behandling av sår med stora mängder exsudat [56], och kanske räcker det då att använda denna högre nivå under de första dagarna.
Vid behandling av sår med dålig genomblödning, t ex fotsår hos diabetespatienter och tunna hudtransplantat, medför högre undertrycksnivåer (dvs mer än –80 mm Hg) troligen en risk för hypoperfusion, eftersom den maximala effekten på det regionala blodflödet redan uppnåtts [52]. Dessutom är det vanligt med smärta vid dessa undertrycksnivåer [57]. Studier visar att hypoperfusionen inte är lika påtaglig vid –40 mm Hg, samtidigt som undertryckseffekterna på såret kvarstår till viss del. Med anledning av detta skulle –40 mm Hg kunna vara en tänkbar undertrycksnivå för dåligt vaskulariserade sår [52]. Kliniska studier har bekräftat att undertryck som är lägre än –125 mm Hg också ger upphov till fullgod sårläkning [57].
Sammanfattningsvis finns det alltså inte en optimal undertrycksnivå, utan snarare ett spann mellan –25 och –125 mm Hg där olika biologiska effekter är maximerade. Valet av undertrycksnivå bör därför göras med tanke på vilka biologiska verkningsmekanismer man anser vara viktigast att optimera för det aktuella såret.
Sårfyllnadsmaterial
Ursprungligen användes enbart polyuretanskum som sårfyllnadsmaterial. I dag används även gasväv som är impregnerad med ett antibakteriellt preparat (polyhexametylenbiguanid, PHMB) [58]. Trycköverföringen till sårbädden har befunnits vara likartad oavsett om gasväv eller skum används [32]. Likaså bibehålls den fuktiga läkningsmiljön oavsett val av sårfyllnadsmaterial.
Valet av sårfyllnadsmaterial påverkar sårläkningen i stor utsträckning. Skum stimulerar snabbt nybildning av stora mängder granulationsvävnad, vilket kan vara gynnsamt t ex efter sternotomi. Den granulationsvävnad som bildas under gasväv är tunn och mera stabil, medan polyuretanskum ger riklig men lucker granulationsvävnad [55, 59, 60]. En kraftig läkningsreaktion leder till en hypertrofisk granulationsvävnad och i förlängningen till fibros, ärrläkning och kontrakturer [60].
Det kan tänkas att gasväv är att föredra när det kosmetiska resultatet är betydelsefullt och när kontrakturer bedöms vara extra olämpliga (t ex vid lednära sår). Ytterligare en fördel med gasväv är lättheten att anpassa materialet för »besvärliga« sårutseenden.
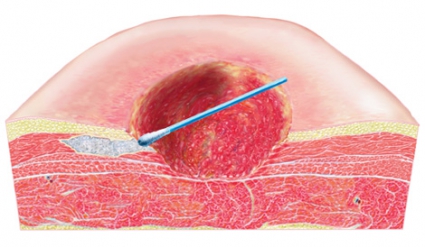
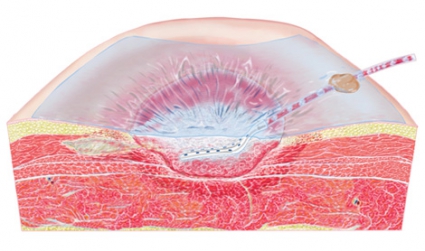
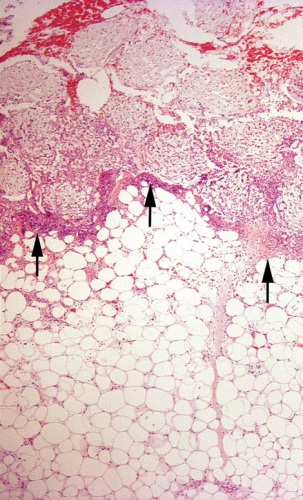
Granulationsvävnaden växer in i skum [61] men inte in i gasväv [55] (Figur 3). Inväxten gör att förbandsbyten blir mer smärtsamma [62], och nybildad vävnad kan komma att skadas. Dessutom riskerar delar av skummet att bli kvar i såret [63, 64], vilket senare kan leda till en främmandekroppsreaktion. För att undvika inväxt kan ett »kontaktlager« placeras mellan sårfyllnadsmaterialet och sårbädden [55], men samtidigt minskar då den mekaniskt stimulerande kontakten mellan skummet och sårbädden. Kontaktlager används när det finns underliggande känsliga strukturer eller när inväxt i skummet måste motverkas. Om man vill minimera inväxtproblematiken är gasväv ett lämpligt fyllnadsmaterial.
Nästa steg i utvecklingen av undertrycksbehandling blir troligen nya sårfyllnadsmaterial, där problemen med inväxt undviks samtidigt som läkningsreaktionen stimuleras. För närvarande studeras även biodegraderbara material, vilket teoretiskt skulle kunna medföra att man undviker smärtsamma förbandsbyten [64].
Forskningen har hittills visat att det finns en mängd material som skulle kunna underlätta celladhesion, diffusion av näringsämnen och tillväxt [65].
Kontinuerligt, intermittent och variabelt undertryck
Oftast används kontinuerlig behandling, vilket innebär att undertrycksnivån hela tiden är densamma (t ex –75 mm Hg). Denna behandlingsform är utmärkt till sår med stora mängder exsudat. Om trycknivån i stället alternerar mellan atmosfärstryck och, exempelvis, –75 mm Hg benämns detta »intermittent behandling« [6]. Variabel undertrycksbehandling liknar den intermittenta behandlingen, men trycket förblir hela tiden negativt (man kan alternera mellan t ex –10 och –75 mm Hg), och övergången mellan undertrycken sker gradvis för att minska problemen med smärta hos patienterna. Cyklerna är vanligtvis 7 minuter långa: 5 minuter med högt undertryck och 2 minuter med lågt undertryck eller atmosfärstryck. Dessa tidsperioder baseras på Morykwas’ studie från 1997 [6], eftersom det saknas studier som närmare undersöker vilka tidsspann som är bäst ur läkningssynpunkt.
Både den intermittenta och den variabla behandlingen har visats öka nybildningen av granulationsvävnad mer än om kontinuerlig terapi används [6, 66]. Orsaken är troligtvis den mekaniska stimuleringen av sårbädden [66] i kombination med blodflödeseffekter [67].
Trots de beskrivna fördelarna har intermittent behandling inte använts kliniskt i någon större utsträckning. Två tänkbara förklaringar är att de regelbundna kontraktionerna ger plötsliga smärtgenombrott som är svåra att tolerera samt att det uppstår svårigheter att få förbandet att sitta kvar över såret. Variabel undertrycksbehandling introducerades eftersom den troligen kan minimera dessa problem samtidigt som de gynnsamma effekterna på sårläkningen kvarstår.
Sammanfattning
Många av de verkningsmekanismer som tros ligga till grund för den goda sårläkningseffekt som ses vid undertrycksbehandling är kartlagda. Med ledning av dessa ges möjlighet att variera behandlingen så att varje patient får bästa möjliga sårläkning utan att komplikationsrisken blir oacceptabelt hög. Valet av sårfyllnadsmaterial (gasväv eller skum) har djurexperimentellt visat sig vara av stor betydelse för sårläkningen. Även undertrycksnivån och sättet undertrycket appliceras på (kontinuerligt, intermittent eller variabelt) kan anpassas till det enskilda såret. Utvecklingen inom området förväntas framskrida raskt den närmaste tiden, bl a med nya typer av sårfyllnadsmaterial och större kliniska studier.
*
Potentiella bindningar eller jävsförhållanden: Richard Ingemansson, Sandra Lindstedt och Malin Malmsjö anlitas som experter och rådgivare av en rad svenska och utländska företag (Prospera, Smith & Nephew, Mölnlycke, Johnson & Johnson, Magle AB, Synthes), som arbetar med sårvård och/eller undertrycksbehandling.