Sammanfattat
Nokardios är främst en opportunistisk infektion, men cirka en tredjedel av de drabbade är immunkompetenta.
I Sverige diagnostiseras sällan några fall av nokardios.
Människor smittas via inokulation på skadad hud eller genom inhalation.
Vid disseminerad nokardios är symtomen ospecifika, och sjukdomen kan förväxlas med tuberkulos eller malignitet.
Relevanta prov med begäran om förlängd odlingstid krävs för att säkerställa diagnosen nokardios.
Här beskrivs ett fall med en man som efter längre vistelse i Irak insjuknade med allmänpåverkan och kraftig viktnedgång. Röntgenundersökningar visade oklara lungförändringar och patienten avled utan att diagnos hade ställts. Vid obduktionen fann man multipla abscesser spridda i kroppen ur vilka Nocardia farcinica odlades fram.
Nocardia-infektion, nokardios, är ovanlig i Sverige, men incidensen är okänd på grund av att Nocardia (en aerob, grampositiv, förgrenad stav) är svår att upptäcka. Vid disseminerad nokardios är symtomen ospecifika, och sjukdomen kan förväxlas med tuberkulos (tbc) eller malignitet. Relevanta prov med begäran om förlängd odlingstid krävs för att säkert kunna ställa diagnos. Här beskrivs ett fall där patienten avled.
Fallbeskrivning
Patienten var en 40-årig tidigare väsentligen frisk man som tidigare varit rökare. Mannen kom ursprungligen från Irak men hade varit bosatt i Sverige sedan tio år. Det senaste året hade mannen bott hos släktingar i norra Irak, där han insjuknat med tilltagande trötthet och klåda på benen. Han sökte läkare vid flera tillfällen i Irak, fick slutligen diagnosen depressiv psykos och behandlades med diverse psykofarmaka. Symtomen tilltog dock med matleda och viktnedgång på drygt 10 kg. På grund av nytillkomna smärtor i ryggen och svaghet i benen blev mannen inlagd på sjukhus i Irak, där han fick diagnoserna diabetes mellitus och anemi. Mannen återvände därefter till Sverige och sökte omgående (tre månader efter insjuknandet i Irak) läkarhjälp på akutmottagningen vid Skånes universitetssjukhus i Malmö.
Lades in på infektionskliniken. Patienten var vid ankomsten till akuten medtagen, blek, intorkad och trött, med medvetandegrad motsvarande RLS 2 utan nackstyvhet. I munnen sågs en utbredd beläggning med multipla afteliknande sår. Saturationen var 95 procent. Han hade takypné men var afebril. Blodtrycket var 96/64 mm Hg, pulsen regelbunden och normofrekvent. Känsel och kraft var nedsatt i underbenen. Där noterades även ett flertal petekier. Laboratorieprov visade B-TPK 75 ✕ 109/l (referensintervall 145–348), B-Hb 90 g/l (134–170), P-CRP 58 mg/l (≤ 5), B-LPK 8,2 ✕ 109/l (3,5–8,8), P-glukos 9,3 mmol/l (4,2–6,3), P-K 2,4 mmol/l (3,5–4,4), P-PK 1,4 (≤ 1,2), aB-pH 7,53 (7,37–7,47) och B-BE + 19 mmol/l (–3 till +3).
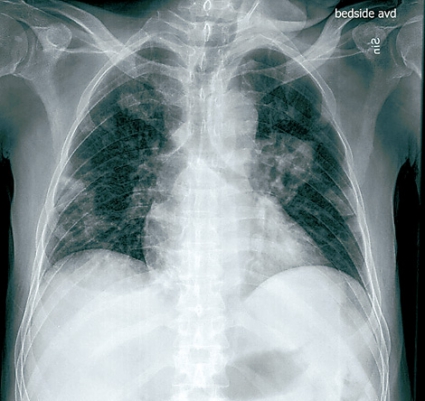
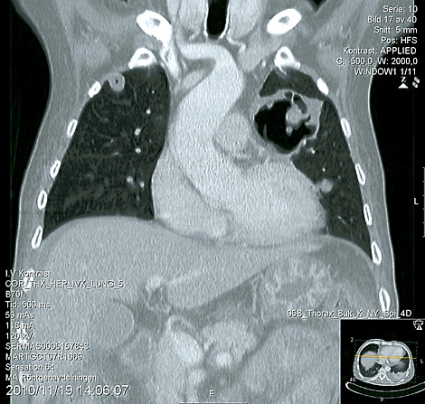
Patienten lades in på infektionskliniken, där han screenades och isolerades avseende multiresistenta bakterier. På misstanke om oral svampinfektion sattes nystatin in. Då patienten hade diarré togs fecesodling och prov för Clostridium difficile. Patienten fick syrgas på grimma. Lungröntgen visade bilaterala avrundade parenkymförändringar av oklar natur (Figur 1). Fynden ingav misstanke om malignitet alternativt tbc, varför man gick vidare med datortomografi av torax, buk och hjärna. DT-hjärna var utan anmärkning, men DT-torax visade en stor kavern i vänster ovanlob och bilateralt flera kaviterande förändringar med vätskenivåer samt en mindre mängd pleuravätska (Figur 2). På DT-buk sågs en ödematös kolonvägg. Clostridium difficile-toxin i feces var positivt, och behandling med metronidazol påbörjades. Svar på sedvanlig fecesodling var negativ. Den neurolog som konsulterades bedömde att patienten hade nedsatt kraft i benen men att han inte var totalt paraplegisk. MR-rygg beställdes.
Då patienten uppgav huvudvärk genomfördes lumbalpunktion på misstanke om tuberkulös meningit men likvoranalysen var utan anmärkning. Direktmikroskopi av likvor efter gramfärgning och Ziehl–Nielsen-färgning visade inga bakterier, och PCR var negativ för tbc. Då patienten inte kunde producera något sputumprov genomfördes ventrikelsköljning, och han fick kombinationsbehandling mot tbc. Direktmikroskopi med Ziehl–Nielsen-färgning och PCR av ventrikelsköljning utföll dock negativt avseende tbc. MRSA-screening var positiv, och eradikeringsbehandling med mupirocinsalva nasalt och trimetoprim–sulfametoxazol sattes in. Screening för multiresistenta bakterier visade även växt av ESBL-producerande E coli och K pneumoniae i feces.
Dag sex var patienten fortsatt kliniskt stabil men behövde syrgas. Diagnosen var fortfarande oklar, och man gick vidare med bronkoskopi med bronkoalveloärt lavage. Kvantitativ odling från borstprov visade växt av insignifikanta mängder MRSA (100 CFU/ml) och K pneumoniae, ESBL typ A (80 CFU/ml) men signifikant växt av Streptococcus species (1200 CFU/ml). PCR från bronkoalveloärt lavage utföll negativ avseende tbc. Hb och trombocyter fortsatte att sjunka av oklart skäl. Hematolog konsult bedömde att patientens progredierande trombocytopeni och anemi i första hand berodde på sekundär benmärgsdepression vid svår infektion, inte på underliggande hematologisk malignitet.
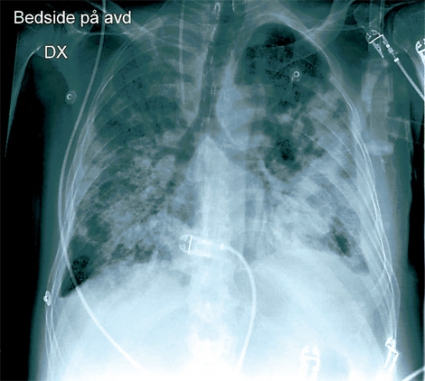
Patienten kraftigt försämrad. På kvällen den sjunde dagen efter inläggning försämrades patienten med dyspné, sjunkande saturation och tryck över bröstet. Hb sjönk från 113 till 74 g/l. Akut lungröntgen visade en bild förenlig med lungödem alternativt lungblödning. Patienten försämrades ytterligare, och han intuberades och lades i respirator. Ny lungröntgen efter att central venkateter lagts in visade ingen pneumotorax, däremot progress av lungförändringarna, mest uttalat på vänster sida med pleuravätska (Figur 3). Ny bronkoskopi visade inget synligt blod i bronkerna men rikligt med klart sekret. Flera timmar senare blev patientens tryck instabilt. Septikemi misstänktes och han fick tobramycin och trimetoprim–sulfametoxazol intravenöst. Då malignitet var en sannolik differentialdiagnos påskyndades svaret från den cytologiska undersökningen av bronkoalveolärt lavage och borstprov. Denna visade endast ospecifik inflammation och inga maligna celler. Man gjorde även ett ultraljud av hjärtat, vilket var svårbedömt, men vänster kammare bedömdes fungera normalt. Det blev dock allt svårare att ventilera patienten i respiratorn. Han försämrades successivt med sjunkande syresättning och höga luftvägstryck och avled efter några timmar.
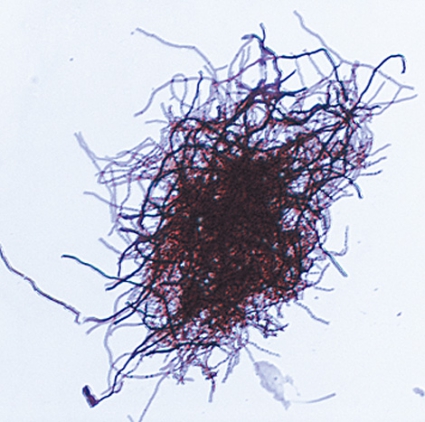
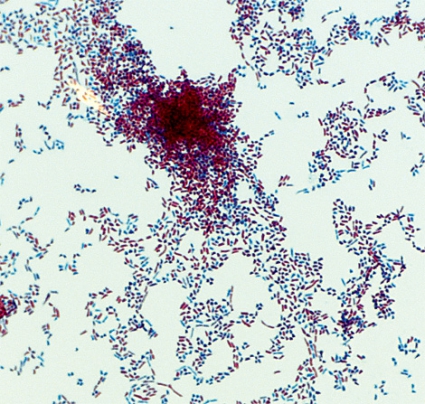
Diagnos post mortem. Obduktionen visade inga malignitetssuspekta förändringar, däremot påvisades abscesser bilateralt i lungparenkymet, myokardiet, båda njurarna, tunntarmsmesenteriet och i tyreoidea. Prov togs från lungvävnad. Vid direktmikroskopi med Ziehl–Nielsen-färgning noterades blå nystan men inga mykobakterier (Figur 4). Prov från lungvävnad odlades efter sedvanlig avdödning av syrakänsliga bakterier dels på fast substrat (Löwenstein–Jensen-medium), dels i flytande odlingsmedium (Middlebrook-buljong) för automatisk odling och avläsning i Bactec MGIT 960-systemet.
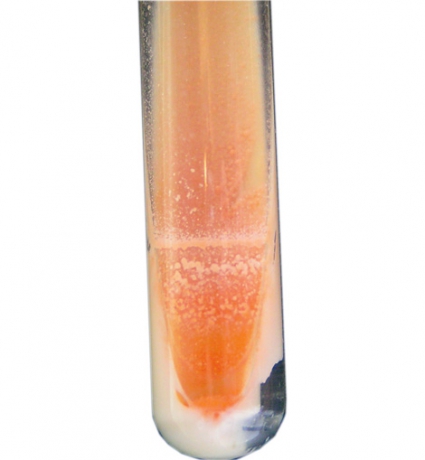
Efter 6 dagars inkubation växte bakterier i MGIT-röret, och vid mikroskopi med Ziehl–Nielsen-färgning sågs syralabila, långa grenade stavar (Figur 5). Bakteriebuljongen inkuberades på konventionell agar samt på Löwenstein–Jensen-medium. Efter 3 dygn växte små gulorange kolonier (Figur 6). Bakteriekolonierna artbestämdes med sekvensering av 16S-RNA-genen till Nocardia farcinica. Stammen resistensbestämdes med E-test (MIC-värden inom parentes) för cefotaxim (8 mg/l), imipenem (1,0 mg/l), amikacin (2,0 mg/l), trimetoprim–sulfametoxazol (0,5 mg/l) och ciprofloxacin (0,064 mg/l), vilka tolkades som känsliga, medan MIC för tobramycin (64 mg/l) och piperacillin-tazobactam (256 mg/l) tolkades som resistenta.
Post mortem anlände svar från mikrobiologiskt laboratorium, som visade att tbc-odlingar från bronkoalveloärt lavage, likvor och ventrikelsköljvätska utföll negativ. I provmaterialet från lungvävnad som togs vid obduktionen påvisades måttlig växt av K pneumoniae ESBL typ A och sparsam växt av aneroba bakterier. Dödsorsaken bedömdes vara en disseminerad Nocardia farcinica-infektion. Patienten hann aldrig genomgå en MR-undersökning av ryggen. Någon förklaring till smärtorna samt de neurologiska bortfallssymtomen i benen finns därmed inte. Man kan spekulera över om det även fanns spridning av Nocardia farcinica till skelettet.
Disseminerad nokardios ovanlig i Sverige
Nocardia är en aerob, grampositiv, förgrenad stav [1]. De är normalt förekommande i jord och vatten över hela världen, men det är sällan som fall av Nocardia-infektion diagnostiseras i Sverige. Den sanna incidensen är dock okänd eftersom Nocardia är svår att upptäcka. Nocardia är inte anmälningspliktig enligt smittskyddslagen, och några smittskyddsåtgärder föreligger inte vid nyupptäckt infektion [2]. Det finns mer än 80 arter av Nocardia, varav minst 33 kan ge upphov till sjukdom hos människa [3]. N farcinica anses vara en av de mest virulenta arterna då den oftare orsakar disseminerad sjukdom. Antibiotikaresistens är också vanligare hos N farcinica än hos övriga Nocardia-arter. Detta gäller särskilt resistens mot tredje generationens cefalosporiner och tobramycin [4]. Människor kan smittas av Nocardia via direkt inokulation på skadad hud eller genom inhalation [5)]. I majoriteten av fallen infekteras primärt lungorna och man tror att infektionen sedan sprids hematogent [6]. Den disseminerade infektionen kan drabba i princip hela kroppen även om lungor, CNS, hud, skelett, hjärtklaffar, leder och njurar är de vanligaste lokalerna [7]. Inkubationstiden är osäker och kan variera från några dygn till veckor [2]. Nocardia-infektion anses ofta vara opportunistisk. Kortisonbehandling, organtransplantation, HIV-infektion och malignitet är de viktigaste riskfaktorerna. Diabetes mellitus, rökning och kronisk lungsjukdom ökar också risken [8].
Här var patienten tidigare rökare och hade en nyupptäckt diabetes mellitus. Cirka en tredjedel av de patienter som insjuknar i nokardios är dock immunkompetenta, och de drabbas framför allt av den primärt kutana manifestationen [6]. Män drabbas oftare än kvinnor. Det är oklart om detta hänger ihop med en ökad exponering för Nocardia inom vissa yrken, eller om östrogen kan ha en skyddande effekt hos kvinnor [9].
Symtom och diagnos
Symtomen vid disseminerad nokardios är ospecifika och beror på vilka organ som är drabbade. Om lungorna är involverade så är feber, nattsvettning, allmän trötthet, viktnedgång, dyspné, hosta, hemoptys och bröstsmärtor vanligt förekommande [1]. Eftersom symtomen är ospecifika och de röntgenologiska fynden mycket väl kan överensstämma med tbc är det vanligt att man som i det här fallet börjar behandla patienten för tbc. Andra vanliga differentialdiagnoser vid Nocardia-infektion som omfattar lungorna är malignitet (primär lungcancer eller lungmetastaser) och invasiv svampinfektion (Aspergillus, zygomykos, Cryptococcus neoformans) [1].
För att ställa diagnosen nokardios är det viktigt att få till relevanta prov, gärna tagna från djupa lokaler [10]. I det här fallet var direktmikroskopi från både ventrikelsköljvätska och bronkoalveloarvätska negativa, men i vävnadsprov från obduktionen hittade man Nocardia. Nocardia blir lätt överväxt av snabbväxande bakterier [1]. Från den här patientens borstprov växte tre arter av bakterier (MRSA, K pneumonia ESBL typ A, och Streptococcus species), vilket gör att det sannolikt inte hade gått att identifiera Nocardia-kolonier. Detta gör att direktmikroskopi är av särskild vikt vid diagnostik av Nocardia. Vid direktmikroskopi kan man påvisa grampositiva förgrenade, oftast syrafasta stavar. Nocardia har inga särskilda tillväxtkrav utan växer på de flesta aeroba odlingsmedier, inklusive Löwenstein–Jensen-medium. Nocardia växer långsamt och kräver 5–21 dagar för att växa fram, så det är viktigt att begära förlängd odlingstid [6]. Det går också att blododla, men det är ovanligt att Nocardia växer fram i blod [11].
Behandling
Nocardia har en varierande känslighet mot olika antibiotika. Vid svår infektion rekommenderas att man behandlar intravenöst med två eller tre antibiotika i väntan på resistensbestämning [3]. Trimetoprim–sulfametoxazol är förstahandsmedel och kan ges tillsammans med andra preparat som amikacin, imipenem eller cefotaxim. Kombinationsbehandlingen ska sträcka sig mellan tre och sex veckor beroende på behandlingssvar och immunstatus. Därefter kan man gå över till peroral behandling med exempelvis trimetoprim–sulfametoxazol [3]. Patienten i det fall som beskrivits fick trimetoprim–sulfametoxazol för sent i förloppet. Behandlingstiden är inte väl definierad men bör vara lång eftersom det finns risk att Nocardia-infektionen recidiverar. Vid svår infektion rekommenderas behandling under minst ett år. Kirurgisk intervention kan ske på samma indikation som vid andra former av kronisk bakteriell infektion [1]. Vid tidig diagnos och tidigt insatt behandling är prognosen god även vid disseminerad sjukdom [12]. Dock är det vanligt att diagnosen ställs för sent, vilket det här fallet illustrerar.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
*
Ingela Tjernberg och Marianne Jonsson vid Labmedicin Skåne har tagit bilderna av Nocardia farcinica, framodlad från patienten i fallrapporten.