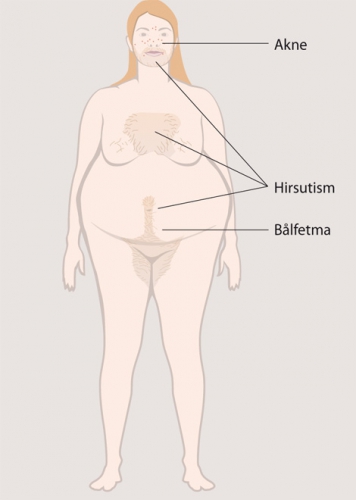
Polycystiskt ovariesyndrom (PCOS) beskrevs första gången 1935 av Stein och Leventhal och kallas i äldre litteratur för Stein–Leventhals syndrom [1]. Det är ett heterogent tillstånd med varierande klinisk bild, och det är viktigt att utesluta andra potentiellt allvarligare tillstånd innan diagnosen fastställs. Kvinnan/flickan kan söka hos gynekolog, hudläkare, barnläkare, distriktsläkare eller internmedicinare för infertilitet, amenorré, hirsutism, akne, prematur adrenarke eller övervikt.
PCOS är den vanligaste endokrina rubbningen hos kvinnor i fertil ålder. Prevalensen varierar i olika etniska grupper och är svår att fastställa exakt; 6–8 procent är en siffra som reproducerats i flera studier [2]. Symtomen hos en kvinna varierar också över tid beroende på ålder och livsstilsfaktorer. Denna sammanställning baseras på artiklar i databasen PubMed samt på svenska [3] och internationella kliniska riktlinjer.
Diagnostik
De diagnoskriterier vi använder i Sverige fastställdes vid en konsensuskonferens i Rotterdam 2003 och kallas för Rotterdamkriterierna [4]. Två av tre kriterier krävs för diagnos. Rotterdamkriterierna har kritiserats, framför allt för att de innebär att diagnosen PCOS kan ställas utan att kliniska eller biokemiska tecken på hyperandrogenism finns. När man läser litteraturen om PCOS är det viktigt att man är medveten om vilka diagnoskriterier som avses. Diskussion pågår fortfarande om hur man bäst ställer diagnosen [2].
Etiologi och patogenes
PCOS har multifaktoriellt ursprung med en genetisk komponent och trolig överlappning till ärftlighet för metabola syndromet [5]. Den genetiska predispositionen samverkar med livsstilsfaktorer och troligtvis också med den intrauterina miljön [6].
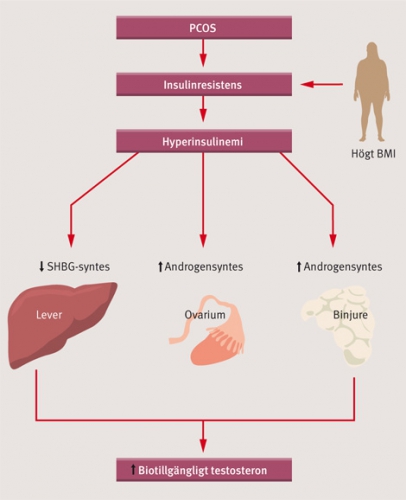
Den primära orsaken är inte klarlagd, men både insulinresistens och hyperandrogenism är nyckelfaktorer. Insulinresistens leder till hyperinsulinemi: insulin påverkar ovarier och binjurar till ökad androgenproduktion och levern till minskad produktion av könshormonbindande globulin (SHBG). Hyperandrogenism kan i sin tur ge insulinresistens.
Fettfördelningen skiljer sig mellan kvinnor utan PCOS – både överviktiga och normalviktiga – och kvinnor med PCOS, som har mer av abdominellt än av gluteofemoralt fett. Den abdominella fetman är mer metabolt aktiv och förvärrar insulinresistensen. Viktreduktion är därför ett viktigt om än svåruppnått mål [4, 6].
Huruvida det finns en manlig variant av PCOS är oklart – den har ännu inte identifierats. Spekulationer finns om att tidig skallighet skulle kunna vara ett uttryck för PCOS hos män [7].
Symtom och långtidsrisker
Kliniska symtom på oligo- eller anovulation är oligo-/amenorré och infertilitet på grund av uteblivna eller få ovulationer. Primär amenorré innebär att spontan menstruation aldrig funnits. Sekundär amenorré definieras som menstruationer med ett uppehåll på minst tre cykelintervall. Oligomenorré är menstruationer med en cykellängd >35 dagar [3].
Sambandet mellan biokemisk och klinisk hyperandrogenism (akne, hirsutism, androgen alopeci) är svagt, och sannolikt är orsaken till klinisk hyperandrogenism multifaktoriell. Hirsutism har starkare samvariation med förhöjda testosteronnivåer än akne [2, 4]. Kraftigt förhöjda testosteronnivåer tyder på annan genes än PCOS. Virilisering med röstpåverkan och klitorishypertrofi kräver att androgenproducerande tumör och icke-klassisk kongenital adrenal hyperplasi (NCAH) utesluts. Man ska heller inte glömma att exogent tillförda androgener, anabola steroider, kan vara orsaken.
Övervikt förvärrar insulinresistensen och hyperandrogenismen och kan vara den faktor som gör att kvinnan får kliniska symtom. Prevalensen av övervikt vid PCOS varierar beroende på den totala prevalensen, och den är högre i USA än i Europa. Flera europeiska studier har visat ett medel-BMI på 28–29 i PCOS-populationen, och vid diagnos var 40–50 procent av kvinnorna överviktiga [3, 6]. I linje med Rotterdamkonferensen rekommenderar Svensk förening för obstetrik och gynekologi (SFOG) oral glukosbelastning vid BMI ≥27 och/eller riskfaktorer för typ 2-diabetes och hjärt–kärlsjukdom [3, 4].
Risken för nedsatt glukostolerans och typ 2-diabetes är ökad [8-10]. PCOS verkar medföra en snabbare övergång från nedsatt glukostolerans till manifest diabetes. För diagnostik rekommenderas oral glukosbelastning hellre än fasteglukos [8]. Prevalensen av typ 2-diabetes stiger med åldern och samvarierar med övervikt, precis som hos den övriga befolkningen. Den var 7,5 procent hos 254 PCOS-kvinnor i åldern 14–44 år i en studie [8] och 10 procent i en kohort om 122 kvinnor ≤30 år [9]. Detta motsvarar 3–7 gånger ökad risk jämfört med en åldersmatchad befolkning [8].
Mycket har skrivits om PCOS och hjärt–kärlrisken. Förekomsten av obesitas, diabetes, bålfetma, sömnapné, dyslipidemi, hypertoni och förhöjda inflammationsparametrar premenopausalt är ökad [6] – alla kända riskfaktorer för hjärt–kärlsjukdom. Utifrån förekomsten av riskfaktorer estimerades i en studie från 1992 risken för hjärtinfarkt hos en grupp PCOS-kvinnor till sju gånger högre än hos en åldersmatchad kontrollgrupp [11]. Senare studier har visat att risken var överskattad. Enligt den evidens vi har tillgång till i dag finns ingen signifikant ökad morbiditet eller mortalitet i hjärt–kärlsjukdom vid PCOS [12].
Ett samband mellan PCOS och endometriecancer föreslogs redan 1949. Den mekanism man diskuterade var långvarig östrogenstimulering utan progesteron, som leder till en hyperplasi av slemhinnan. Det finns inga stora prospektiva studier, men det finns flera kohort- och retrospektiva fall–kontrollstudier som fastslår en ökad risk. I en långtidsuppföljning av 786 PCOS-patienter fann man en femfaldig ökning [13], och i två fall–kontrollstudier fann man ökad förekomst av PCOS hos premenopausala kvinnor med endometriecancer [14, 15].
För att undvika endometriehyperplasi rekommenderas inducerade regelbundna bortfallsblödningar [3, 6, 16] genom cykliskt gestagen eller p-piller. Randomiserade, kontrollerade alternativt stora prospektiva studier för att fastställa att man med denna handläggning minskar cancerrisken finns inte. Det man vet säkert är att övervikt, diabetes och nulliparitet ökar risken för endometriecancer [17].
PCOS är ett syndrom, och de kliniska symtomen varierar. Man kan grovt dela upp fenotypen i klassisk anovulatorisk och ovulatorisk PCOS. Den klassiska anovulatoriska är den allvarligare formen med mer insulinresistens, högre testosteronnivåer och ökad risk för metabola syndromet [2, 6].
Utredning
Diagnosen PCOS ställs i dag oftast av gynekolog. Det finns inget som hindrar att andra specialiteter utreder och remitterar för gynekologisk undersökning. Vilka blodprov/undersökningar som är indicerade varierar beroende på klinisk bild.
Testosteron och SHBG ska kontrolleras och kvoten totalt testosteron/SHBG, som ger fritt androgenindex (FAI), bedömas. Testosteronanalysen är laboratorieberoende, och gränsen för patologiskt förhöjt FAI varierar därför mellan 0,05 och 0,1. I praktiken talar ett sänkt SHBG för PCOS. De hyperandrogena tillstånden Cushings syndrom, icke-klassisk kongenital adrenal hyperplasi (NCAH) och androgenproducerande tumör ska övervägas och uteslutas om de misstänks. Vid amenorré/oligomenorré ska follikelstimulerande hormon (FSH), tyreoideastimulerande hormon (TSH) och prolaktin i serum kontrolleras. Sköldkörtelrubbning eller hyperprolaktinemi utesluter dock inte samtidig förekomst av PCOS. Ovulation säkerställs med ägglossningsstickor eller genom att mäta S-progesteron i lutealfas. Anovulation kan förekomma trots återkommande blödningar.
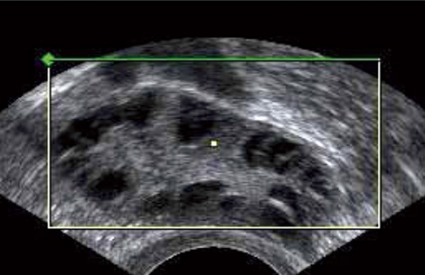
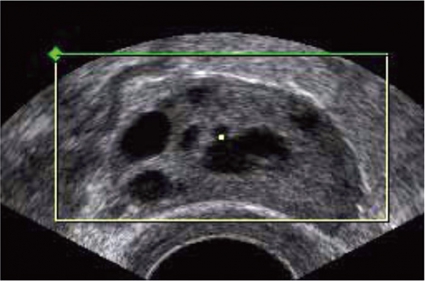
Äggstockarnas utseende bedöms med vaginalt ultraljud. Ett multifollikulärt ovarium med många olikstora folliklar är normalt hos en ung kvinna och ska inte förväxlas med ett polycystiskt ovarium med många likstora antralfolliklar. Kombinerade p-piller kan ofta normalisera ultraljudsbilden. I utredningen ska ingå en värdering av de metabola riskerna, och utgående från denna görs eventuellt oral glukosbelastning.
Behandling
Det finns starkt vetenskapligt underlag för att rekommendera livsstilsförändring till överviktiga PCOS-patienter i syfte att minska risken för typ 2-diabetes och endometriecancer [17, 18]. Vi vet med säkerhet att övervikt påverkar missfallsrisken negativt [22]. En färsk Cochrane-rapport inkluderande sex studier jämförde livsstilsintervention med ingen eller minimal intervention vid PCOS [19]. Man fann att viktnedgång och fysisk aktivitet förbättrade BMI och markörer för insulinresistens. Testosteronnivåerna sänktes också men utan signifikant påverkan på FAI. Ingen studie undersökte fertilitetsutfall eller ovulationsfrekvens. Det har inte visats att viktnedgång ökar antalet levande födda barn, och ytterligare forskning är nödvändig.
Den i dag tillgängliga evidensen talar för att livsstilsintervention hos överviktiga PCOS-kvinnor förbättrar både hälsan på lång sikt och symtomen hirsutism och anovulation på kort sikt. Det är välgrundat att rekommendera viktnedgång hos överviktiga PCOS-patienter och att betona stabil vikt hos normalviktiga. Behandlingen ska individualiseras.
Kombinerade p-piller är den mest använda behandlingen och har god effekt på oligo-/amenorré liksom på akne och hirsutism. Man bör välja ett preparat från tredje eller fjärde generationens p-piller. P-pillrens negativa metabola aspekter vad gäller insulinresistens och blodfetter har diskuterats, och det finns hypoteser om att de är mindre lämpliga för just PCOS-patienter [6]. Fjärde generationens p-piller med drospirenon/etinylöstradiol har visat sig ha mindre negativ påverkan på lipidprofilen och god antiandrogen effekt. Cyproteron, ett antiandrogent gestagenderivat, finns i låg dos i preparatet Diane, i praktiken ett p-piller men registrerat med indikationen akne.
Cyproteron i högre doser än vad som finns i Diane kombinerat med p-piller blir nästa steg i behandlingen mot hirsutism, vilket kräver kontroll av levervärden. Därefter övervägs spironolakton, finasterid eller det nyligen registrerade eflornitin [3, 6]. Observera att alla antiandrogena preparat är kontraindicerade under graviditet. Behandling av hirsutism kräver tid, och farmakologisk behandling behöver ofta kompletteras med hårborttagning.
I USA finns en stark tradition av att använda metformin vid PCOS även utan manifest diabetes, vilket är ovanligt i Skandinavien. En Cochrane-rapport jämförde kombinerade p-piller och metformin avseende effekt på akne, hirsutism och utveckling av diabetes typ 2. Man fann att p-piller var bättre än metformin vad gäller blödningskontroll och testosteronsänkning. Metformin, däremot, påverkade hyperinsulinemin i positiv riktning och ökade inte nivån av S-triglycerider. Inga skillnader fanns mellan p-piller och metformin avseende akne, hirsutism och diabetes. I rapporten ingick fyra randomiserade, kontrollerade studier med totalt 104 patienter [20]. Man hade också för avsikt att jämföra p-piller och metformin beträffande risken för/skyddet mot hjärt–kärlsjukdom och endometriecancer men hittade inga randomiserade studier att inkludera. Kunskapsunderlaget är alltså begränsat, och fler prospektiva, helst randomiserade, studier behövs.
Klomifencitrat är förstahandsalternativet vid ovulationsstimulering. Risken för flerbörd ökar och kan minimeras med ultraljudsövervakning. Klomifencitrat kräver inte remiss till reproduktionsmedicinsk enhet utan kan hanteras av öppenvårdsgynekolog. En viss andel av patienterna svarar inte på klomifencitrat (klomifenresistens). Man kan då lägga till metformin eller gå vidare till gonadotropinstimulering i lågdos. Letrozol, en aromatashämmare registrerad för bröstcancerbehandling, har använts i Norge och ges peroralt [21].
Punktvis diatermi (ovarian drilling) är en behandling mot anovulation där man laparoskopiskt diatermerar på ovariet. Effekten är jämförbar med den av klomifencitrat men med lägre risk för flerbörd [6]. Positiva långtidseffekter med kvarstående ovulationer under ett flertal år och normaliserad hormonbild har visats i små material [22]. Den ökade risken för adherenser och eventuellt försämrad ovarialreserv måste beaktas. Ovariell diatermi används sällan i Sverige.
Det finns få långtidsuppföljningar av kvinnor med PCOS, och vi vet inte om farmakologisk långtidsbehandling med metformin, andra insulinkänslighetshöjande preparat eller aromatashämmare kan minska förekomsten av övervikt och diabetes typ 2.
PCOS och graviditet
Kvinnor med PCOS väger mer än kvinnor som inte har PCOS. Detta ökar risken för missfall. Vid ett BMI ≥30 ökade den relativa risken med 25 procent [23]. Om PCOS i sig ökar risken för missfall är inte visat, men det finns studier som antyder det [24, 25]. En metaanalys fann inte stöd för att behandling med prekonceptionellt metformin minskade missfallsfrekvensen [26].
PCOS-patienter blir oftare än andra gravida genom ovulationsstimulering och assisterad befruktning, som innebär ökad risk för flerbörd. Flerbörd är en obstetrisk riskfaktor som i sin tur ökar förekomsten av preeklampsi, graviditetsdiabetes och hypertoni. Även övervikt är en obstetrisk risk.
Insulinresistens är ju en nyckelfaktor i PCOS-syndromet, och graviditet i sig innebär ökad insulinresistens. Hypotesen att gravida med PCOS genom denna dubbla mekanism har ökad förekomst av graviditetsdiabetes har undersökts. En statistiskt signifikant riskökning för PCOS-gruppen efter justering för BMI erhölls i två metaanalyser [27, 28]. Författarna reserverar sig dock för att dra för långtgående slutsatser av resultaten på grund av de ingående studiernas heterogenitet. Flera studier har undersökt metformins eventuella förebyggande effekt avseende graviditetsdiabetes, men inte heller här finns några evidensbaserade rekommendationer [27].
I Sverige har vi en väl utbyggd mödravård och det finns i dag inte evidens för att PCOS-patienter ska följas på annat sätt än andra under graviditet.
Hälsovinster
Man kan fråga sig varför PCOS finns, en fenotyp med inbyggd subfertilitet/infertilitet. Mycket pekar på att PCOS också kan innebära fördelar. En tydlig effekt av den hyperandrogena konstitutionen är att dessa kvinnor har lättare att bygga muskler och lämpar sig väl för idrott [28]. De har också ökad bentäthet [30], men om det innebär minskad risk för osteoporos och frakturer är inte undersökt.
Det finns tecken på att kvinnor med PCOS har bättre ovarialreserv [31], längre fertil period och senare menopaus [11, 32]. Vilken eller vilka faktorer som förklarar paradoxen med utbredda riskfaktorer, men frånvaro av utbredd sjuklighet i hjärt–kärlsjukdom, vet man inte.
Man tror att PCOS kan ha varit en fördel i jägar–samlarsamhället [33]. Kvinnorna blev gravida med glesa intervall, vilket sannolikt minskade dödligheten hos deras avkomma, de var muskulösa och hade en energisparande konstitution som lätt gick upp i vikt vid positiv energibalans: en fördel under perioder av varierande tillgång på föda men en nackdel i vårt moderna samhälle.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.