Sammanfattat
Hereditärt angioödem är en sällsynt sjukdom med trolig prevalens kring 1/50 000.
Orsaken är mutationer i kromosom 11 med nedsatt mängd eller funktion av C1-esterasinhibitorn, medan 20–30 procent är nymutationer.
Kliniken kännetecknas av smärtsamma, djupa svullnader: abdominellt, perifert, i ansiktet och även i larynx, med risk för kvävning.
Sjukdomen diagnostiseras ofta sent, och många patienter felbehandlas därför under lång tid, med risk för död.
Plötsligt intresse har på senare år visats för sjukdomen. Tidigare var behandlingsmöjligheterna få, och sjukdomen har inte tilldragit sig något större intresse från sjukvård eller industri.
Nya behandlingsalternativ finns nu för denna sjukdom, som obehandlad har hög mortalitet. Tidigare behandling med androgener har svåra biverkningar.
Vi presenterar den nyaste informationen om diagnostik och behandling.
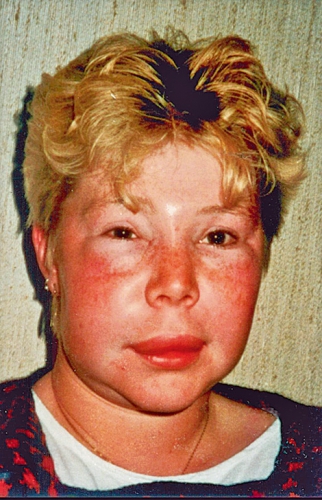
Hereditärt angioödem är en sjukdom med anfallsvisa svullnader. Svullnaderna varar ofta två till fem dagar och kan föregås av ett retikulärt erytem som sällan kliar (Figur 1). Svullnaderna orsakas av ökad produktion av bradykinin på grund av för låg mängd fungerande C1-inhibitor. Det ger kapillärläckage av plasma ut i alla delar av kroppen (Figur 2 och 3). De tydligaste svullnaderna är i huden, särskilt i ansiktet. Det mest smärtsamma är ödem i mag–tarmkanalen och det farligaste är larynxödem.
De första beskrivningarna av hereditärt angioödem finner vi sannolikt i arbeten av Robert Graves i Dublin 1843 [1, 2]. Heinrich Quincke ansåg att ödemen medierades av nervsystemet och kallade ödemet angioneurotiskt [3]. William Osler visade att hereditärt angioödem var ärftligt [4]. Virginia Donaldson fann att vid hereditärt angioödem saknades C1-inhibitorproteinet [5].
Utlösande orsaker och symtom
Många patienter med hereditärt angioödem märker att mental stress utlöser och ökar frekvensen av anfall [6]. Intag av östrogeninnehållande preventivmedel ger anfall hos i det närmaste alla kvinnor med hereditärt angioödem och är för många orsak till att sjukdomen demaskeras. Även östrogensubstitution i menopausen förvärrar anfallen [6, 7]. De få patienter med hereditärt angioödem som har tagit ACE-hämmare har fått svåra anfall eftersom preparaten ökar bradykininkoncentrationen. Infektioner utlöser anfall hos många. Trauma, som operationer, slag eller nötning, ger lätt svullnader. Detsamma gäller tandextraktioner, som för många är mentalt stressande och samtidigt ett trauma i ett område som lätt får ödem [8].
Typiskt för hereditärt angioödem är emellertid den stora variationen av symtom och av vad som utlöser anfallen. Det gäller inte bara mellan olika patienter utan också hos den enskilde i olika faser av livet (Fakta 1).
Patofysiologi
C1-inhibitorproteinet består av 478 aminosyror och verkar genom att binda sig kovalent till proteaser via sitt reaktiva ställe. De viktigaste proteaserna vid hereditärt angioödem är kallikrein och faktor XII. C1-inhibitorn hämmar också de klassiska komplementfaktorerna C1r och C1s, därav namnet.
Vidare hämmas proteaser i lektinaktiveringsvägen i komplementsystemet och i mindre grad faktor XI, plasmin och vävnadsplasminogenaktivatorn [7].
Mutationer i C1-inhibitorgenen på en av de två kromosomerna 11 får till följd att det bildas hälften så mycket av C1-inhibitor. Sjukdomen ärvs autosomalt dominant. Den halva mängden C1-inhibitor är troligen inte nog för att hindra autoaktivering av komplement- och kallikrein–kininsystemen, även utan pågående anfall. Detta kan förklara varför både funktionen och mängden av C1-inhibitor ofta är under 30 procent hos patienter med hereditärt angioödem. Hos ungefär en av tio familjer med hereditärt angioödem är mutationen belägen på den delen av genen som kodar för aminosyror runt platserna 444 (hereditärt angioödem typ II). Därmed bildas det ett muterat C1-inhibitorprotein som inte klarar av att utveckla kovalenta bindningar till proteaserna. Om C1-inhibitorn då kvantifieras med immunologiska tekniker fås normala eller förhöjda C1-inhibitorproteinvärden, troligen beroende på att det muterade C1-inhibitorproteinet inte bildar komplex med proteaserna. Därmed blir det inte avlägsnat från cirkulationen, som det normala C1-inhibitorproteinet gör, utan kan finnas i ökad mängd. Funktionstest visar emellertid värden under 30 procent även hos individer med hereditärt angioödem typ II.
Den reducerade mängden C1-inhibitor vid hereditärt angioödem är otillräcklig för att hämma kallikrein, faktor XII och dessa två enzymers ömsesidiga aktivering. Kallikrein spjälkar därför snabbare av den nio aminosyror långa peptiden bradykinin från högmolekylärt kininogen [9]. Patienter med hereditärt angioödem i remission har högre bradykininnivå än normalt, och nivån ökar ytterligare under anfall [10]. Specifika bradykininblockerare reverserar troligen också sjukdomen lika effektivt som exogen tillförsel av C1-inhibitor [11]. Det saknas dock randomiserade jämförande studier, och alla de studier som gjorts på enskilda preparat har haft olika effektmått. Man har inte funnit andra mediatorer av ödemet. Komplementaktiveringen och de kroniskt nedsatta nivåerna av C4 och troligen av C2 disponerar emellertid för autoimmuna sjukdomar, som tycks vara vanligare vid hereditärt angioödem. Patienterna har kliniskt inte nedsatt immunförsvar eller förändrad koagulation eller fibrinolys.
Bradykinin och dess metaboliter binder sig till två receptorer, kallade B1 och B2. B2-receptorn antas vara viktigast och finns särskilt på endotelcellerna. Bradykinin bryts snabbt ner av en rad peptidaser, varav angiotensinkonverterande enzym (ACE) är viktigast [12]. Plasma läcker ut ur kapillärerna mellan endotelcellerna, som tränger ihop sig.
Östrogen ökar mängden av faktor XII och kallikrein [13]. B2-receptorn uppregleras av bl a östrogen [12], varvid aktiviteten av ACE och aminopeptidas-P, som båda bryter ner bradykinin, reduceras [7]. ACE-hämmare bromsar även nedbrytningen av bradykinin och kan utlösa allvarliga anfall [14]. Det är mer osäkert varför mental stress utlöser anfall, men mental stress i sig själv aktiverar fibrinolysen [15]. Plasmin kan aktivera kallikrein–kininsystemet och frisätta bradykinin. Trauma aktiverar faktor XII och kan öka heat-shock-protein 90, som aktiverar kallikrein i endotelcellernas cytoplasma [7]. Infektioner och trauman kan uppreglera B1-receptorn och, i den mån det är viktigt, främja ödemutvecklingen [12].
Det finns ingen samlande förklaring till de stora skillnaderna i symtom vid hereditärt angioödem. Emellertid kan man tänka sig att polymorfier eller mutationer i alla de enzymer som bestämmer koncentrationen av bradykinin och i de receptorer som förmedlar effekten av bradykinin resulterar i olika symtombilder.
Klinisk diagnostik
Den kliniska diagnostiken kännetecknas ofta av lång tid mellan symtomdebut och diagnos. Genomsnittstiden vid diagnos var 16,3 år i en stor dansk studie [16]. Insjuknandet kan ske när som helst under livet men vanligen före vuxen ålder (Figur 4). Hereditärt angioödem kan också uppstå som ny mutation, som nedärvs vidare. Man uppskattar att i dagsläget utgör patienter med dessa de novo-mutationer ca 20–30 procent av den totala populationen av patienter med hereditärt angioödem och har således inte någon anamnes i familjen [17, 18].
Diagnosen hereditärt angioödem bör misstänkas om patienten har symtom (Fakta 1) och om dessa utlöses av stress, både psykisk och somatisk, inflammationer, infektioner och trauma samt östrogener, både egna och tillförda. Därför debuterar sjukdomen i vissa fall i samband med menstruationsstart, p-pilleranvändning eller graviditet. Diagnosen bör också misstänkas om patienten erhållit sedvanlig behandling för akut allergiskt eller idiopatiskt angioödem med adrenalin, antihistamin och glukokortikoider men svarat otillfredsställande.
Differentialdiagnoser är framför allt histaminerga angioödem, oftast med urtikaria, och angioödem som beror på höga bradykininnivåer orsakade av t ex ACE-hämmare. Dessa anfall liknar dem vid hereditärt angioödem men är oftast mer koncentrerade till ansiktet, särskilt läppar och tunga. Det är sällan som andra angioödem än hereditära ger buksmärta och ödem på extremiteter. På senare år har man noterat ärftligt angioödem trots normala C4- och C1-inhibitorvärden. I vissa fall har man konstaterat mutationer i faktor XII vid en variant som kallas hereditärt angioödem typ III eller hereditärt angioödem med normala nivåer av CI-inhibitor [19].
Laboratoriediagnostik
Laboratoriediagnostiken är enkel. Ett serumprov, minst 2 ml för vuxna och 150 µl för barn samt EDTA-plasma 0,5 ml respektive 100 µl, sänds till något av referenslaboratorierna i Köpenhamn, Oslo, Lund eller Uppsala, som alla analyserar såväl sänkt totalnivå av som funktionell brist på C1-inhibitor vid hereditärt angioödem typ I och II. Man får vara uppmärksam på att patienten inte behandlas med östrogen vid provtagningen då detta kan ge ett falskt lågt värde [20]. C4 är nästan alltid lågt hos individer med hereditärt angioödem även då inget anfall föreligger. Diagnostiken hos nyfödda är svårare, bl a på grund av andra referensområden för C1-inhibitor [21].
I akutläget, dvs under pågående anfall, kan man ha god ledning av komplementfaktor C4, som analyseras på flertalet sjukhuslaboratorier, även akut. Ett normalt C4 under pågående anfall utesluter med stor sannolikhet hereditärt angioödem som orsak till besvären [22].
Behandling och profylax
Behandling av hereditärt angioödem innefattar akut behandling av anfall, förebyggande behandling och korttidsförebyggande behandling inför särskilda risksituationer eller exponering för provocerande faktorer (Tabell I). Långtidsbehandling ges till patienter med täta och/eller allvarliga anfall [7, 23]. Valet av potentiellt livslång profylaktisk behandling avgörs också av möjligheten till behandling av akuta anfall och görs gemensamt av patient och läkare.
Varje patient med hereditärt angioödem ska informeras om potentiellt utlösande faktorer, såsom trauma, stress och vissa
typer av läkemedel, som ACE-hämmare och östrogen. Sanering av infektioner, t ex Helicobacter pylori, kan minska anfallens frekvens och svårighetsgrad [24].
Antifibrinolytika används för profylax mot och behandling av anfall för de få patienter som svarar på behandlingen [7, 25-28]. Tranexamsyra föredras, eftersom substansen har den bästa profilen vad gäller effekt och biverkningar. Tranexamsyra bör inte användas vid aktiv trombotisk sjukdom. Patienter som får långtidsbehandling med tranexamsyra bör ha genomgått trombofiliscreening.
Vi rekommenderar kontroll av leverstatus, kreatinin och kreatininkinas (CK) var sjätte månad. Vid ögonproblem bör patienten hänvisas akut till ögonläkare. Vissa rekommenderar årlig kontroll hos ögonläkare [23].
Anabola steroider eller androgener. Danazol, stanozolol och oxandrolon är syntetiska 17-α-alkylerade androgener, som är mindre viriliserande och har färre biverkningar än metyltestosteron [7, 23, 25]. De kan kontrollera sjukdomen hos ca 90 procent av patienterna. I en retrospektiv undersökning av 118 långtidsbehandlade patienter med hereditärt angioödem i Danmark och Tyskland visade 111 danazolbehandlade behandlingsrespons, och 54 (46 procent) blev symtomfria eller hade <1 anfall om året [26]. Androgener verkar bl a genom att öka syntesen av C1-inhibitor i levern, och vid tillräckligt hög dosering kan anabola steroider normalisera nivåerna av C1-inhibitor och C4 [27, 28]. En annan nyligen beskriven verkningsmekanism för androgener är ökad aktivitet av plasmaaminopeptidas P (APP), vilket leder till bättre nedbrytning av den aktiva bradykininmetaboliten des-Arg9-bradykinin [29]. Androgener får inte ges vid betydligt nedsatt lever-, njur- eller hjärtfunktion [30]. Behandlingen bör inte heller ges till patienter med prostatacancer. Androgener bör enbart användas till barn på tvingande indikation och i samarbete med barnläkare [7, 31, 32]. Vi rekommenderar ultraljudsskanning av levern före behandlingsstart, årlig kontrollskanning [23] samt kontroll av blod- och leverstatus, CK, kreatinin, lipider, blodsocker, tyreoideastimulerande hormon (TSH) var sjätte månad tillsammans med kontroll av blodtryck och vikt. Hos män som långtidsbehandlas bör prostataspecififkt androgen (PSA) kontrolleras årligen.C1-inhibitorkoncentrat. I vissa svåra fall har C1-inhibitor givits som långtidsprofylax [33].Behandling vid akuta anfall Effekten av C1-inhibitorkoncentrat för behandling av anfall är dokumenterad i tre av fyra dubbelblindade, placebokontrollerade studier [33-37].Koncentrat av plasmaderiverad C1-inhibitor har använts sedan 1973. Behandlingseffekt kan inträda redan efter tio minuter, och maximal behandlingseffekt ses efter omkring en timme. Ett av preparaten var verksamt i alla 193 behandlade fall av larynxödem [38]. Koncentraten administreras intravenöst, och preparaten är funktionellt aktiva in vivo omkring två dygn. Preparaten administreras vanligtvis på närmsta sjukhus, men utvalda patienter med frekventa anfall kan utbildas i att själva injicera [39]. Innan behandling med C1-inhibitorkoncentrat startas rekommenderas screening för hepatit och HIV samt kontroll av leverstatus. Dessa parametrar följs årligen om patienten behandlas med C1-inhibitorkoncentrat och serum sparas i bank [23].Konestatalfa är ett rekombinant humant C1-inhibitorkoncentrat som har visat lovande resultat [40-45]. Läkemedlet utvinns ur kaninmjölk och administreras intravenöst. Rekombinant C1-inhibitorkoncentrat är kraftigare glykosylerat än plasmaderiverad C1-inhibitor från människa, vilket betyder att halveringstiden är kortare och att dosen behöver vara högre. Preparatet är ännu godkänt bara för vuxna och får inte användas till patienter som är allergiska för kanin. Behandlade patienter bör följas regelbundet för att upptäcka eventuell allergiutveckling.Ikatibant är en selektiv bradykinin-2-receptorantagonist (BK2-R) med liknande struktur som bradykinin. Produkten blev godkänd av europeiska läkemedelsmyndigheten EMA år 2008, och effekten på akuta anfall är dokumenterad i kliniska kontrollerade prövninger och öppna studier [11, 40, 42, 46-50]. 2011 blev ikatibant godkänt för egenbehandling. Preparatet är ännu godkänt bara för vuxna med hereditärt angioödem. Ikatibant får inte användas veckorna efter apoplexi. Försiktighet bör iakttas vid akut ischemisk hjärtsjukdom.Nödmedicin Alla patienter bör ha läkemedel hemma för att vid behov kunna söka hjälp på närmsta sjukvårdsenhet eller behandla sig i hemmet själva eller med hjälp av närstående. I avsaknad av C1-inhibitorkoncentrat eller ikatibant kan färskfrusen plasma som innehåller C1-inhibitor i undantagsfall användas vid behandling av anfall. Behandlingen är kontroversiell eftersom färskfrusen plasma kan tillföra andra komplementfaktorer och kininer, såsom kallikrein och högmolekylärt kininogen, som kan förvärra angioödemet [51, 52]. Vidare finns risk för överföring av blodburna infektioner och hypersensitivitetsreaktioner [7, 53].Nytt behandlingsalternativ Ekallantid (Kalbitor) är ett 60 aminosyror långt protein som produceras i svampen Pichia pastoris. Ekallantid blockerar kallikrein med stor affinitet och specificitet, varvid produktionen av bradykinin nedsätts [54-59]. Ekallantid administreras subkutant, effekten är dokumenterad i kliniska studier och preparatet har marknadsförts i USA [60]. Preparatet har dock på grund av anafylaxiliknande reaktioner fått en s k black box warning, dvs en typ av varning med svart kant som Food and Drug Administration (FDA) i USA kräver på bipacksedeln för receptbelagda läkemedel som kan ge allvarliga biverkningar. * Potentiella bindningar eller jävsförhållanden: Janne Björkander har utfört konsultuppdrag för CSL Behring, Jerini, Shire, Sobi och Viropharma samt kliniska prövningar för CSL Behring och Jerini. Anette Bygum har deltagit i kliniska prövningar och utbildningar och kongresser med CSL Behring, Jerini/Shire och Viropharma. Erik Waage Nielsen har mottagit kongressresebidrag och C1-inhibitorkoncentrat samt bradykinblockeraren ikatibant till forskningsprojekt från Aventis Behring, Shire, Biovitrum och Sanquin.