Sammanfattat
Metabolismen och utsöndringen av testosteron skiljer sig på grund av genetiska faktorer 100–1000-faldigt mellan olika individer.
Populationsstudier har visat en bimodal fördelning av dessa egenskaper; en grupp med långsam och en med snabb metabolism och utsöndring i urin.
Fördelningen av »långsamma» och »snabba« individer skiljer sig mellan västerlänningar (9 respektive 91 procent) och asiater (67 respektive 25 procent).
I dopningstest för testosteron tillämpas i dag ett enda gränsvärde för misstanke om testosteronintag trots den stora genetiska och interetniska variationen.
Införande av genetisk analys (genotypning) skulle öka dopningstestens precision och undvika onödiga och dyrbara extraanalyser.
Ett av de största problemen vid läkemedelsbehandling är den stora genetiska variationen i omsättning och effekter av läkemedel, vilket innebär krav på en individualiserad dosanpassad behandling. Senare tids forskning har avslöjat lika stora genetiska variationer i förmågan att omsätta androgena steroider, till exempel testosteron och flera av dess försteg och metaboliter. Variationen ses både i den endogena androgenomsättningen och när androgenerna ges terapeutiskt eller i dopningssyfte.
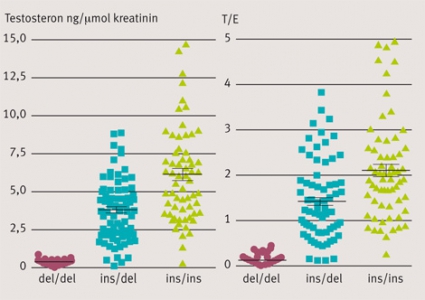
Urinutsöndringen av testosteron varierar 100–1000-faldigt både inom och mellan etniska grupper [1]. I en studie av koreaner, som är representativa för asiatiska folk, och svenska (västerländska) försökspersoner visade vi att utsöndringen var i medeltal 5 gånger (median 16 gånger) högre hos svenskarna. Utsöndringsmönstret i bägge grupperna var bimodalt, det vill säga en del av befolkningen utsöndrar mycket testosteron, medan den andra delen bara utsöndrar små eller omätbara mängder. Märkligt nog tillhörde 74 procent av asiaterna men endast 6,6 procent av västerlänningarna gruppen med liten utsöndring av testosteron. Vi kunde knyta det bimodala mönstret till en mutation i UGT2B17-enzymet som konjugerar testosteron och är en förutsättning för dess utsöndring. Genen är helt deleterad (del/del-genotyp) hos individer med låg utsöndring av testosteron. Individer med en allel (ins/del-genotyp) eller två alleler (ins/ins-genotyp) har en måttlig respektive stor utsöndring av testosteron. »Ins« betecknar i detta sammanhang insertion, det vill säga allelen finns inkluderad i genomet. Resultatet blir att kvoten testosteron/epitestosteron (T/E-kvoten), som mäts för att påvisa testosterondopning, påverkas på samma sätt (Figur 1) eftersom utsöndringen av epitestosteron är opåverkad av UGT-genotypen. Epitestosteron konjugeras av ett annat enzym, UGT2B7 [2]. Figur 1 ger ett tydligt exempel på en så kallad gen–doseffekt, det vill säga ingen, en eller två alleler ger en stegvis höjning av T/E-kvoten.
Andra gener har också visat sig ha en funktionell genetisk variation som påverkar utsöndringen av testosteron i urinen. Det gäller till exempel cytokrom P450 17 (CYP17) som katalyserar vissa försteg i testosteronsynteskedjan, samt fosfodiesteras 7B (PDE7B) som spjälkar testosteronenantat, som används i läkemedelsberedningarna. Genetiska varianter av PDE7B påverkar hastigheten och graden av testosteronstegringen i blod och utsöndringen i urin, se nedan [3].
Genetiska fördelar ur effektsynpunkt
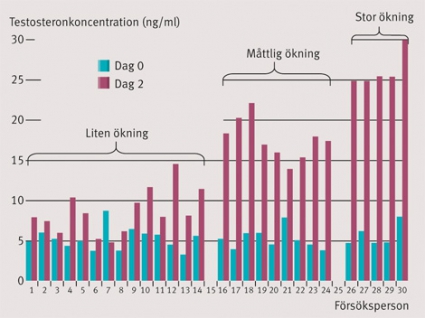
Kan genetiken påverka i vilken utsträckning man tillgodogör sig testosteronet? Serumkoncentrationen av testosteron förutsätts vara relaterad till effekterna av hormonet vid normal känslighet för androgener. Om man ger samma dos testosteronenantat till ett antal individer stiger koncentrationen av testosteron olika mycket (Figur 2), även efter korrektion för kroppsvikten. Med hjälp av en genomassociationsstudie (genome wide association study, GWAS) jämförde vi två grupper individer; en med liten och en med stor stegring av testosteronkoncentrationen. Resultatet visade ett antal träffar som pekade på att fosfodiesteraser kunde förklara en del av skillnaderna. Därför är det sannolikt att effekten av en given dos av testosteron är större hos individer med en genetisk variant som ger hög aktivitet i PDE7B [3]. Vi har också identifierat en polymorfi i ett transportprotein (SLCO2B1) som ser ut att förklara 20 procent av variationen i serumkoncentration (opublicerade resultat).
Effekten av testosteron hos olika genotyper av UGT2B17 skiljer sig sannolikt inte åt eftersom serumkoncentrationerna är lika. Vi studerar för närvarande androgeneffekten med hjälp av en androgenreceptor-assay [4]. I metoden mäts den totala androgena effekten av föreningar som har en androgen effekt, vare sig de är kända eller okända, mätbara eller omätbara. Androgenreceptorn är »inbyggd« i en jästsvamp som ger luminiscens när den exponeras för androgena ämnen i till exempel serum eller urin. Luminiscensens intensitet är relaterad till den androgena effekten i provet. I serum ökar androgenreceptoreffekten efter en enkeldos av testosteron i ett par veckors tid och är fortfarande förhöjd 14 dagar efter dosen givits. Serumprofilen av androgeneffekten mätt med androgenreceptormetoden var oberoende av vilken UGT2B17-genotyp som individen tillhörde (opublicerade resultat).
Den genetiska variationens betydelse för dopningstest
Testosteron är ett av de vanligaste dopningsmedlen bland androgener enligt WADA (World Anti-Doping Agency) 2010 (Adverse analytical findings and atypical findings reported by accredited laboratories
I det internationellt använda dopningstestet för testosteron (T) mäts både testosteron och epitestosteron (E), som är en isomer av testosteron vars utsöndring sjunker vid testosterondopning. T/E-kvoter som överstiger värdet 4 inger misstanke om intag av testosteron. Proven går då vidare till så kallad isotopkvotsmasspektrometri (IRMS-analys). Metoden bygger på att syntetiskt testosteron har ett annat innehåll av 13C-isotopen än endogent testosteron, varför kvoten mellan 13C och 14C påverkas av intag av testosteron.
Tillämpningen av ett och samma T/E-värde för misstänkt dopning innebär, vilket vi visat, att ungefär var 10:e individ som har en funktionell UGT-gen blir »positiv« utan att ha tagit testosteron (falskt positiva). På motsvarande sätt missar testet cirka 40 procent av de individer som saknar genen trots att de tagit testosteron (falskt negativa) [5].
Om man tar hänsyn till den genetiska variationen i testosteronutsöndring inom och mellan etniska grupper och de olika allelfrekvenserna i populationerna kommer summan av falskt negativa och falskt positiva svar att uppgå till cirka 11 procent hos västerlänningar och 31 procent hos asiater. Visserligen kommer alla misstänkta prov att gå vidare för analys med IRMS, men denna analys är mycket dyrbar och försenar också det slutliga svaret. Dessutom har nya studier visat att flera av de testosteronberedningar som finns på marknaden inte detekteras med IRMS [6].
T/E-testet bygger således på ett populationsbaserat gränsvärde som gäller globalt och ingår i WADA:s rekommendationer. Med de nya kunskaperna om stora genetiska variationer skulle information om individens deletionspolymorfi i UGT-genen göra dopningskontrollen mer effektiv, billigare och snabbare eftersom ett stort antal IRMS-analyser skulle kunna undvikas. Det är sannolikt att man kommer att gå över till en individbaserad bedömning av T/E-kvoten som bygger på information om individens sanna negativa basvärde och en så kallad bayesiansk inferensanalys.
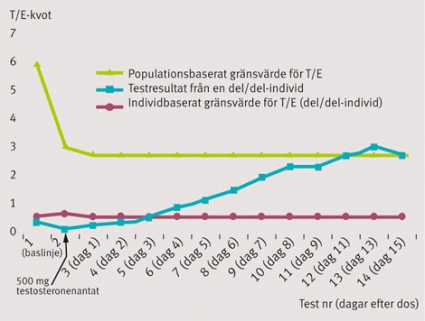
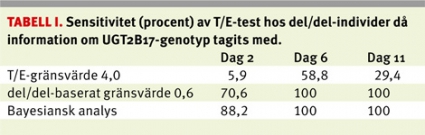
Vi har studerat hur T/E-testets sensitivitet och specificitet påverkas om man i en bayesiansk modell lägger till genetisk information om UGT-polymorfin [7]. 55 försökspersoner som tillhörde de tre genotyperna för UGT-polymorfin, det vill säga ingen, en eller två alleler för genen (del/del, del/ins, ins/ins), fick dosen 500 mg testosteronenantat intramuskulärt. I analysen beräknades det individuella gränsvärdet för misstänkt testosterondopning på basis av dagliga urinanalyser av testosteronglukuronid och T/E-kvot under 15 dagar efter att dosen gavs.
Programmet genererade betydligt lägre gränsvärden för alla del/del-individer. Testets sensitivitet ökade således avsevärt för dessa individer, vilket framgår av Tabell 1. I Figur 3 ses resultaten för en enskild individ som saknar genen (del/del). Om genetisk information kan läggas in i programmet blir individen positiv i T/E-testet redan tre dagar efter en tagen dos. Utan den genetiska informationen blir individen inte avslöjad förrän dag 13 efter att dosen tagits.
För att optimera nyttan och utfallet av T/E-testet bör gränsvärdet anpassas efter individens genetiska UGT-situation. Detta skulle kunna införas oberoende av etnicitet, och leda till avsevärt förbättrad sensitivitet i testet. I Tabell 1 visas hur mycket sensitiviteten påverkas om man i stället för 4,0 för alla individer tillämpar gränsvärdet 0,6 för del/del-individer och 4,0 för övriga.
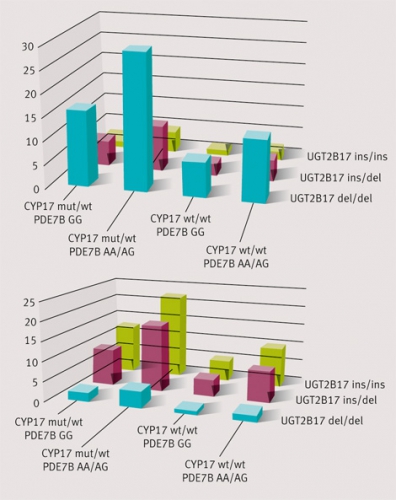
Exemplet med deletionspolymorfin i UGT-genen visar hur stor effekten är på urinutsöndringen av testosteron och därmed även T/E-kvoten. En promotorpolymorfi i CYP17-genen, vars enzym katalyserar 17-hydroxyleringen av pregnenolon och progesteron, påverkar också T/E-kvoten genom en inverkan på utsöndringen av epitestosteron. Även genetisk variation i PDE7B-enzymet påverkar T/E-kvoten genom att testosteronutsöndringen varierar med en av polymorfierna i genen. Vi har studerat hur olika kombinationer av alleler i generna för UGT2B17, PDE7B och CYP17 maximerar respektive minimerar stegringen av T/E-kvoten – och risken för att bli avslöjad – efter en testosterondos [8]. Den kvantitativa betydelsen är störst för UGT2B17-polymorfin, följt av mutationerna i PDE7B- och CYP17-generna. Genkombinationernas frekvens skiljer sig markant mellan den asiatiska och den västerländska befolkningen (Figur 4). De turkos staplarna i främre raden i diagrammen anger frekvensen av de genotypkombinationer som ger minst påverkan på T/E-kvoten av testosteron. Sådana kombinationer är avsevärt vanligare i den asiatiska än i den västerländska populationen, vilket man borde ta hänsyn till i internationella kontrollprogram genom att i tillämpliga situationer införa genotypning.
Det finns sannolikt flera mutationer i enzymgener som direkt eller indirekt styr urinutsöndringen av testosteron. Kunskap om genetiska faktorer som påverkar T/E-kvoten bör beaktas i tolkningen av de resultat som beskrivits. I den bayesianska tolkningsmodellen kan naturligtvis annan genetisk information ingå när den har betydelse för testosteronutsöndringen. Sannolikt skulle sensitiviteten öka ytterligare med sådan information.
Framtida dopningskontroller
T/E-kvoten har använts och rekommenderats i internationell idrott sedan 1980-talet. Det är fortfarande ett primärtest, och bygger på ett globalt populationsbaserat gränsvärde. Senare års forskning har tydligt visat att omsättningen, och möjligen även effekterna, av testosteron och andra androgener är starkt påverkad av genetisk variation i ett antal enzymer som deltar i denna process. Framtida kontrollprogram bör vara individbaserade och ta hänsyn till den nyupptäckta genetiska variationen i omsättningen av androgener.
En rationell tolkning av vetenskapliga resultat och konsekvensanalys stöter dock på patrull när det gäller att införa nya moment i den internationella globala dopningskontrollen, sannolikt beroende på att inställningen till genetiska test varierar av politiska, ekonomiska och religiösa skäl.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.