Sammanfattat
Enterovirusinfektion i nyföddhetsperioden är vanlig och ofta lindrig men kan även ha ett mycket allvarligt förlopp. Enstaka barn utvecklar behandlingsresistent cirkulatorisk chock.
Enda framgångsrika behandlingen för dessa svårast sjuka är mekaniskt hjärtstöd i form av extrakorporeal membranoxygenering (ECMO) eller vänsterkammarstöd (VAD).
Vid behov av akut stöd och vid kombinerad cirkulatorisk och respiratorisk svikt är ECMO ett bra alternativ.
Prognosen kan även i dessa mycket allvarliga fall vara god. Hjärtmuskeln har ofta god återhämtningsförmåga, och transplantation är sällan nödvändig.
Veno-arteriell ECMO vid vänsterkammarsvikt kan försvåra kammarens tömning i systole.
En minimalinvasiv septostomi är ett möjligt och odramatiskt terapialternativ för att avlasta vänsterkammaren vid veno-arteriell ECMO.
Myokardit hos barn orsakas oftast av infektion med influensa- och enterovirus. Sjukdomen har mycket varierande allvarlighetsgrad. Det finns studier som indikerar att 13 procent av nyfödda barn smittas med enterovirus men att majoriteten av dem är helt symtomfria. Av de barn som behöver sjukhusvård utvecklar enstaka behandlingsresistent cirkulatorisk chock [1]. Utan åtgärd är mortaliteten då nära 100 procent. Enda möjliga behandling för dessa mycket sjuka barn är mekaniskt hjärtstöd i form av extrakorporeal membranoxygenering (ECMO) eller vänsterkammarstöd (VAD) [2, 3].
Behandlingen syftar då till att stödja hjärtat till tillfrisknande eller – i de fall då hjärtfunktionen inte återhämtar sig – att utgöra brygga till transplantation.
Rapporterade resultat i patientgruppen skiljer sig mycket i olika studier, men en långtidsöverlevnad på 70 procent, där endast ett fåtal behöver hjärttransplanteras, kan förväntas [4]. De flesta patienter visar alltså god läkningsförmåga. I en långtidsuppföljning av vuxna med fulminant myokardit rapporteras nedsatt men acceptabel fysisk och psykisk livskvalitet [5].
ECMO eller vänsterkammarstöd som behandling
ECMO och vänsterkammarstöd är olika behandlingsmetoder med för- och nackdelar vid behandling av dessa patienter. ECMO-systemet dränerar blodet från höger förmak. Blodet pumpas genom en konstgjord lunga ut i aorta via en kanyl i arteria femoralis. Ett vänsterkammarstöd dränerar blod från vänster kammare och pumpar ut blodet i aortaroten.
Vid ECMO-behandling syresätts således blodet aktivt utanför kroppen, medan behandling med vänsterkammarstöd kräver att patienten själv kan syresätta det venösa blodet via lungorna.
Tidigare har ECMO varit det enda möjliga alternativet för små barn, eftersom utrustning för vänsterkammarstöd saknats i passande storlek. I dag finns utrustning och ökad erfarenhet för bägge alternativen.
I princip är ECMO ett förstahandsalternativ vid akut behov av stöd och vid kombinerad respiratorisk och cirkulatorisk svikt [2, 4]. Nackdelar är behovet av avancerad intensivvård, sängbundenhet och risk för komplikationer som blödning, infektion och koagulationsrubbning. Komplikationsrisken ökar med behandlingstiden [6].
En svårighet vid ECMO och sviktande hjärtfunktion är direkt avlastning av vänster kammare. Ett kontinuerligt ECMO-flöde riktat mot aortaklaffen riskerar att öka kravet på kontraktionskraft för att vänsterkammaren ska tömma sig. En dåligt tömd vänsterkammare med förhöjda fyllnadstryck kan medföra risk för subendokardiell ischemi. Det ökade fyllnadstrycket i kammaren ökar risken för lungödem och försämrat syreupptag i lungan [7-9].
Möjligheter att avlasta vänster kammare finns i form av konvertering till vänsterkammarstöd [4] men också genom att öppna en förmaksshunt via septostomi. Detta kan göras via perkutan teknik och har visats vara effektivt som avlastning för vänster kammare vid ECMO [10]. Septostomin kan i vissa fall möjliggöra förlängd ECMO-behandling utan behov av konvertering till vänsterkammarstöd. För de patienter som har kombinerad hjärt- och lungsvikt är detta sannolikt en fördelaktig terapistrategi.
Vi beskriver här ett fall av mycket grav myokardit hos ett barn som behandlades framgångsrikt med ECMO och perkutan septostomi.
Fallbeskrivning
Patienten var en fullgången pojke som föddes efter en normal graviditet. Han var barn nummer två med ett 2-årigt syskon hemma. Hemgång efter 2 dagar, och han var välmående på eftervårdskontroll vid 4 dagars ålder. Därefter blev han slö och ammade inte tillräckligt.
Han försämrades ytterligare och kom 9 dagar gammal till akutmottagningen efter att inte ha ätit på en hel dag. Väl på akuten blev pojken bradykard och medvetandesänkt. Hans tillstånd stabiliserades med avancerad hjärt–lungräddning och volymtillförsel så att transport till barnsjukhus kunde genomföras.
Vid ankomst till barnsjukhuset visade ekokardiografi nedsatt bakväggskontraktilitet, ejektionsfraktion 20–30 procent, stor mitralisinsufficiens, dilaterat vänster förmak och suprasystemiskt tryck i lilla kretsloppet. Initialt förbättrades patienten på ytterligare volymtillförsel och inotropi. Laktatvärdet sjönk från 27 till 10 mmol/ml (referensvärde 0–2 mmol/ml), och pH steg över 7. Trots behandling nådde inte medelartärtrycket över 30 mm Hg, och tilltagande ventrikulära takyarytmier tillkom.
Patienten uppfyllde då väl kriterier för refraktär cirkulatorisk chock som indikation för mekanisk hjärtstödjande behandling. Veno-arteriell ECMO startades 10 timmar efter ankomsten till akutmottagningen.
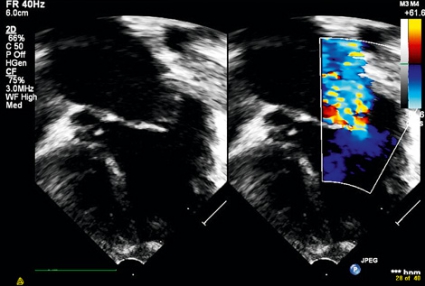
Den kliniska bilden var väl förenlig med myokardit, och serologisk provtagning var positiv för enterovirus. Efter påbörjad ECMO-behandling stabiliserades patientens tillstånd relativt snabbt avseende vitalparametrar, laktat och pH. Ekokardiografi visade fortsatt nedsatt vänsterkammarfunktion, grav funktionell mitralisinsufficiens och förstorat vänster förmak (Figur 1). Som tecken på förhöjda tryck i lungkretsloppet sågs även en stor trikuspidalisinsufficiens och korta accelerationstider för flödet i arteria pulmonalis.
Under första veckan försämrades vänsterkammarfunktionen ytterligare, och aortaklaffen slutade öppna. Både vänster kammare och vänster förmak dilaterades successivt. Det pulmonella trycket ökade med sekundärt tilltagande belastning för höger kammare.
Behandlingen sköttes tvärprofessionellt med ECMO-läkare, barnkardiologer och barntoraxkirurger. Tio dagar efter ankomsten hölls telefonkonferens. Vänsterkammardysfunktion dominerade då bilden. Kammaren uppfattades skadligt belastad, och olika åtgärdsalternativ diskuterades. Alternativet att konvertera till vänsterkammarstöd avslogs, eftersom patienten hade både hjärtsvikt och lungsvikt. För att säkra syresättningen skulle ett vänsterkammarstöd ha behövt kompletteras med ECMO. Det skulle ha medfört toraxkirurgiskt ingrepp, öppen bröstkorg, dubbla system med antikoagulationsterapi och därmed kraftigt ökad blödningsrisk.
I stället beslutades om minimalinvasiv perkutan septostomi. Det höga trycket i vänsterkammare dränerades via mitralisinsufficiensen och septostomin till höger förmak.
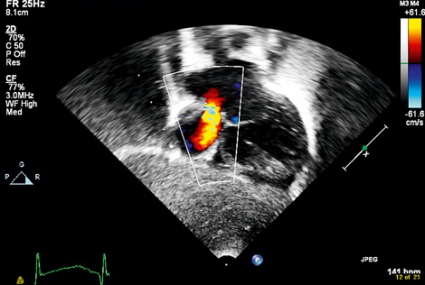
Ekokardiografi dagen efter septostomin visade kraftigt minskad tryckdifferens mellan höger förmak och kammare; detta som tecken på minskad högerkammarbelastning. Vänster förmak återgick snabbt till normalstorlek. Initialt efter septostomin återcirkulerade en stor del av hjärtminutvolymen från vänster förmak till höger förmak (Figur 2). Det veno-arteriella ECMO-flödet upprätthöll systemcirkulationen.
Några dagar efter septostomin visade vänsterkammaren förbättrad funktion, och aortaklaffen började öppna sig med små slagvolymer. Under pågående ekokardiografiundersökning sänktes pumpflödet i ECMO, med ökat flöde över aortaklaffen som följd.
Under de kommande 10 dagarna förbättrades lufthalten och gasväxlingen över lungan. ECMO-flödet kunde successivt sänkas, och efter 26 dagars behandling dekanylerades patienten. Ytterligare 2 dagar senare extuberades pojken framgångsrikt.
Barnet vårdades sedan ytterligare 30 dagar vid kardiologavdelning. Sviktbehandlingen optimerades före utskrivning till hemmet. Ekokardiografi inför hemgång visade god vänsterkammarfunktion men med kvarstående dyskinesi i bakväggen. Högerkammarfunktionen normaliserades. Kvar fanns en liten mitralisinsufficiens; aortaklaffunktionen var normal.
Diskussion
Fallet visar tydligt hur utomordentligt allvarligt enstaka patienter kan drabbas vid viral myokardit. Dessa patienter är extremt vårdkrävande och behöver tillgång till multiprofessionell intensivvård. Om denna vård kan ges, finns gott hopp även för de allra svårast sjuka.
Vid myokardit och akut terapiresistent cirkulatorisk svikt är ECMO ett förstahandsval. ECMO är också ett tilltalande behandlingsalternativ vid kombinerad hjärt- och lungsvikt. ECMO erbjuds vid de sjukhus där man bedriver öppen hjärtkirurgi. Med hjälp av det mobila akutteamet vid ECMO-enheten vid Astrid Lindgrens barnsjukhus, Karolinska universitetssjukhuset, Solna, kan behandlingen erbjudas även vid sjukhus som normalt inte bedriver vård med hjärt–lungmaskin.
Fallet belyser risken för ökad vänsterkammarbelastning vid start av veno-arteriell ECMO. En dilaterad och dysfunktionell vänsterkammare som inte slår ut adekvat ökar vänster förmakstryck och lungperfusionstryck. Dilatationen riskerar att försämra koronarcirkulationen, med subendokardiell ischemi som följd. Förloppet följs bäst med upprepade ultraljudsundersökningar.
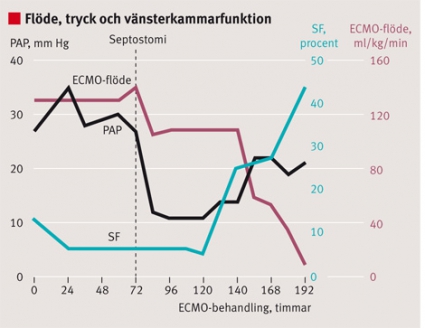
Litteraturen beskriver olika sätt att hantera denna förväntade komplikation [8-10]. I vårt fall med lyckat resultat avlastades kammaren med en kateterburen förmaksseptostomi. Efter åtgärden visade ekokardiografi sjunkande tryck i lilla kretsloppet. Detta är exemplifierat i tidigare litteratur [7] (Figur 3). Gasväxlingen över lungorna förbättrades och vänsterkammarfunktionen återhämtade sig successivt. Fallet belyser därmed återhämtningsförmågan hos myokardiet vid myokardit och stödjer de arbeten som indikerar att transplantation sällan är nödvändig [2-4]. Det finns patienter som har ännu längre återhämtningsfas. För dem som behöver cirkulatoriskt stöd under längre tid är vänsterkammarstöd ett alternativ.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.