Sammanfattat
Endoskopisk submukosadissektion möjliggör en mer omfattande resektion än endoskopisk mukosaresektion av polyper och tidig cancer i kolon och rektum (T1N0).
Härmed kan man undvika att fragmentera stora polyper (>2 cm), vilket är vanligt vid endoskopisk mukosaresektion.
Borttagande av polyper i en bit underlättar patologens radikalitetsbedömning och minskar antalet lokalrecidiv.
Nackdelen är att tekniken är svårare att lära sig och att risken för komplikationer, framför allt tarmperforationer, är högre än vid endoskopisk mukosaresektion.
Endoskopisk submukosadissektion är en lovande minimalinvasiv behandling av stora polyper och tidig cancer i kolon och rektum.
På grund av sin komplexitet bör metoden koncentreras till högspecialiserade endoskopiska centra.
Neoplastiska polyper (adenom) anses vara förstadium till cancer i kolon och rektum. Stjälkade polyper kan enkelt tas bort med endoskopisk polypektomi, då man nyper bort polypen med en elektrisk snara. Bredbasiga och flacka polyper kan elimineras med endoskopisk mukosaresektion (EMR), där man först lyfter upp lesionen med en submukosal vätskeinjektion för att minska perforationsrisken och sedan diatermerar bort polypen med en elektrisk snara [1, 2].
EMR är en relativt enkel och standardiserad metod, men ett problem är att man oftast inte kan bort större (>2 cm) bredbasiga och flacka polyper i en bit (en bloc) utan i stället tvingas ta bort polyperna i delar (»piecemeal«). En nackdel är att fragmenterade polypdelar gör det svårt för patologen att bedöma tumörens invasionsdjup och marginalerna för att säkerställa radikalitet. Osäker radikalitet efter EMR leder i sin tur ofta till att man rekommenderar kirurgisk åtgärd. En annan nackdel med att ta bort polyper i fragment är att recidivrisken ökar jämfört med att ta bort dem en bloc (Tabell I).
Ny metod utvecklad i Japan
För att undvika dessa problem med EMR vid stora polyper har man i Japan i början av 2000-talet utvecklat en minimalinvasiv metodik som baseras på endoskopisk dissektion av submukosa och som kallas för endoskopisk submukosadissektion (ESD). ESD möjliggör borttagande av stora polyper utan storleksbegränsning och tumörer i tidigt stadium med växt begränsad till den ytliga delen av submukosan. Flera studier har visat att ESD minskar antalet lokala återfall jämfört med EMR (Tabell I). Nackdelen är att ESD är mycket svårare att utföra än EMR och att risken för komplikationer är högre (Tabell II).
Antalet fall av stora polyper kommer sannolikt att öka i takt med att kolorektal screening implementeras och med den ökande andelen äldre personer i samhället. Detta kommer att ställa nya krav på effektiva och säkra metoder för att ta bort tumörer i kolon och rektum, där ESD sannolikt kommer att inta en plats. Tillämpningen av ESD är inte begränsad till kolon och rektum; också tumörer i esofagus och ventrikel kan behandlas.
Indikationer
Den vanligaste indikationen för ESD är tumörer som inte kan tas bort en bloc med EMR. Det rör sig ofta om bredbasiga polyper som är större än 2 cm eller flacka adenom. Flacka adenom har ansetts vara ovanliga i västerlandet jämfört med i Japan, men senare studier antyder att de antagligen förekommer i större omfattning (7–45 procent av alla polyper) än vi trott [13-16]. Studier har visat att frekvensen av en bloc-resektioner av polyper som är större än 2 cm är mindre än 50 procent med EMR, medan den är över 80 procent med ESD (Tabell I). Det är välkänt att risken för invasiv cancer ökar med storleken på polypen [17]. Exempelvis är risken för invasiv cancer ca 19 respektive 64 procent vid polyper som är 2,5 respektive 4 cm stora [17]. Fibros förekommer ibland i submukosan och gör att tumörer inte lyfter efter vätskeinjektion, vilket är indikation för ESD oavsett polypstorlek. Lokala recidiv efter EMR kan med fördel tas bort med ESD [18].
Endoskopisk bedömning
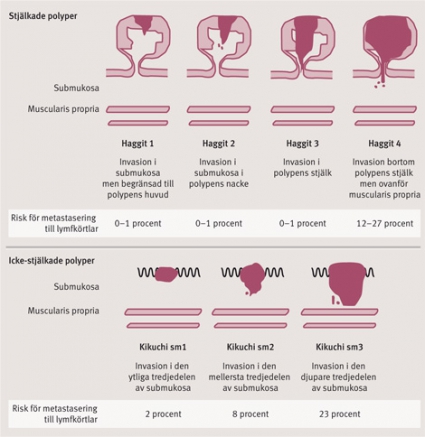
Det är viktigt att bedöma invasionsdjupet vid ytlig cancer (T1-stadium) i kolon och rektum på grund av risken för spridning av tumörceller till regionala lymfkörtlar. T1-cancer indelas i substadier med avseende på risken för lymfkörtelmetastasering beoroende på om tumörerna är stjälkade eller icke-stjälkade. För stjälkade polyper bedömer man graden av invasion in i stjälken enligt Haggitts fyra nivåer (Figur 1). Vid t ex Haggitt typ 4 är risken 12–27 procent att patienten har lymfkörtelmetastaser [19-21]. För icke-stjälkade tumörer används Kikuchis system, där växten in i submukosan delas upp i en ytlig, en mitt- och en djup tredjedel (sm 1–3), vilka korrelerar med risken för lymfkörtelmetastasering (Figur 1).
Båda systemen kräver att preparaten tagits bort en bloc. I litteraturen anges att risken för samtidig lymfkörtelmetastasering är obefintlig om tumören växer mindre än 1 mm in i submukosan [21–23], varvid ESD anses som tillräcklig behandling. Om invasionsdjupet är större än 1 mm ökar risken för tumörcellsspridning till lymfkörtlar till 9 procent [21], och patienten bör då bedömas för kirurgisk resektion. MR och DT har dålig sensitivitet och specificitet för att bedöma invasionsdjup för tumörer i kolon och rektum. Man kan utföra endoskopiskt ultraljud för att förbättra bedömningen i rektum men inte i kolon. Endoskopiskt ultraljud har en sensitivitet på 81–96 procent och en specificitet på 91–98 procent för att bedöma T-stadium i rektum [24].
Kromoendoskopi
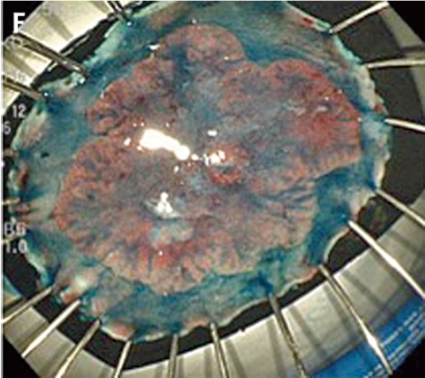
I Japan, där det görs i särklass flest ESD-procedurer, använder man ofta kromoendoskopi och s k narrow band imaging (NBI) för att bedöma kolorektala tumörers malignitetsrisk och invasionsdjup. Kromoendoskopi baseras på ytlig applikation av olika färgämnen för att bättre definiera specifika förändringar i gastrointestinalkanalen som annars inte ses. Indigokarmin och gentianaviolett är de mest använda färgämnena. Indigokarmin används mest i ventrikel, kolon och rektum för att avgränsa tumörer från omgivande vävnad.
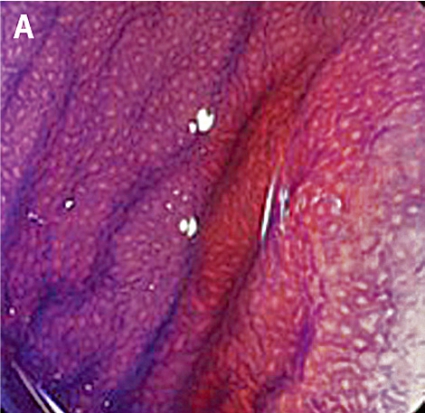
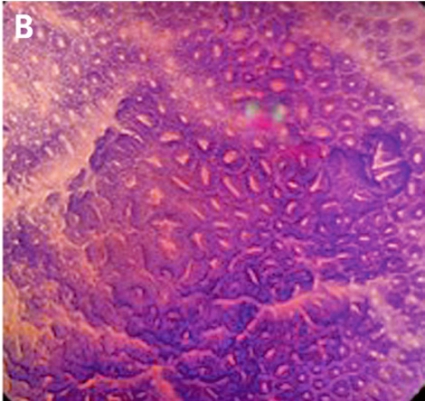
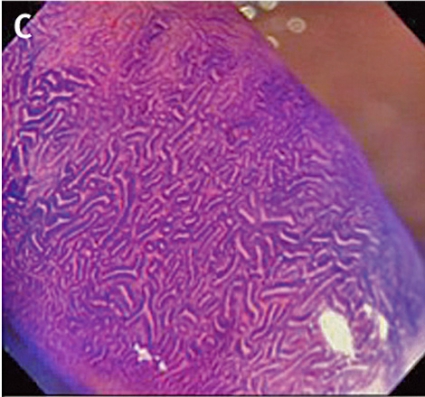
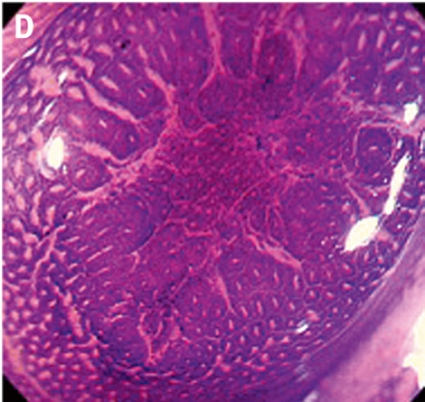
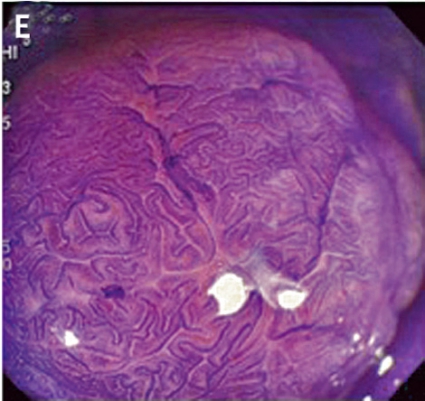
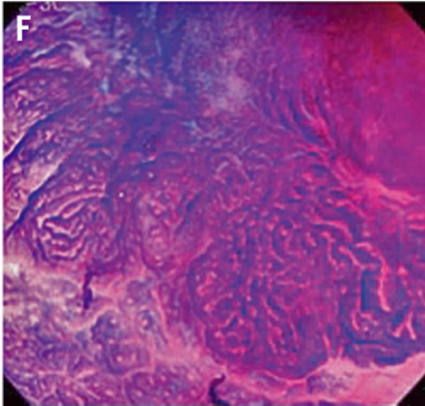
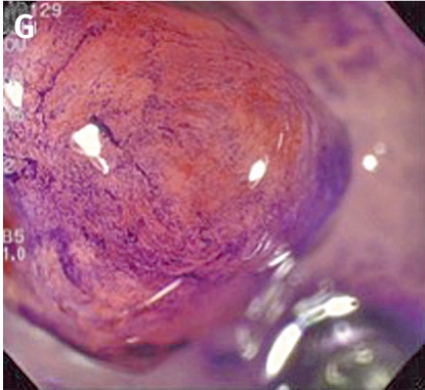
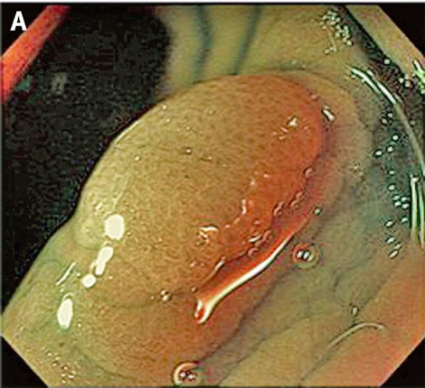
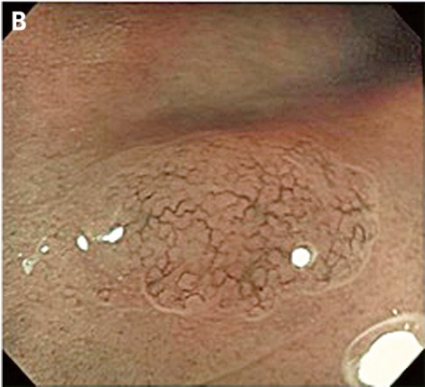
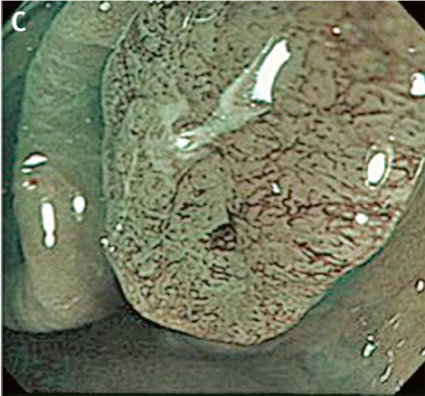
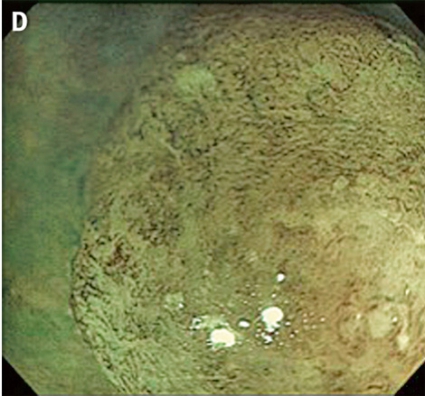
Gentianaviolett används för att underlätta analys av kryptmönstret (»pit pattern«) i kolon och rektum [25, 26]. Gentianaviolett absorberas i Lieberkühns kryptor, som ses som vita prickar och ger en tydlig bild av kryptmönstret i slemhinnan. Det här mönstret definieras som specifika typer, där typen enligt Kudos system korrelerar med malignitetsgraden. Det finns fem olika typer av kryptmönster, där typ I (A, Figur 2) och II (B, Figur 2) predicerar icke-neoplastiska förändringar, såsom normal mukosa och hyperplastisk polyp. Typ III (C, Figur 2) och IV (D, Figur 2) predicerar neoplastiska förändringar som adenom. Typ V indikerar cancer, där typ VIrregular (VI) (E, Figur 2) uppvisar ett oregelbundet och typ VNon-structure (VN) (F, Figur 2) ett helt ostrukturerat kryptmönster. Båda dessa typer är förenliga med växt djupt in i submukosa och bör behandlas kirurgiskt. Denna typ av kryptmönsteranalys har visat sig vara effektiv för bedömning av tumörer i nedre gastrointestinalkanalen och viktig för beslut om endoskopisk eller kirurgisk behandling [13, 27].
Narrow band imaging (NBI)
NBI möjliggör också bedömning av kryptmönstret men underlättar framför allt en detaljerad bedömning av det ytliga mikrovaskulära nätverket i tumörer. Hemoglobin är den principiella substansen i tarmväggen som absorberar synligt ljus, med en topp i den blåa delen av spektret (415 nm), vilket projiceras tillbaka som brunrött ljus för endoskopisten. NBI är baserat på specifika icke-överlappande filter som gör de blåa och gröna färgområdena smalare, vilket skapar olika bilder på specifika djup i tarmväggen och därmed ökar kontrasten mellan blodkärl och omgivande vävnader [28]. NBI kombineras ofta med högupplösande förstoringsendoskopi och fungerar ungefär som »digital kromoendoskopi«.
I Japan har man utvecklat ett system för klassificering av kapillärmönstret enligt Sanos system [29, 30], där typ 1 motsvarar normal mukosa eller hyperplastiska polyper (A, Figur 3). Kärlmönster av typ II ses i adenom och karakteriseras av elongerade och dilaterade kapillärer (B, Figur 3). Typ IIIa ses vid höggradig dysplasi och karakteriseras av oregelbundna kapillärer (C, Figur 3). Typ IIIb indikerar att tumören växer in i submukosan, och man ser nu endast kaotiska atypiska blodkärl (D, Figur 3).
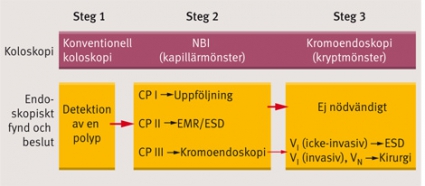
Baserat på dessa tekniker har en trestegsmodell utvecklats som inbegriper koloskopi med NBI och kromoendoskopi vid endoskopisk hantering av ytliga tumörer i kolon och rektum (Figur 4). Om en polyp upptäckt med koloskopi visar sig ha ett kapillärmönster av typ I–II med NBI kan man ta bort polypen endoskopiskt utan annan diagnostik. Om kapillärmönstret är av typ III undersöker man tumören med kromoendoskopi (gentianaviolett), och om kryptmönstret i tumören inte är av invasiv typ VI eller typ VN kan man utföra ESD. Om tumören däremot uppvisar ett kryptmönster motsvarande invasiv typ VI eller typ VN remitteras patienten för kirurgisk åtgärd. Optimal bedömning av kryptmönster och mikrovaskulärt nätverk i kolon och rektum med NBI fås bäst med zoom-endoskopi, som fortfarande är sällsynt i Sverige.
Teknik
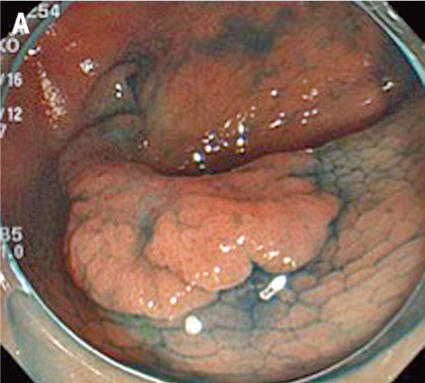
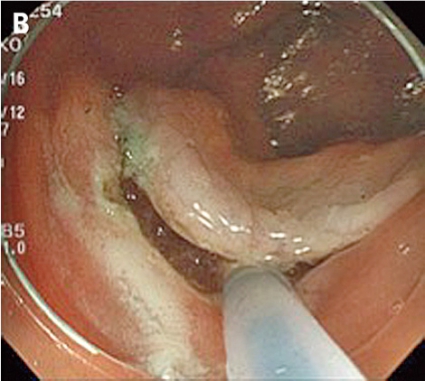
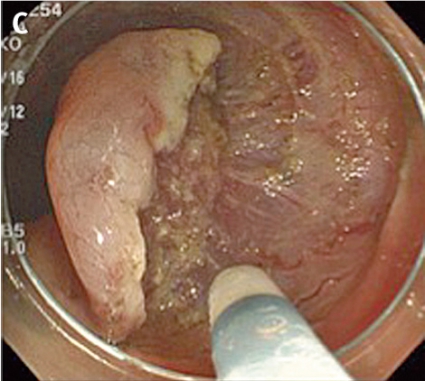
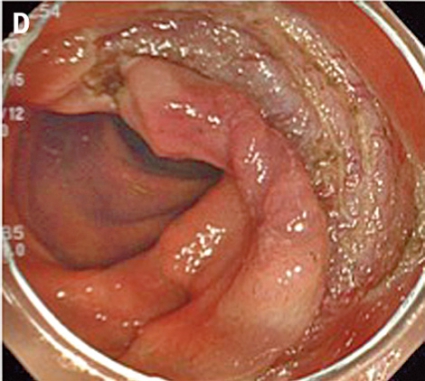
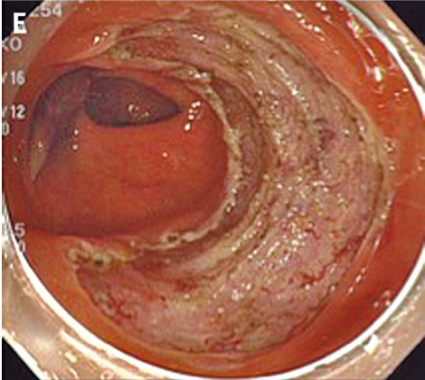
Inför ESD laxeras patienten såsom före rutinmässig koloskopi. ESD genomförs med ett vanligt koloskop eller ett gastroskop (kortare instrument med större manövrerbarhet), och patienten sederas med midazolam och opioider eller propofol. En transparent huva som kan mobilisera tumören monteras på endoskopspetsen. Huvan används för att skapa tension i submukosan och för att underlätta skopets åtkomst till dissektionsområdet. I en del fall appliceras indigokarmin för att bättre visualisera tumörens avgränsning mot normal vävnad (A, Figur 5).
Man inleder med att lyfta tumören genom att injicera en högviskös substans (t ex hyaluronsyra) i submukosan. Injektionslösningen kan blandas med indigokarmin för att bättre visualisera submukosan och adrenalin för att minska blödningarna. Sedan incideras mukosan med en diatermikniv (B, Figur 5). De finns många typer av diatermiknivar (Figur 6), och ingen studie har ännu visat om någon är bättre än andra, vilket bidrar till bristen på standardisering av ESD i kolon och rektum. Oftast görs initialt bara en partiell incision. Sedan dissekerar man igenom submukosan parallellt med muscularis propria (C, Figur 5). Under dissektionens gång får man ofta komplettera och förnya de submukosala injektionerna för att lyfta upp lesionen.
Eftersom endoskopets position i förhållande till tumören är viktig bör endoskopisten vara mycket erfaren. Ofta krävs att patienten byter position flera gånger under proceduren. Blodkärl koaguleras med diatermikniven, och blödningar stoppas med diatermikniven eller ett speciellt instrument (»coag-grasper«, Figur 6) som kan greppa och diatermera lite större blodkärl. Eftersom tarmväggen i kolon och rektum är tunn måste man vara försiktig med koaguleringen. Till sist kompletteras den partiella incisionen av mukosan runt hela tumören (D, Figur 5), och preparatet kan tas ut i en bit med en extraktionskorg (E, Figur 5). Preparatet nålas sedan upp på en skiva och fixeras (F, Figur 5). Proceduren är tidskrävande och tar 1–3 timmar beroende på tumörens svårighetsgrad. Eftersom ESD tar relativt lång tid används alltid koldioxid som insufflationsgas, som snabbare diffunderar ut ur tarmen. Endoskopisk tumörresektion anses radikal om det intakta preparatet har negativa marginaler, invasionsdjupet i submukosan är mindre än 1 mm och inga tecken till engagemang av lymf- eller blodkärl finns.
Komplikationer
Perforation och blödning är de viktigaste komplikationerna vid ESD. Perforationerna kan vara letala, men de allra flesta hanteras konservativt och behöver ingen kirurgisk åtgärd [31, 32]. Vanligen räcker det med att stänga perforationen med ett par clips. Perforationsfrekvensen är högre vid ESD än vid EMR och varierar i olika studier mellan 1 och 8 procent, men de flesta rapporterar runt 4 procent (Tabell II). Den stora variationen i perforationsrisk återspeglar delvis teknikutvecklingen men också bristen på standardisering. Det finns centrum där man har försökt standardisera ESD-proceduren och rapporterat en perforationsfrekvens som närmar sig noll [33].
Det tycks inte finnas någon lokalisation i kolon eller rektum som oftare perforeras än andra. Risken för perforation ökar med tumörens storlek [6] och med förekomst av fibros i submukosa. Orsakerna till att perforation är vanligare i kolon än i esofagus och ventrikel är paradoxal peristaltik, förekomst av veck och flexurer samt tunnare vägg i kolon.
Särskilt fruktad är s k sen perforation, som uppkommer efter behandlingen och som ses i 0,3–0,7 procent av fallen av genomgången ESD [6, 7, 34]. Orsaken är okänd men kan bero på överdriven koagulering och diatermering av muscularis propria. Sena perforationer är ofta större och kräver ofta akut kirurgisk åtgärd. Frekvensen blödningar efter ESD varierar mellan 0 och 12 procent, i likhet med efter EMR (Tabell II). De flesta blödningarna efter ESD avstannar spontant eller efter endoskopisk behandling.
Implementering i Sverige
Innan man börjar utföra ESD bör man ha lång erfarenhet av endoskopi i allmänhet och av EMR i synnerhet. Adekvat selektion av patienter till ESD är avgörande för en framgångsrik verksamhet. Dessutom bör man lära sig att hantera ESD-tekniken och de speciella instrumenten genom övningar på djur samt genom besök på endoskopiska centra där ESD görs rutinmässigt. I Japan börjar man kliniskt med att utföra ESD i ventrikeln då ytliga tumörer är vanliga där och då ESD är avsevärt enklare att genomföra i ventrikeln än i esofagus och kolon. När man fått tillräcklig erfarenhet av ESD i ventrikeln börjar man med ESD i esofagus och kolon.
Under hela processen har man en handledare vid alla ESD-procedurer. Eftersom lämpliga fall för ESD i esofagus och ventrikel är relativt ovanliga i Sverige kan det vara svårt att tillämpa den japanska modellen här. I Sverige är det mer sannolikt att de som skaffar sig erfarenhet av ESD i kolon och rektum också tar sig an de få fallen av ESD i esofagus och ventrikel. På så sätt skulle endoskopiska centra för behandling av patienter med stora polyper och tidig cancer i hela gastrointestinalkanalen kunna utvecklas. I dagsläget har ESD börjat etableras på ett fåtal platser i Sverige, och alla fall hittills rör tumörer i kolon och rektum. Den här modellen för ESD-implementering är i linje med europeiska rekommendationer [35].
Konklusion
I takt med att antalet fall av polyper och tidig cancer i kolon och rektum ökar kommer behovet av minimalinvasiva och effektiva tekniker också att öka. ESD kan förbättra den patologiska diagnostiken och minska recidiven, men metoden är tekniskt utmanande. Det största problemet är risken för tarmperforation. Risken kan minskas med adekvat endoskopisk utbildning. En standardisering av ESD-metoden i kolon och rektum är dock nödvändig för att maximera patientsäkerheten. Därför bör ESD-verksamheten i Sverige även fortsättningsvis samlas till ett begränsat antal endoskopiska centra för att säkerställa hög kompetens inom området.