Sammanfattat
Utsättning av trombocythämmare för att minimera blödning vid kirurgi innebär ökad risk för trombotiska komplikationer.
Den individuella responsvariabiliteten för klopidogrel är stor.
Nya, effektivare trombocythämmare (tikagrelor och prasugrel) kan medföra större blödningsproblem i samband med kirurgi.
Beslut om utsättning av trombocythämmare bör fattas i samråd med kardiolog.
Erfarenheterna av handläggningen av klopidogrelbehandlade patienter i samband med hjärtkirurgi kan i de flesta fall tillämpas för patienter som ska genomgå invasiva, icke-hjärtkirurgiska åtgärder.
Patientnära analys av klopidogrels trombocythämmande effekt kan ge vägledning men kräver kunskap om använd metod. Vid hög ADP-inducerad trombocytreaktivitet är blödningsrisken inte ökad. Vid låg trombocytreaktivitet och blödning finns indikation för trombocytkoncentrat och eventuellt aprotinin. Tikagrelorrelaterade blödningar kan bli svårare att häva.
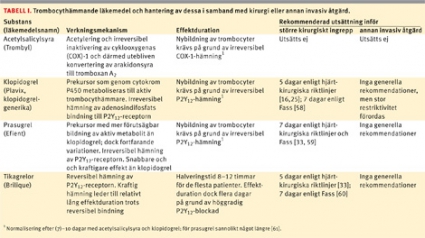
Ett ökande antal patienter i Sverige får klopidogrel (Plavix) som trombocythämmande behandling vid akut kranskärlssjukdom och i samband med perkutan koronarintervention med stentimplantation. Nu har därtill två nya P2Y12-receptorantagonister, prasugrel (Efient) och tikagrelor (Brilique), introducerats i Sverige (Tabell I). Mer än 13 000 patienter med icke-ST-höjningsinfarkt rapporterades 2010 till Riks-HIA, varav 93 procent behandlades med en P2Y12-receptorantagonist vid utskrivningen [1]. Dessa patienter, med en medelålder omkring 70 år, är i många fall i behov av kirurgi under pågående behandling med klopidogrel eller annan P2Y12-blockerare. Cirka 5 procent av patienterna som genomgår koronarintervention med stentimplantation behöver ett kirurgiskt ingrepp inom ett år [2].
Effekter av trombocythämning
Patienter med akuta koronara syndrom och patienter som genomgått perkutan koronarintervention har under läkningsförloppet intimaskador i kranskärlen och ökad trombocytreaktivitet, vilket ökar risken för ischemiska händelser [3]. För att minska denna risk adderas under en begränsad tidsperiod en P2Y12-blockerare till basbehandlingen med acetylsalicylsyra (ASA; Trombyl). Kombinationsbehandlingen blockerar samtidigt trombocytens arakidonsyra- och adenosindifosfat (ADP)-medierade signalvägar och medför kraftigare antitrombotisk effekt med ökad blödningsrisk.
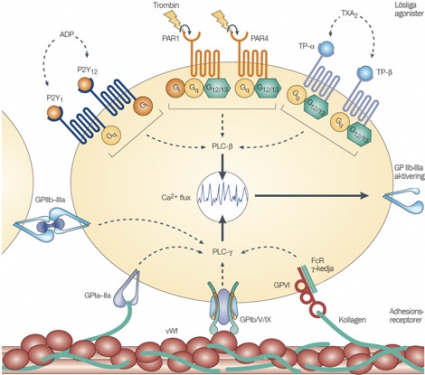
Trombocytaktivering är en central del i utvecklingen av akuta koronara syndrom. Vid ruptur av ett aterosklerotiskt kranskärlsplack exponeras t ex kollagen och von Willebrand-
faktorn, till vilka trombocyter kan bindas. Aktiverade trombocyter frisätter bl a ADP samt arakidonsyra som bildar tromboxan A2; dessa substanser förstärker trombocytaktiveringen. ADP binder till trombocytens P2Y12-receptor, som faciliterar uttrycket av aktiverade glykoprotein IIb/IIIa-receptorer på trombocytens yta. Dessa receptorer korslänkas via fibrinogen, och därmed bildas trombocytaggregat. Genom interaktion med leukocyter leder trombocytaktiveringen även till ett stegrat inflammatoriskt svar (Figur 1).
Genom irreversibel hämning av trombocytens P2Y12-receptor är tienopyridinen klopidogrel en potent hämmare av ADP-medierad trombocytaktivering. Tillägg av klopidogrel till ASA minskar risken för kardiovaskulär mortalitet, hjärtinfarkt och stroke men ökar blödningskomplikationerna hos patienter med akuta koronara syndrom utan ST-höjning [4, 5]. Vid utsättning av klopidogrel föreligger ökad risk för trombotiska komplikationer [6, 7]. Även prasugrel blockerar P2Y12-receptorn irreversibelt och har i rekommenderad dosering en snabbare och vanligtvis kraftigare effekt än klopidogrel. Tikagrelor blockerar P2Y12-receptorn reversibelt, men genom den mycket kraftiga trombocythämning som föreligger vid rekommenderad dosering varar effekten trots det ganska länge efter utsättningen.
Responsvariabilitet och mätning av trombocytreaktivitet
Det finns en responsvariabilitet för klopidogrel mellan olika individer, och monitorering av trombocytreaktivitet har därför en potentiell roll i handläggningen av dessa patienter. Uppskattad andel patienter med nedsatt effekt av klopidogrel varierar mellan 5 och 44 procent beroende på mätmetod [8, 9]. Klopidogrelbehandlade patienter med trombocytreaktivitet överstigande en viss nivå klassificeras som non-responders [10], vilket är ett förenklat synsätt.
Hög trombocytreaktivitet har ofta en annan orsak än sann klopidogrelresistens, som definieras som utebliven förmåga att hämma P2Y12-receptorn. Responsvariabilitet kan bero på varierande bioaktivering av klopidogrel (bildning av den aktiva metaboliten) på grund av CYP2C19-polymorfi och läkemedelsinteraktioner, varierande grad av trombocytaktivering (oavsett behandling) samt bristande följsamhet till behandlingen. Med anledning av detta bör begrepp som klopidogrelresistens undvikas; i stället bör benämningen vara hög trombocytreaktivitet under pågående behandling. Denna benämning återspeglar att tillståndet kan bero på många faktorer och att sann klopidogrelresistens endast är en av dessa [11, 12].
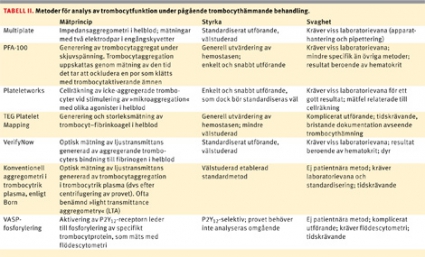
Medvetenhet om denna responsvariabilitet har lett till ett ökat intresse för mätningar av trombocytreaktivitet under pågående klopidogrelbehandling. Flera patientnära analysmetoder, såsom Multiplate, PFA-100, Plateletworks, TEG PlateletMapping och VerifyNow, finns i dag tillgängliga (Tabell II). Med dessa metoder mäts ADP-inducerad trombocytaktivering och -aggregation på olika sätt; detta kräver utbildning och erfarenhet för att ge tillförlitliga resultat [13]. VASP-fosforyleringsmetoden är selektiv för P2Y12-mekanismen men kräver flödescytometri och är således inte patientnära. Gränsvärden för definition av hög trombocytreaktivitet har upprättats för vissa av dessa analysmetoder [14], men de är ofta arbiträra och bör dokumenteras bättre avseende kliniska utfall.
Flera studier har påvisat ett samband mellan hög trombocytreaktivitet och risk för ischemiska händelser [14, 15]. Hög trombocytreaktivitet mätt med Plateletworks, VerifyNow eller konventionell ADP-inducerad aggregabilitet har relaterats till ökad risk för mortalitet, hjärtinfarkt och stenttrombos hos patienter som genomgår perkutan koronarintervention [16]. Orsakerna till dessa samband är emellertid komplexa; exempelvis har patienter med dålig följsamhet generellt sämre prognos än patienter med god följsamhet.
Det är inte visat om och hur skräddarsydd trombocythämmande behandling kan förbättra prognosen för patienter med hög trombocytreaktivitet under pågående klopidogrelbehandling. Individualisering av trombocythämmande behandling med patientnära analyser anses därför fortfarande vara på forskningsstadiet [14, 17].
Trombocytreaktivitet vid prasugrel- och tikagrelorbehandling kan monitoreras med hjälp av patientnära analys av ADP-inducerad trombocytaggregation för kontroll av följsamhet till dessa potenta läkemedel. Vid prasugrelbehandling ses viss variabilitet mellan individer, varför testning även kan användas för identifiering av svaga responders till prasugrel [18].
Utsättning av ASA och klopidogrel inför kirurgi
Vid utsättning av ASA finns risk för rekylfenomen med ökad trombocytreaktivitet [19]. Fortsatt ASA-behandling inför kranskärlskirurgi är relaterad till minskad mortalitet utan samtidigt ökad risk för reoperation på grund av blödning [20, 21]. Att fortsätta ASA-behandling vid invasiva åtgärder är associerat med minskad risk för hjärtinfarkt utan ökad risk för allvarliga blödningar, förutom eventuellt vid intrakraniella ingrepp och transuretral prostatektomi [22-24]. Med anledning av detta bör ASA-behandling för sekundärprevention av hjärt–kärlsjukdom inte sättas ut i samband med hjärt- eller övrig kirurgi [25].
Inverkan av klopidogrelbehandling hos patienter som genomgår invasiva, icke-hjärtkirurgiska åtgärder är bristfälligt studerad [24]. På grund av små patientvolymer, stor variation i typen av ingrepp och brist på kontrollgrupper är det svårt att dra definitiva slutsatser från dessa studier [2]. Kranskärlskirurgi utgör en bra modell för studier av klopidogrels effekter vid kirurgi då andelen klopidogrelbehandlade patienter är stor och mätning av postoperativ blodförlust sker rutinmässigt. Erfarenheterna av handläggningen av klopidogrelbehandlade patienter i samband med hjärtkirurgi kan i de flesta fall tillämpas på patienter som ska genomgå invasiva, icke-
hjärtkirurgiska åtgärder.
Andelen patienter med akuta koronara syndrom utan ST-höjning som genomgår kranskärlskirurgi har uppskattats till 10–15 procent [26-28]. Det är viktigt att känna till om dessa patienter behandlats med klopidogrel eftersom utsättning av medlet mindre än fem dagar före kranskärlskirurgi ökar risken för blödning och reoperation samt behovet av transfusion [26, 29, 30]. Å andra sidan har dessa patienter ökad risk för ischemiska händelser vid utsättning av klopidogrel [6, 7]. Den optimala tidpunkten för utsättning av klopidogrel inför kranskärlskirurgi är inte fastställd. Kliniska riktlinjer förespråkar utsättning fem dagar före kranskärlskirurgi [17, 25] men majoriteten av ingreppen utförs tidigare än så [27, 29].
Nya trombocythämmare
Ökad användning av de potenta trombocythämmarna prasugrel och tikagrelor innebär nya utmaningar och frågeställningar i samband med kirurgi. I TRITON-TIMI 38-studien var behandling med prasugrel jämfört med klopidogrel associerad med ökad risk för allvarlig blödning hos både patienter som genomgick kranskärlskirurgi och övriga patienter [31]. För patienter som genomgick kranskärlskirurgi var den absoluta riskökningen 15 procent [32]. På grund av den förlängda och kraftigare effekten jämfört med klopidogrel rekommenderas utsättning av prasugrel sju dagar före hjärtkirurgi [33].
Tikagrelors trombocythämmande effekt är betydligt mer uttalad än klopidogrels [34]. Det sker en snabbare återhämtning av trombocytfunktionen efter utsättning av tikagrelor än efter utsättning av klopidogrel [35], men det tar ändå ett par dagar innan blockaden är mindre för tikagrelor än för klopidogrel [34]. Blödningsrisken vid kranskärlskirurgi i PLATO-studien var lika hos tikagrelor- och klopidogrelbehandlade patienter vid samtidig utsättning av trombocythämmarna [36]. Med anledning av detta bör tikagrelor sättas ut minst fem dagar före kranskärlskirurgi [33, 36].
Trombocytreaktivitet och blödning
Få studier har undersökt förhållandet mellan trombocytreaktivitet och blödningsrisk efter perkutan koronarintervention. I dessa studier korrelerar låg trombocytreaktivitet med högre incidens av allvarlig blödning [37, 38]. Likaså har endast ett fåtal studier utvärderat relationen mellan trombocytfunktion och blödning vid kirurgi.
På Karolinska universitetssjukhuset genomgick totalt 798 patienter isolerad kranskärlskirurgi under åren 2010–2011. Av de 5 procent som reopererades på grund av blödning hade 66 procent erhållit klopidogrel inom fem dagar före operationen. Vi har hos klopidogrelbehandlade patienter som genomgått kranskärlskirurgi analyserat trombocytreaktiviteten mätt med cellräkningsmetoden Plateletworks i förhållande till blödning [39, 40]. I ett material med data från 88 patienter var låg preoperativ ADP-inducerad trombocytaggregation, som tyder på kraftig behandlingseffekt, relaterad till större blödning och fler transfusioner av trombocytkoncentrat. Patienter i tertilen med lägst trombocytreaktivitet hade 29 procent större blödningsmängd tolv timmar efter kirurgi än patienter i tertilen med högst trombocytreaktivitet. 43 procent av patienterna i tertilen med lägst trombocytreaktivitet erhöll trombocytkoncentrat jämfört med 17 procent av patienterna i tertilen med högst trombocytreaktivitet [40]. Dessa resultat överensstämmer med dem från studier där andra trombocytfunktionstest använts [41-44].
Att finna ett eventuellt samband mellan preoperativ trombocytreaktivitet och blödning är av stort kliniskt intresse. Trombocytdysfunktion är en av flera orsaker till blödning och tidig reoperation efter hjärtkirurgi. Reoperationer är resurskrävande och blodprodukter är kostsamma och utgör även en risk [45]. Kännedom om trombocytreaktivitet kan användas vid beslut om optimal tidpunkt för kranskärlskirurgi och inför administrering av trombocytkoncentrat vid operationen [7, 46, 47]. Detta kan minska risken för allvarlig blödning och reoperation efter hjärtkirurgi.
Noteras bör att blödningarna kan bli svårare att hantera hos patienter som behandlas med tikagrelor än hos dem som behandlas med tienopyridinerna. Det beror på att de senare medlen verkar genom en kortlivad aktiv metabolit, varför nya trombocyter som tillförs inte bör blockeras i någon större utsträckning. Tikagrelor däremot, som finns lagrat i kroppen, kan fortsätta att blockera nya trombocyter via direkt verkan och fortsatt bildning av dess aktiva metabolit [48]. Erfarenheter av behandling av allvarliga blödningar under tikagrelorbehandling med t ex trombocytkoncentrat finns ännu inte rapporterade.
Riktlinjer saknas
Det finns i dag inga allmänna riktlinjer för handläggningen av klopidogrelbehandling inför invasiva, icke-hjärtkirurgiska åtgärder. Bedömningen bör vara multidisciplinär med utvärdering av den individuella risken för blödning och trombotiska komplikationer [24]. Oro för ökad blödning vid kirurgi kan leda till för tidig utsättning av klopidogrel, vilket är den viktigaste riskfaktorn för stenttrombos [2, 24] med åtföljande risk för hjärtinfarkt och död [6].
De uppdaterade amerikanska kliniska riktlinjerna rörande blodbevarande hjärtkirurgi från Society of Thoracic Surgeons och Society of Cardiovascular Anesthesiologists rekommenderar patientnära analys av ADP-inducerad trombocytaggregation för att identifiera non-responders till klopidogrel [49]. Hos dessa patienter, utan förväntat ökad blödningsrisk, kan ett planerat ingrepp genomföras utan väntetid efter utsättning av klopidogrel.
Det finns inga strikta riktlinjer kring vilken analysmetod för trombocytreaktivitet som bör användas i samband med kirurgi. Vissa av de patientnära testen har definierade gränsvärden för klassificering av hög trombocytreaktivitet under pågående klopidogrelbehandling, men de har tagits fram avseende risken för återinsjuknande, inte avseende blödningsrisken vid kirurgi [14]. De amerikanska riktlinjerna anger inte analysmetod eller gränsvärden för definition av non-responders. Den metod som används kommer därmed att variera mellan olika kliniker, och definitionen av non-responders kommer inte att vara enhetlig. Kunskap om metoden, utförandet och tillämpningen av resultat är således av stor vikt [13].
Framtida möjligheter
Klopidogrelbehandlade patienter med hög risk för ischemiska händelser som ska genomgå kirurgisk revaskularisering sätts ibland över på infusionsbehandling med kortverkande glykoprotein IIb/IIIa-antagonister trots att vetenskapligt stöd för det saknas [50]. Den reversibla, mycket kortverkande P2Y12-antagonisten kangrelor har varit föremål för flera stora studier men är ännu inte tillgänglig för kliniskt bruk. Nyligen publicerades BRIDGE-studien, där tienopyridinbehandlade patienter behandlades med kontinuerlig infusion av kangrelor fram till sex timmar före kranskärlskirurgi. Jämfört med kontrollgruppen uppvisade de kangrelorbehandlade patienterna lägre risk för allvarlig blödning [51]. På sikt kan detta vara ett attraktivt alternativ i handläggningen av klopidogrelbehandlade patienter med ökad risk för ischemiska händelser som ska genomgå kirurgi.
Slutsatser
ASA med indikationen sekundärprevention vid hjärt–kärlsjukdom bör inte sättas ut i samband med hjärt- eller övrig kirurgi [25]. Beslut om utsättning av klopidogrel inför kirurgi bör ske i samråd med kardiolog och baseras på individuell bedömning av risk för blödning och trombotiska komplikationer. Trombocytfunktionstest kan användas som stöd för beslut om optimal tidpunkt för kirurgi. Beträffande patienter med läkemedelsstent eller nyligen insatt behandling för akut kranskärlssjukdom tillråds försiktighet vad gäller utsättning av klopidogrel och andra P2Y12-blockerare.
I 2012 års riktlinjer från American College of Chest Physicians poängteras risken för stenttrombos vid utsättning av trombocythämmande läkemedel i samband med kirurgi [25]. Man rekommenderar senareläggning av kirurgi för patienter som behandlas med 2PY12-receptorantagonister och som erhållit metallstent inom sex veckor eller läkemedelsstent inom sex månader före operation. I de fall senareläggning av kirurgi inte är möjlig avråder man från utsättning av trombocythämmande behandling i anslutning till operation [7, 25].
Analys av ADP-inducerad trombocytaggregation kan användas för att identifiera hög trombocytreaktivitet under pågående klopidogrelbehandling. Dessa patienter har inte förhöjd blödningsrisk.
Riktlinjer anger att klopidogrelbehandlade patienter i behov av akut kirurgi kan behandlas profylaktiskt med trombocytkoncentrat för att minska risken för allvarlig blödning, vilket dock är bristfälligt studerat [25]. Rimligtvis kan sådan behandling tillämpas vid låg ADP-inducerad trombocytaggregation. En studie på friska individer visar dock att en stor volym trombocytkoncentrat behöver tillföras för att häva klopidogrelinducerad trombocythämning [52]. Blödningar orsakade av tikagrelor kan visa sig vara ännu svårare att motverka på detta sätt. Tranexamsyra minskar blödningsrisken och transfusionsbehovet vid hjärtkirurgi [53] och administreras därför profylaktiskt inför dessa ingrepp. Inga rekommendationer angående användning av tranexamsyra vid invasiva, icke-hjärtkirurgiska åtgärder föreligger i dag.
Vid manifest, svårkontrollerad blödning hos en patient med preoperativt låg ADP-inducerad trombocytaggregation kan användning av fibrinolyshämmaren aprotinin övervägas. Användningen av aprotinin begränsades år 2007 på grund av ökad mortalitet vid kranskärlskirurgi i den behandlade gruppen i den kanadensiska BART-studien [54]. Nyligen underkändes studien av kanadensiska myndigheter då man vid eftergranskning av data funnit att aprotinin inte är associerat med ökad mortalitet [55].
Den europeiska läkemedelsmyndighetens (EMA) vetenskapliga kommitté har nyligen rekommenderat att aprotinin åter ska få marknadsföras i Europa [56]. Aprotinin har i tidigare studier visats minska postoperativ blödning och transfusioner av trombocyt- och erytrocytkoncentrat hos klopidogrelbehandlade patienter [57].
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.