Sammanfattat
En mångfald aspekter måste tas i beaktande när man överväger att införa nya screeningprogram eller behålla etablerade sådana.
Målsättningen med screening är att i en frisk population förhindra utveckling av och död i en sjukdom.
Effekten av screening beror på sjukdomens egenskaper, screeningtestet och tillgängliga behandlingar, vilka anges i WHO:s screeningkriterier.
Till screeningens baksida hör t ex kostnaden, falskt positiva respektive falskt negativa provresultat och överdiagnostik.
I denna översikt tar vi upp grundläggande koncept och kriterier vad gäller screening och dess för- och nackdelar. Vi beskriver kortfattat hur screening kan utvärderas. Exempel på olika etablerade screeningprogram och sådana som är under diskussion nämns men utan att gå in på detaljer. Vår förhoppning är att läsaren bättre ska förstå vilka hänsyn som måste tas när man utvärderar och överväger att införa nya screeningprogram.
Definition
Screening innebär att man med ett relativt enkelt test sållar fram sjuka individer i en population. Målsättningen med screening är att i en frisk population förhindra utveckling av och död i en sjukdom. Ett screeningtest syftar inte till att diagnostisera och säkerställa sjukdom utan till att identifiera individer som med hög sannolikhet är drabbade. Dessa personer genomgår därefter riktade undersökningar eller procedurer. För många sjukdomar innebär diagnos i tidigt stadium att man med olika interventioner kan förbättra prognosen.
Vid en första anblick känns kanske detta som ett tilltalande koncept, men i praktiken finns många komplicerande faktorer som kan göra att fördelarna med screening inte uppenbart överväger sidoeffekterna och kostnaderna.
Kriterier
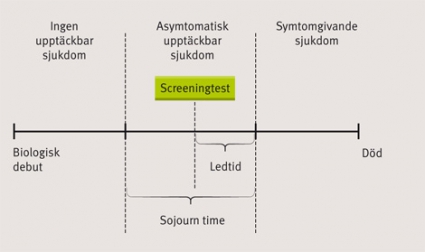
Huruvida screening uppnår avsedd effekt beror på sjukdomens, screeningtestets och behandlingens egenskaper. Viktiga sådana egenskaper har angivits i WHO:s screeningkriterier [1]. Sjukdomen ska vara allvarlig, dvs orsaka betydande grad av lidande och död, och bör ha hög prevalens i prekliniskt stadium i den definierade populationen. Vidare ska naturalförloppet vara känt, och tiden mellan första märkbara tecken på sjukdom och manifest, klinisk sjukdom (s k sojourn time) behöver vara tillräckligt lång.
I Figur 1 illustreras tidpunkten för ett screeningtest i förhållande till en sjukdoms naturalförlopp. Screeningtestet ska ha tillräcklig sensitivitet och specificitet (se definition i avsnittet om diagnostik och Figur 2) samt vara enkelt och billigt att genomföra. Testet måste också vara säkert att genomgå och accepterat i populationen samt ha tillräcklig reliabilitet (dvs tillförlitlighet, exempelvis i form av reproducerbarhet).
Slutligen ska det finnas en effektiv, acceptabel och säker behandling och en etablerad infrastruktur för diagnostik och behandling. Det finns ingen anledning att screena för en sjukdom som inte kan upptäckas innan symtomen gör att individen söker vård. Om tidig behandling saknar effekt på prognosen har screening inte heller något berättigande. Tidigare upptäckt medför i detta fall endast att individen får leva längre med vetskap om sjukdomen utan att förloppet kan påverkas, vilket är etiskt tvivelaktigt.
Fördelar och nackdelar
Syftet med screening är i första hand att minska dödligheten i en sjukdom. Detta kan sekundärt även ge minskad sjuklighet. Upptäckt av sjukdomen i ett tidigt stadium minskar risken för död och innebär också mindre symtom och kanske även mindre omfattande behandling, vilket i sin tur kan medföra ökad livskvalitet. Som sållningsprocess i en population, där vanligtvis merparten inte har sjukdomen, ger screening upphov till ett antal oönskade effekter.
Ett screeningprograms sållningsprocess kan förenklat illustreras i den fyrfältstabell som ligger till grund för beräkning av sensitivitet och specificitet (Figur 2). Denna består av följande grupper: de som testar positivt och som har sjukdomen (sant positiva), de som testar positivt men som inte har sjukdomen (falskt positiva), de som testar negativt och som inte har sjukdomen (sant negativa) och de som testar negativt men som har sjukdomen (falskt negativa).
I syfte att rädda några individer från att dö kommer ett antal personer att få en falskt positiv diagnos och några kommer att missas eftersom det inte finns någon screeningmetod med 100 procent specificitet och sensitivitet. De som får ett falskt positivt svar kan utsättas för varierande grad av oro under utredningstiden och eventuella ytterligare diagnostiska procedurer som kan medföra andra risker. De som får ett falskt negativt svar kan invaggas i falsk säkerhet eftersom de tror att de är friska, vilket kan få följden att de söker vård senare än de annars hade gjort.
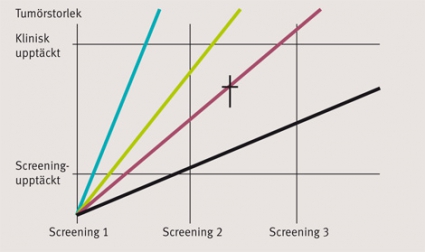
Ytterligare ett problem med screening är risken för överdiagnostik. Det innebär upptäckt av sjukdom som annars inte hade gett sig till känna hos individen under dennes livstid (Figur 3). Fenomenet har benämnts pseudosjukdom eller latent sjukdom [2]. Det finns således en »reservoar« av sjukdomar i populationen – vissa leder till döden och andra inte – på grund av att man kan dö av annan orsak eller att en dödlig form av sjukdomen inte utvecklas under individens levnad. Detta fenomen gäller för många sjukdomar men har i screeningsammanhang framför allt uppmärksammats för bröst- och prostatacancer [3-5].
För att illustrera detta har Barrat et al [6] föreslagit att den klassiska fyrfältstabellen kompletteras med grupperna »sant« positiva och »falskt« negativa (Tabell I). I ett exempel med bröstcancer utgörs således »sant« positiva av kvinnor med mammografifynd av bröstcancer som inte skulle ha utvecklats till symtomgivande sjukdom under kvinnans livstid. De behandlas på samma vis som de sant positiva, och man kan inte säga vilka av kvinnorna som har överdiagnostiserats och därmed överbehandlats. Få screeningprogram informerar fullt ut om dessa sidoeffekter, vilket har debatterats i bl a Skandinavien och Storbritannien [7, 8].
Utvärdering
När en sjukdom bedöms passa in i ovan nämnda screeningkriterier och ett lämpligt screeningtest finns återstår att avgöra huruvida det skulle vara genomförbart och effektivt att införa ett storskaligt screeningprogram.
Genomförbarheten avgörs av följande faktorer: acceptans hos screeningprogrammets målgrupp, kostnadseffektivitet, efterföljande diagnos och behandling av dem som testar positivt samt avkastning i form av antal fall som upptäcks och hur många dödsfall som förhindras. Acceptans uppnås lättare om testet är snabbt, enkelt och medför minimalt obehag och kan mätas med procentuellt deltagande i den avsedda befolkningen. Kostnader inkluderar både screeningförfarandet i sig och uppföljningar i form av diagnostik och behandling av dem som testats positivt. Ett mått på avkastningen är det prediktiva värdet.
Med det positiva prediktiva värdet avses andelen sant positiva fall i relation till det totala antalet som testet funnit vara positiva. Omvänt avser det negativa prediktiva värdet andelen sant negativa fall i relation till det totala antalet negativa fall som testet har funnit. Det prediktiva värdet bör vara så högt som möjligt och styrs av sjukdomens förekomst i befolkningen (prevalens) samt screeningmetodens sensitivitet och specificitet. Om förekomsten av en sjukdom är låg blir det prediktiva värdet alltid lågt även om sensitiviteten och specificiteten är höga. Skillnaden mellan prediktivt värde, sensitivitet och specificitet illustreras i Figur 2.
Ett screeningprograms effektivitet avgörs av dess förmåga att sänka den sjukdomsspecifika morbiditeten och mortaliteten. Det yttersta måttet på effektivitet får man genom att jämföra sjukdomsspecifik mortalitet bland dem som diagnostiserades i screeningprogrammet med dem som diagnostiserades kliniskt på grund av symtom. I cancerscreeningprogram kan även exempelvis surrogatparametrar i form av andel intervallcancer (cancerfall som upptäcks mellan två screeningomgångar, Figur 3) och stadiedistributionen användas som mått på effektiviteten. Idealiskt sett utvärderas effektiviteten (efficacy) i randomiserade kontrollerade studier (RCT) där man kan försäkra sig om att de båda grupperna är jämförbara och att utfallet fastställs på samma sätt. I realiteten är sådana studier svåra att genomföra bl a på grund av höga kostnader och etiska problem.
Omfattande RCT har gjorts på bl a bröst-, prostata-, kolorektal- och lungcancer samt bukaortaaneurysm [3, 4, 9-11]. Alternativet är att basera utvärderingar på observationsstudier (med alla de begränsningar som sådana studier har) [12, 13]. I kohortstudier kan tidstrender för t ex sjukdomsspecifik mortalitet i olika populationer jämföras för olika screeningintervall, i samtida populationer med och utan screening eller i samma population vid olika tidpunkter (se t ex Kalager et al [14]). Fall–kontrollstudier kan vara av värde för att exempelvis jämföra olika screeningintervall eller tillvägagångssätt men har en tendens att överskatta effekten av screening framför allt på grund av risken för selektionsbias [15].
I utvärderingen av screeningprogram måste man också beakta möjlig påverkan av olika systematiska fel (bias), såsom selektionsbias, ledtidsbias (lead time bias) och tidsbias (length bias). De som väljer att delta i ett screeningprogram kan ha både högre och lägre mortalitet än den avsedda populationen oavsett deltagande i screeningen (selektionsbias). I fallet med ledtidsbias kan det felaktigt se ut som om överlevnaden bland fall som upptäckts med screening är längre, medan man i själva verket bara har tidigarelagt upptäckten. Tidsbias syftar på att de som har en längre preklinisk fas är överrepresenterade bland fall som upptäcks genom screening. Dessa har naturligt en mer gynnsam diagnos (Figur 3).
I Sverige finns screeningprogram etablerade för bröstcancer (mammografi) och cervixcancer och för vissa tillstånd hos spädbarn (t ex blodprov för fenylketonuri [PKU], kongenital hypotyreos, adrenogenitalt syndrom [CAH], galaktosemi och biotinidasbrist). Screening för kolorektalcancer och aortaaneurysm har införts i vissa delar av landet, medan screening för prostata- respektive lungcancer är omdebatterad och ännu inte införda.
Konklusion
Det finns många faktorer att ta hänsyn till vad gäller screening, vilket bidrar till att förklara de intensiva debatterna om olika programs vara eller icke-vara. Den intresserade läsaren kan läsa mer om screening i textböcker av t ex Raffle et al [16], Rothman et al [17], Hennekens et al [18] och Juth et al [19].
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-09-01)