Stevens–Johnsons syndrom och toxisk epidermal nekrolys är ovanliga men potentiellt livshotande hud- och slemhinnereaktioner.
Karbamazepin är ett av de läkemedel som starkast associerar till ökad risk för dessa reaktioner.
Denna risk kan i hög grad kopplas till bärarskap av HLA-B*15:02-allelen, vilken är mer frekvent förekommande i vissa asiatiska folkgrupper.
Screening för HLA-B*15:02-allelen, eller val av annat läkemedel än karbamazepin och andra aromatiska antiepileptika, till personer med viss asiatisk härkomst rekommenderas.
Karbamazepin är sedan länge ett förstahandsmedel vid behandling av fokal epilepsi och trigeminusneuralgi, men används också vid alkoholabstinens, mani och bipolär sjukdom [1, 2]. Hudreaktioner av karbamazepin är inte ovanliga och incidensen anges till cirka 5–10 procent [2, 3]. Flertalet hudbiverkningar är lindriga och reversibla när behandlingen avbryts, men 1–10 per 10 000 drabbas av potentiellt livshotande överkänslighetsreaktioner såsom Stevens–Johnsons syndrom och toxisk epidermal nekrolys [4-6]. Mortalitetsrisken kan uppgå till 10 procent vid Stevens–Johnsons syndrom och över 50 procent vid toxisk epidermal nekrolys [2, 5, 6].
Risken för dessa reaktioner vid behandling med karbamazepin är betydligt högre för vissa etniska grupper där fler är bärare av specifika HLA-alleler; i första hand HLA-B*15:02 och i viss mån även HLA-A*31:01 [2]. HLA-B*15:02-allelen är vanligt förekommande hos personer med asiatiskt ursprung, speciellt vissa folkgrupper i Kina, Thailand, Malaysia, Indien, Indonesien, Filippinerna, Hongkong och Vietnam där prevalensen uppgår till 2–15 procent av populationen [2, 4, 7-10]. Detta att jämföra med < 1 procent hos personer med europeiskt ursprung [2].
Fallpresentation
En 32-årig tidigare frisk kvinna, adopterad från Indonesien, drabbades av ett oprovocerat, generaliserat epileptiskt anfall. Utredningen, inklusive MR-hjärna, visade normala värden och poliklinisk uppföljning planerades. Knappt 2 veckor senare fick patienten ett nytt generaliserat anfall, och EEG följande dag visade epileptiform aktivitet frontotemporalt på höger sida, vilket stödde diagnosen fokal epilepsi. Patienten påbörjade behandling med karbamazepin i upptrappande schema till måldosen 200 mg × 2. Elva dagar efter påbörjad behandling fick patienten mörkt rodnade, lätt kliande utslag i dekolletaget vilka snabbt bredde ut sig på bålen.
Då man misstänkte att kvinnan fått en läkemedelsreaktion ersattes karbamazepin med levetiracetam och hon blev inlagd på intermediärvårdsavdelning för övervakning. Dagen därpå uppträdde brännande känsla i huden, ögonen, munhålan och underlivet samt central blåsbildning i hudlesionerna. Patienten remitterades till hudklinik med frågeställningen om Stevens–Johnsons syndrom/toxisk epidermal nekrolys.
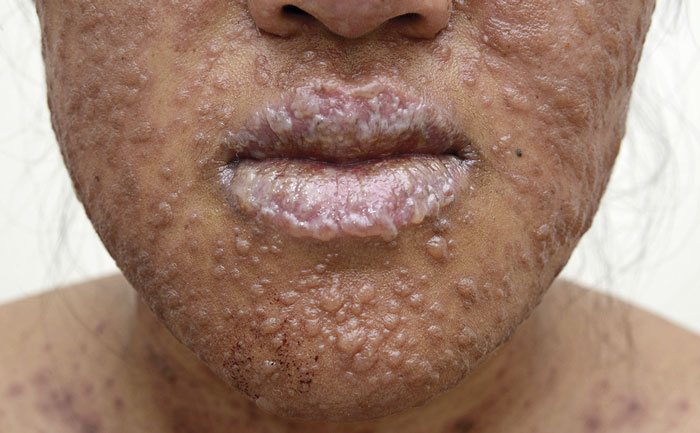
Vid ankomsten noterades i hudstatus rodnade kokarder med centimeterstora blåsor på övre del av bröst och rygg (Figur 1), blåröda makulae på armar, lår och underben, erosioner och blåsor på ögonlock, läppar och kinder (Figur 2), vita beläggningar i munslemhinnan, erosioner i underlivet samt rodnad av konjunktiva bilateralt. Omfattningen av blåsbildning beräknades till knappt 15 procent av kroppsytan överensstämmande med överlappande Stevens–Johnsons syndrom/toxisk epidermal nekrolys. Patienten hade takykardi och B-glukos 5,4 mmol/l, S-bikarbonat 21 mmol/l, urea 5 mmol/l, vilket motsvarade 2 poäng på specifik svårighetsskala för toxisk epidermal nekrolys, så kallad SCORTEN-skala (0–7) [11]. Behandling med intravenöst immunglobulin 1 g/kg kroppsvikt/dag inleddes. Patienten bedömdes av ögonläkare, öron-, näs- och halsläkare samt gynekolog. Hudbiopsier för histopatologi och direkt immunofluorescens togs. Blododlingen visade växt av Staphylococcus epidermidis och patienten insattes på vankomycin.
Efter ett dygn förvärrades patientens allmäntillstånd med temperaturstegring upp mot 40 grader och 15 procent manifest hudavlossning lokaliserat till ansikte, hals, armar och framsidan av bål och rygg, varför hon överfördes till Brännskadecentrum vid Akademiska sjukhuset i Uppsala. Hon behandlades för hypovolemi och xenograft (»pigskin«) lades på bål, rygg och armar. Patienten intuberades också på grund av hotad luftväg. På andra dygnet visade patienten tecken på svår sepsis och antibiotikabehandlingen utvidgades med piperacillin/tazobaktam. Hennes hudstatus stabiliserades på femte dygnet och hon extuberades på sjätte dygnet. Hon flyttades tillbaka till hudkliniken efter 12 dagars vård på Brännskadecentrum då såren var i läkningsfas men fortsatt täckta med xenograft. Genetisk analys under vårdtiden påvisade att patienten var bärare av HLA-B*15:02-allelen.
Patienten har efter behandlingen sequelae i form av omfattande hypo- och hyperpigmentering i huden. Intubationsperioden ledde till pares av vänster stämband och nervus hypoglossus med heshet och lindrig dysfagi. Avseende epilepsin är patienten hittills anfallsfri med levetiracetam sedan 7 månader.
Diskussion
Stevens–Johnsons syndrom/toxisk epidermal nekrolys
Stevens–Johnsons syndrom och toxisk epidermal nekrolys är del i samma kliniska spektrum av specifika cellmedierade överkänslighetsreaktioner som drabbar hud och slemhinnor. Gränsdragningen mellan dessa baseras på omfattning av hudavlossning; mindre än 10 procent av kroppsytan definieras som Stevens–Johnsons syndrom och >30 procent av kroppsytan som toxisk epidermal nekrolys, och däremellan som överlappande Stevens–Johnsons syndrom/toxisk epidermal nekrolys [2]. Tillstånden har en mortalitet som varierar mellan 3,2–90 procent beroende på utbredning och övriga riskfaktorer baserat på SCORTEN-skalan [11]. Toxisk epidermal nekrolys är mycket sällsynt (1–3 på en miljon och år), och i minst 80 procent av fallen misstänkt utlöst av läkemedel; övriga utlösande faktorer kan vara infektioner och idiopatiska reaktioner. Enligt VigiBase (WHO:s globala databas för läkemedelsbiverkningar) [12] är karbamazepin det femte vanligaste läkemedlet rapporterat vid toxisk epidermal nekrolys (Fakta 1).
Farmakogenetik och läkemedelsbiverkningar
Karbamazepininducerat Stevens–Johnsons syndrom och toxisk epidermal nekrolys är exempel på T-cellsmedierade, immunogent betingade läkemedelsreaktioner (typ B) enligt klassifikationen av läkemedelsbiverkningar [13, 14]. Medan typ A-biverkningar relaterar till läkemedlets farmakodynamiska egenskaper och är dosberoende och reversibla då medicineringen avbryts är typ B-biverkningar idiosynkratiska och kan inte förutspås utifrån läkemedlets farmakodynamik [14]. Forskning inom farmakogenetik har under de senaste åren gått starkt framåt, och allt fler immunogena läkemedelsbiverkningar kan kopplas till specifika HLA-alleler [15].
HLA-B*15:02-förekomst i olika befolkningsgrupper
HLA-B*15:02-allelen är speciellt en stark prediktor för karbamazepininducerat Stevens–Johnsons syndrom och toxisk epidermal nekrolys hos Han-kineser, taiwaneser, indier och malaysier [8, 16, 17]. En mindre stark association med HLA-B*15:02-bärarskap har påvisats i japanska, koreanska och europeiska befolkningar. En systematisk litteraturgenomgång från 2014 beskriver att 72–100 procent av patienter med karbamazepininducerat Stevens–Johnsons syndrom/toxisk epidermal nekrolys hade HLA-B*15:02, samtliga från Asien (Kina, Thailand, Malaysia och Indien), jämfört med 4–19 procent av de karbamazepinexponerade som inte utvecklade dessa reaktioner [2]. Evidensen för ökad risk för karbamazepininducerat Stevens–Johnsons syndrom/toxisk epidermal nekrolys bland bärare av HLA-B*15:02 klassificerades som stark [2]. Också för lamotrigin och fenytoin finns Stevens–Johnsons syndrom/toxisk epidermal nekrolys beskrivet hos bärare av HLA-B*15:02. Detta antyder att HLA-B*15:02 kan vara en riskallel för hela gruppen av aromatiska antiepileptika [17].
Även HLA-A*31:01 har ådragit sig intresse som riskmarkör. HLA-A*31:01 identifieras hos 2–5 procent av européer och 10 procent av japaner och Han-kineser [3]. Den är mindre starkt kopplad till Stevens–Johnsons syndrom/toxisk epidermal nekrolys men innebär predisposition för andra allvarliga läkemedelsreaktioner med hudutslag, multipel organpåverkan och eosinofili, så kallat DRESS-syndrom (drug reaction with eosinophilia and systemic symptoms) och andra hypersensitivitetssyndrom [2, 3, 15, 17].
Rekommendationer för screening av HLA-B*15:02
Internationellt har risken för Stevens–Johnsons syndrom/toxisk epidermal nekrolys lett till rekommendation om genetisk testning av patienter med ursprung från länder med hög prevalens av HLA-B*15:02 [2, 10]. Screening före insättande av karbamazepin är i dag etablerad rutin i flera länder i Asien. I en studie från Hongkong var kostnadseffektiviteten av en sådan screening motsvarande den för mammografi eller gynekologisk cellprovtagning [18]. Vid påvisat bärarskap av HLA-B*15:02 rekommenderas val av annat läkemedel än karbamazepin, och även andra aromatiska antiepileptika såsom till exempel oxkarbazepin, fenytoin, fenobarbital och lamotrigin bör helst undvikas [2].
I Europa inklusive Sverige är förekomsten av HLA-B*15:02 så låg att allmän screening inför start av karbamazepin inte ansetts motiverad. I Sverige finns tydliga rekommendationer i Fass gällande genetisk testning för HLA-B*15:02 hos patienter med asiatiskt ursprung, i första hand Kina, Thailand, Malaysia, Filippinerna och Indien [19]. Vår patient har sitt ursprung i Indonesien, som tillsammans med Hongkong och Vietnam tillhör de länder där genetisk testning av HLA-B*15:02 inför insättning av karbamazepinbehandling rekommenderas enligt internationell litteratur [2].
Sammanfattning
Stevens–Johnsons syndrom och toxisk epidermal nekrolys är mycket allvarliga sjukdomstillstånd med hög mortalitet och morbiditet. Risken att drabbas av karbamazepininducerat Stevens–Johnsons syndrom eller toxisk epidermal nekrolys är betydligt högre för personer med asiatiskt ursprung, vilka oftare är bärare av HLA-B*15:02. Förekomsten av HLA-B*15:02-bärarskap i Sverige beräknas till < 1 procent, och allmän screening inför insättande av karbamazepin med syfte att undvika dessa reaktioner har hittills inte ansetts indicerad.
Med ökad migration och adoption vill vi uppmärksamma att personer med ett etniskt ursprung från Asien (främst Kina, Thailand, Malaysia, Filippinerna, Indien, Indonesien, Hongkong och Vietnam) bör genomgå genetisk testning för HLA-B*15:02 innan karbamazepinbehandling inleds. Vid påvisat bärarskap ska behandling med annat preparat än aromatiska antiepileptika väljas för att minska risken för dessa potentiellt livshotande läkemedelsbiverkningar.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. De vanligaste läkemedlen som rapporterats i samband med toxisk epidermal nekrolys. Källa: VigiBase (WHOs globala databas för läkemedelsbiverkningar).
1. Allopurinol
2. Trimetoprim–sulfametoxazol
3. Paracetamol
4. Fenytoin
5. Karbamazepin
6. Furosemid
7. Lamotrigin
8. Acetylcystein
9. Ibuprofen
10. Ciprofloxacin