Lemierres syndrom kännetecknas klassiskt av tonsillit, trombos i vena jugularis interna samt septiska lungembolier. Ofta har patienten också sepsis. Sjukdomen drabbar framför allt yngre personer i åldern 15–25 år.
Effektiv antibiotikabehandling kopplad till kirurgisk lokal behandling (source control) över tid är fundamental i handläggningen.
Sen diagnos och behandling ökar risken för komplicerat vårdförlopp.
God kunskap om syndromets kliniska kännetecken i hela vårdkedjan, inte minst i primärvård, är viktig för att i tid väcka misstanken.
Det är väsentligt att ha Lemierres syndrom i åtanke vid svår oklar tonsillit hos yngre vuxna.
Lemierres syndrom är ovanligt, men kan orsaka svår sepsis hos framför allt yngre, tidigare friska individer. Den preantibiotiska eran gav värdefull erfarenhet av sjukdomens kliniska progressiva förlopp vilket finns publicerat i ett flertal fallrapporter och väl sammanfattat av Riordan 2007 [1]. I dag är fatal utgång sällsynt, men tidig upptäckt och adekvat behandling är alltjämt av stor vikt för sjukdomsförloppet [2-4]. Med utgångspunkt från en fallpresentation diskuteras här vikten av kunskap om syndromet, möjliga diagnostiska verktyg, behandling samt värdering av vital organfunktion i hela vårdkedjan.
Fallbeskrivning
En tidigare frisk 16-årig flicka inkom till Hudiksvalls sjukhus på grund av en veckas tilltagande halsont, feber och andningssvårigheter. Hon hade tidigare sökt husläkare där tillståndet bedömts som körtelfeber. Vid ankomsten noterades en klinisk bild som vid svår sepsis med RLS (Reaction level scale) 1, andningsfrekvens 60 andetag/min, saturation 85 procent på luftandning, systoliskt blodtryck 80 mm Hg, puls 110 slag/min och temperatur 40,1 oC. Detta motsvarar 13 poäng i bedömningsskalan NEWS (National early warning score) som används vid sjukhuset. Vidare noterades rodnat svalg, lätt förstorade tonsiller och uttalad palpationsömhet på halsen. Monospot- och streptokock A-test var negativa, men CRP var 373 mg/l och LPK 11,3 × 109/l. Efter blod- och svalgodling gavs en första dos cefotaxim. Flickan överfördes till intensivvårdsavdelning för cirkulations- och andningsstöd.
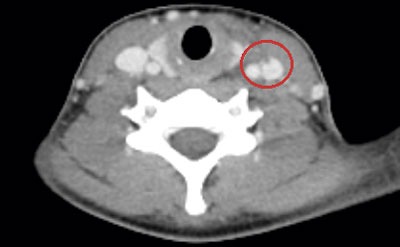
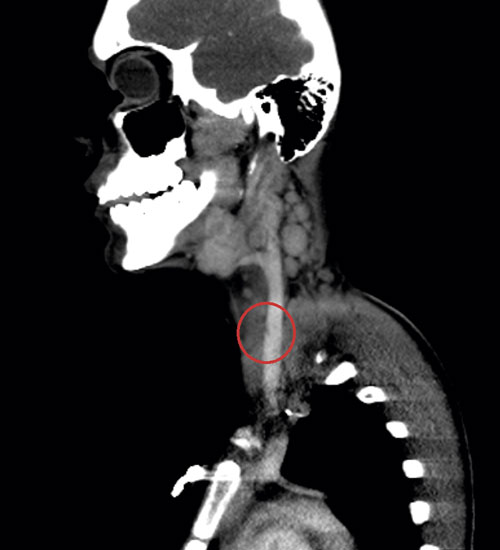
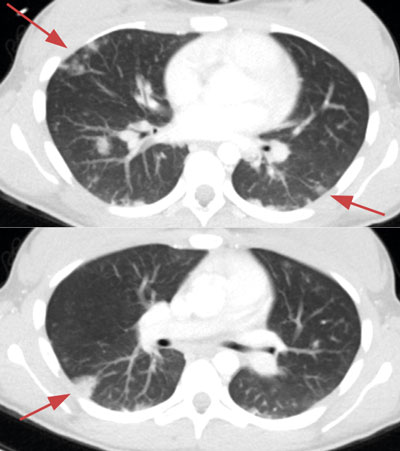
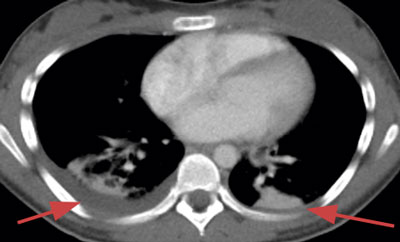
Initialt var diagnosen oklar, men på grund av misstanke om nekrotiserande fasciit i halsområdet gavs trippelbehandling med meropenem, klindamycin, och metronidazol. Tanken på Lemierres syndrom väcktes då datortomografi (DT) av hals och torax visade begynnande trombotisering av vena jugularis interna på vänster sida och embolisering till lungorna (Figur 1 och 2). Diagnosen bekräftades då blododlingar visade växt av Fusobacterium necrophorum i två av fyra flaskor. I svalget växte streptokocker grupp C eller G (slutlig speciesbestämning saknades). Anaerob odling utfördes inte då specifik frågeställning om F necrophorum inte angavs. Serologin av Epstein–Barr-virus (EBV) visade på genomgången primärinfektion. Dalteparin gavs initialt men sattes ut då senare DT-undersökning inte visade progress av trombosen i jugularisvenen, men däremot tillkomst av pleuravätska (Figur 3). Flickan vårdades på barnavdelning från dygn sex. Där gavs behandling med bensylpenicillin och metronidazol intravenöst. Hon skrevs ut till hemmet med peroral klindamycinbehandling. DT-kontroll (hals, torax) i samband med återbesök en månad senare visade normala förhållanden, varför klindamycin avslutades. Hon mår nu bra.
Diskussion
Lemierres syndrom beskrevs av André Lemierre, som i originalpublikationen betonar vikten av klinisk observation och att diagnosen är förhållandevis »enkel« [5]: »Symtomen utgör ett syndrom så karaktäristiskt att misstag är nästan uteslutet« (fritt översatt). Syndromet är allvarligt med potentiella komplikationer, och mortalitetssiffror på upp mot 5 procent finns beskrivna i litteraturen [6].
Bakteriologi och patogenes
F necrophorum är en obligat anaerob gramnegativ stav med exotoxinproduktion och binder till plasminogen som aktiveras till plasmin på bakterieytan vilket kan underlätta bakterieinvasion [7, 8]. Kolonisering med F necrophorum i svalget är vanligt i yngre åldrar och givet samverkan av andra bidragande faktorer kan Lemierres syndrom utvecklas. Sådana faktorer kan vara avsaknad av immunitet och barriärskada till följd av samtidig virus-/annan bakteriesjukdom [9].
Jugularisvenengagemang ingår per definition i syndromet, men prevalensen av makroskopiskt påvisbar trombos är sannolikt mindre än 50 procent. Mekanismen bakom trombosbildning är oklar. Närheten från tonsillregionen via parafaryngeala rummet till halskärlen bidrar säkerligen men det finns fallrapporter med trombotisering på andra lokaler. Bidragande är uppenbarligen prokoagulativa förhållanden vid invasiv växt av F necrophorum, exempelvis interaktioner med faktorer inom den humorala koagulationen [10], dito med trombocyter och endotelceller samt kraftig inflammatorisk reaktion [9].
Ett samband med Epstein–Barr-virus har diskuterats [11], men i en studiepopulation från södra Sverige har detta inte kunnat verifieras. Såväl Epstein–Barr-virusinfektion som underliggande trombofili var ovanligt [12].
Diagnostik
Det kliniska förloppet sker över tid, och misstanken om Lemierres syndrom bör väckas vid svår oklar halsinfektion hos yngre friska personer (Fakta 1). Diagnosen baseras på klinisk misstanke, verifiering av ventrombos och septiska lungembolier samt växt av F necrophorum i blod [13]. Makroskopisk ventrombos kan i många fall inte påvisas direkt utan indirekt i form av septiska lungembolier.
Ultraljud eller DT används för att kartlägga venengagemang, där DT är att föredra eftersom det medger samtidig bedömning av både lungförändringar och kärlavsnitt oavsett förhållande till ekoskymmande strukturer samt vilka av halsens spatier som är engagerade, vilket påverkar infektioners spridningsmöjligheter [14]. Uppföljning kan ske med ultraljud och lungröntgen.
Vanliga laboratoriefynd är trombocytopeni, kraftigt förhöjt CRP och LPK samt förhöjt kreatinin och bilirubin [7, 9].
Vanligaste etiologi är F necrophorum [13], men även andra fusobakterier och anaeroba bakterier som peptostreptokocker och Bacteroides samt aerober har beskrivits. Vanligen påvisas dessa med blododling. Man kan diskutera med sitt lokala laboratorium om fusobakterie-polymeraskedjereaktion eller riktad fusobakterieodling på selektivt medium ska utföras på svalg som ett komplement till blododling. Färska data visar att F necrophorum är en betydelsefull anaerob patogen vid faryngotonsillit i åldrarna 13–40 år [15].
Behandling
Tidig diagnos och antibakteriell behandling är viktig för att hindra fortsatt förlopp med pågående embolisering och fjärrmetastasering (till exempelvis leder och CNS). F necrophorum är alltid känslig för metronidazol och vanligen känslig för parenterala penicilliner, cefalosporiner samt klindamycin. Vid intrakraniellt engagemang är cefotaxim eller meropenem att föredra, men annars rekommenderas penicillin G + metronidazol alternativt penicillin G + klindamycin, där tillägget av metronidazol eller klindamycin teoretiskt ger bättre penetration in i abscesser [16, 17].
Lämplig varaktighet av antibiotikatillförsel har diskuterats i litteraturen och beror på svårighetsgrad, intrakraniellt engagemang, abscesser och kliniskt svar, men 4–6 veckors behandlingstid är ofta nödvändig [9, 11]. Denna tid behövs för att eradikera infektionen, inte minst beroende på endovaskulärt nedslag.
Lungengagemang är vanligt med fynd av septiska embolier och pleural effusion med hotande eller manifest respiratorisk insufficiens. Fjärrmetastasering/hematogen spridning kan ge annan vital organpåverkan (exempelvis lever, njurar, CNS). Pleuravätska kan tillta liksom lungabscesser eller andra nedslag. Därför är effektiv antibiotikabehandling kopplad till kirurgisk lokal behandling (source control), såsom dränage eller spolning, nödvändigt.
Behandling med lågmolekylärt heparin vid associerad trombos är kontroversiell. Vissa författare rekommenderar detta baserat på fallrapporter från bäckenlokaliserade septiska tromboser, men entydiga data saknas. Det kan övervägas vid total ocklusion av vena jugularis interna eller sinustrombos, dock med beaktande av kontraindikationer.
Flertalet patienter har svår sepsis per definition och kan liksom vår patient vara intensivvårdskrävande. Holm et al presenterade tidigare 33 fall av Lemierres syndrom i Sverige, varav 26 uppfyllde kriterierna för svår sepsis [12]. Tid från symtomdebut var starkt kopplad till svårighetsgrad och distalt nedslag.
Vikten av initial och fortlöpande värdering av vitalparametrar kan inte nog betonas (t ex med hjälp av NEWS, National early warning score, vilket troligen minskar risken för underskattning av allvarlighetsgraden vid exempelvis Lemierres syndrom) [18]. Vid svår sepsis och septisk chock är kort tid till första antibiotikados parallellt med stöd av vitala funktioner utslagsgivande för prognosen [3].
Seymour et al fann i en nyligen publicerad studie samband mellan fördröjd antibiotikabehandling och ökad dödlighet i samhällsförvärvad sepsis. Tid från den första sjukvårdskontakten till när antibiotika gavs var mest utslagsgivande (P < 0,01) [19].
Sammanfattning
Sammanfattningsvis är Lemierres syndrom ett allvarligt tillstånd med ibland långvarigt och komplicerat förlopp. God kunskap om sjukdomen är viktig för att möjliggöra tidig misstanke, diagnostik och behandling, och vid septisk påverkan ges antibiotika snarast efter ankomst till behandlande enhet. Att fortsatt studera förekomsten av asymtomatiskt bärarskap av F necrophorum, liksom dess patogena betydelse från tonåren till 40 års ålder, kunde vara intressant som underlag till riktlinjer för primärdiagnostik. Vi föreslår även en diskussion angående svalgodlingar där man i dag enbart fokuserar på betastreptokocker. Det kunde vara av värde att oftare, kanske rutinmässigt, i en yngre åldersgrupp diagnostisera även anaeroba patogener. Fynden skulle kunna ge information för framtida behandlingsrekommendationer vid svår icke streptokockorsakad tonsillit hos för övrigt friska yngre personer.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även författarintervjun med Jan Hedenmark
FAKTA 1. Misstänk Lemierres syndrom vid
- halsont och negativt streptokock A-test,
- smärta och svullnad i käkvinkeln samt palpabel kärlsträng på halsen förenlig med jugularisventrombos eller lokal svullnad på hals/nacke och uttalad palpationsömhet på halsen,
- taky-/dyspné,
särskilt hos yngre patienter med påverkad vital organfunktion.