Fettembolisyndrom är ett ovanligt och i många fall letalt tillstånd som är associerat med trauma eller kirurgi. Det skiljer sig från vanliga fettembolier som ses vid de flesta långa rörbensfrakturer men som är mer begränsade i sin omfattning och mindre allvarliga.
Fettembolisyndrom är en symtomtriad med andningsinsufficiens, neurologisk påverkan och petekier.
Fettembolisyndrom är en uteslutningsdiagnos.
Incidensen av fettembolisyndrom hos vuxna är högre än hos barn, bland annat beroende på benmärgens lägre fetthalt hos barn under 10 år.
Barn med Duchennes muskeldystrofi har en klart ökad risk för fettembolisyndrom, även jämfört med vuxna.
Behandlingen av fettembolisyndrom är understödjande, någon riktad behandling finns inte.
Duchennes muskeldystrofi ingår i gruppen dystrofinopatier, orsakade av brist på eller nedsatt funktion av proteinet dystrofin. Dystrofin finns i skelettmuskulatur, i glatt muskulatur, till viss del i centrala nervsystemet och i hjärtmuskulatur. Dystrofin förankrar cytoskelettet med det extracellulära matrix och stabiliserar på så vis cellväggen. Duchennes muskeldystrofi medför en progressiv muskelsvaghet och förekommer nästan uteslutande hos pojkar/män, då den ärvs X-bundet recessivt. Kognitiva och neuropsykiatriska svårigheter är vanliga hos pojkar med sjukdomen. I cirka 30 procent av fallen beror Duchennes muskeldystrofi på nymutationer i dystrofins stora gen.
Cirka 10–15 pojkar får diagnosen i Sverige årligen. Kvinnliga bärare av mutationen kan ha muskelsvaghet, muskelkramper och bristande fysisk uthållighet. Patienter med Duchennes muskeldystrofi har även risk att utveckla kardiomyopati och bör följas av kardiolog [1].
Diagnosen ställs ofta kring 2–3 års ålder då symtomen blir tydligare. Efter en sen gångdebut utvecklar pojkarna en vaggande gång, med en progredierande symmetrisk svaghet och svårigheter att resa sig från sittande till stående utan armarnas hjälp. En pseudohypertrofi av vadmuskulaturen ses ofta, liksom en uttalad ländlordos till följd av svag bäckenmuskulatur. I 80 procent av fallen påverkas hjärtat med framför allt ofta benigna takyarytmier samt dilaterad kardiomyopati. Hälften av patienterna över 12 år har en kardiomyopati. Den dilaterade kardiomyopatin hos barn med Duchennes muskeldystrofi skiljer sig gentemot den hos barn utan diagnosen såtillvida att kammarväggen är tunnare och mortaliteten på grund av kardiell orsak är högre [2, 3].
Någon bot för Duchennes muskeldystrofi finns inte i dag, men kortisonbehandling från ung ålder förbättrar muskelstyrkan och kan bevara gångförmåga i upp till 2 år. Behandlingen har dock många biverkningar [4].
Nya läkemedel som inriktar sig på att direkt påverka den genetiska avvikelsen finns att tillgå. Dessa är specifika och kan inte behandla alla patienter med Duchennes muskeldystrofi. Eteplirsen godkändes 2016 av FDA (Food And Drug Administration). Läkemedlet återställer den defekta avkodningen av Duchenne-genen genom att binda sig till premRNA så att det defekta exonet 51 hoppas över (»exon skipping«) vid mRNA-splitsning. Detta ger ett kortare men funktionellt RNA och protein bildas. Ataluren tros i stället fungera när felavläsningen av mRNA orsakas av ett stoppkodon och verkar genom att få ribosomen att strunta i stoppkodonet och fortsätta avläsningen av mRNA. Studier har ännu inte gett entydiga resultat när det gäller dessa läkemedels effektivitet, och med tanke på att behandlingskostnaden för ett barn är flera miljoner kronor per år väger hälsoekonomiska aspekter tungt. EMA (European Medicines Agency) har nyligen avslagit ansökan för eteplirsen emedan ataluren är ett godkänt läkemedel i Sverige, som dock inte täcks av läkemedelsförsäkringen [5, 6].
Individer med Duchennes muskeldystrofi som föddes på 1960- och 70-talen dog vid en medelålder av 16,7 år [7]. Förbättrad lungvård (BiPAP, hemrespirator), nutrition (införandet av gastrostomi), aktiv kardiell uppföljning (tidig insättning av betablockerare och ACE-hämmare m m) samt tidig skolioskirurgi har ökat livslängden betydligt, och medelöverlevnaden med mekanisk ventilation är nu närmare 30 år och kommer sannolikt att öka ytterligare [8]. Respiratorisk och cirkulatorisk svikt är fortfarande de vanligaste dödsorsakerna. För den intresserade rekommenderas översiktsartiklar om kliniska riktlinjer för behandling av Duchennes muskeldystrofi [9-11].
Fettembolisyndrom beskrevs 1873 hos en patient som avled efter en femurfraktur [12]. Genesen till fettembolisyndrom är oklar och flera teorier finns. Vissa menar att det intramedullära trycket ökar vid traumat och att fettpartiklar frisätts som stryper mikrocirkulationen, liknande det som sker vid cementering vid proteskirurgi. Vidare föreslås att lipasfrisättningen ökar vid trauma, vilket destabiliserar cirkulerande fettpartiklar, eller att traumat stimulerar en inflammatorisk process som frisätter fria fettsyror vilka inducerar en vaskulitbild [13, 14].
Fettembolisyndrom ses mest efter multitrauman, mindre trauman och elektiva ortopediska ingrepp, framför allt i femur och bäcken. Så kallat icke-traumatiskt fettembolisyndrom har även setts efter benmärgstransplantation, pankreatiter och fettsugning [15]. Den sammantagna incidensen är oklar och varierar beroende på vilka kriterier som används.
Gurd et al har tagit fram kriterier för att avgränsa fettembolisyndrom (Fakta 1), då inga patognomona karakteristika finns [16]. Tillståndet kan imitera andra diagnoser, till exempel lungemboli, aspiration, epileptiska kramper och stroke, varför den initiala utredningen ofta riktas därefter. Svårighetsgraden hos fettembolisyndrom varierar men reaktionen kan leda till multiorgansvikt. Behandlingen är understödjande av vitala funktioner.
Fettembolisyndrom är mycket sällsynt men ses i ökad frekvens vid Duchennes muskeldystrofi [17, 18]. Den beskrivna incidensen varierar mellan 1 och 22 procent hos patienter med Duchennes muskeldystrofi och frakturer i långa rörben [14].
Som förklaring har stillasittande samt ökad osteoporos- och frakturrisk vid kortisonmedicinering diskuterats. Vidare gör den ökade fettinlagringen i benmärgen som kortisonbehandlingen ger att dessa barns benmärg blir mer lik en vuxens.
Fallbeskrivning
Vår patient är en 15-årig pojke som vid 2 års ålder fick diagnosen Duchennes muskeldystrofi. Han bor hemma med föräldrar och två syskon, går i vanlig skola och sitter sedan 13 års ålder i rullstol. Sedan 5 års ålder behandlas han med kortikosteroider, men han har inga vårdtillfällen kopplade till respiratorisk dysfunktion eller kardiovaskulär försämring. Ultraljudskardiografi 6 månader före det aktuella vårdtillfället visade möjligen en lindrig pulmonalisinsufficiens, men ingen annan patologi. Han har inga kognitiva problem, men uttalade fysiska funktionsnedsättningar; han kan äta med sin ena arm stöttande den andra, är rullstolsburen och måste ha hjälp vid alla förflyttningar.
En dag ramlade pojken ur sin rullstol på skolgården och slog i båda knäna men inte huvudet. När pappan hämtade honom klagade han på knäsmärta och hade lite skrapsår på höger knä.
Efter att han lagt sig på kvällen tittade pappan till honom med jämna mellanrum. Klockan 22 var pojken inte kontaktbar, hade en ojämn andning och pappan kunde inte känna någon puls. Under vägledning av SOS Alarm påbörjade pappan HLR i väntan på ambulans. Vid ankomst till hemortssjukhuset var patienten medvetandesänkt (RLS 4), gravt andningspåverkad (andningsfrekvens 45) och hypoxisk (SaO2 67 procent) men hade bärande rytm. Han hade haft urin- och faecesavgång och uppvisat tecken till kramp, varför han behandlades med bensodiazepiner. Patienten intuberades och flyttades till IVA på universitetssjukhuset.
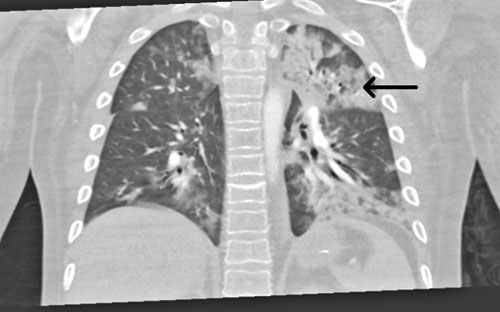
Vid ankomst till IVA var han svår att syresätta (FiO2 [inandad syrgasfraktion] på 80 procent) men cirkulatoriskt stabil. Patientens ordinarie läkare var bakjour det aktuella dygnet. Fettembolisyndrom misstänktes med tanke på den kliniska bilden. Lungröntgen tolkades initialt som påvisande aspiration. Datortomografi (DT) av lungartärer på misstanke om lungemboli (Figur 1) samt en DT av skalle på misstanke om fettemboli gjordes. Datortomografin av lungartärer bedömdes som aspirationspneumoni, och den sämre kontrastfyllnad som ses i enstaka subsegmentella artärer i både höger och vänster lunga tolkades i första hand som flödesbetingad och antibiotika sattes in. DT av knän bilateralt visade odislokerade typ 2-frakturer enligt Salter–Harris frakturklassifikation (Figur 2 A och B), som gipsbehandlades.
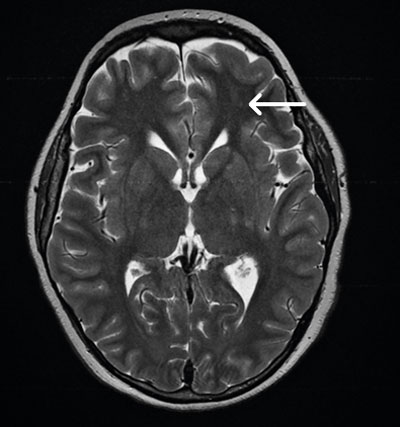
En uppföljande MR-undersökning av hjärnan visade multipla punktformiga förändringar med diffusionsinskränkning bilateralt i frontalloberna, parietalt och superiort i vänster occipitallob i vit substans, subkortikalt och kortikalt (Figur 3). Bilden bedömdes som fettembolisering. Vid eftergranskning av DT lungartär bedömdes de subsegmentella förändringarna i samtliga lunglober också som förenliga med fettembolisyndrom.
Patienten vårdades på IVA under 5 dygn. Efter att initialt ha krävt uttalat andningsstöd (FiO2 på 80 procent) och med en klinisk bild som vid ARDS (adult respiratory distress syndrome) förbättrades han dag 2 (FiO2 kunde sänkas till 45 procent). Som inotropt stöd krävdes initialt noradrenalin (0,15 µg/kg/min), vilket kunde sättas ut dag 2. Dag 4 extuberades han på IVA men behölls där med beredskap för reintubation och titrering av smärtlindring i ett dygn. Därefter vårdades han på en barnneurologisk avdelning tills han 13 dagar efter insjuknandet skrevs ut till hemmet i sitt habitualtillstånd.
Vid uppföljning ett par månader senare mådde han bra och bedömdes som helt återställd.
Diskussion
Om en patient med Duchennes muskeldystrofi skadas bör man ha den ökade risken för fettembolisyndrom i åtanke. Skulle en patient med Duchennes muskeldystrofi söka vård med andningspåverkan, medvetandepåverkan och petekier, även efter mindre trauma, bör DT av torax och MR av hjärna med inriktning mot fettembolisering genomföras. Då behandlingen är understödjande kan dock differentialdiagnoser som kräver mer riktad behandling från start behöva utredas först.
Viss evidens, om än svag, finns för behandling av fettembolisyndrom med kortikosteroider. Om patienten behandlats med kortison för sin muskeldystrofi måste även substitutionsbehandling ges i det akuta skedet. Understödjande behandling för att undvika hypovolemi och hypoxi innebär att fettembolisyndrom vid Duchennes muskeldystrofi är en intensivvårdsindikation. Frakturer bör stabiliseras inom ett dygn med en metod som tar hänsyn till patientens övriga tillstånd.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Gurds kriterier för fettembolisyndrom. Minst ett huvudkriterium och fyra tilläggskriterier krävs för diagnos.
Huvudkriterier
- Axillära eller subkonjunktivala petekier
- Hypoxi
- Medvetandesänkning som är oproportionerlig till hypoxin
- Lungödem
Tilläggskriterier
- Takykardi
- Retinaförändringar (petekier eller fett)
- Urinpåverkan (anuri, oliguri, fettglobuler)
- Plötsligt tapp i Hb eller TPK
- Hög SR (erytrocytsedimentationshastighet)
- Fettglobuler i sputum
(uppdaterad 2020-02-12)