Termen NMO (neuromyelitis optica) har ersatts med termen NMOSD (neuromyelitis optica-spektrumtillstånd; neuromyelitis optica spectrum disorders) enligt nya diagnostiska kriterier.
Diagnosen NMOSD kan numera ställas även om patienten inte har haft engagemang av vare sig optikusnerven eller ryggmärgen.
Area postrema, kräkcentrum, är en preferentiell lokalisation vid NMOSD.
NMOSD bör övervägas som differentialdiagnos vid fall av refraktär hicka/kräkningar utan gastroenterologisk förklaring och bör utredas skyndsamt med MR av hjärnan.
Försening av diagnos kan leda till mera allvarliga manifestationer, framför allt transversell myelit, vilken kan förebyggas med korrekt behandling.
Neuromyelitis optica (NMO) är ett inflammatoriskt CNS-syndrom skilt från multipel skleros (MS). Det beskrevs initialt 1894 och betraktades traditionellt som en monofasisk sjukdom med bilateral optikusneurit och samtidig transversell myelit [1]. Både optikusneuriten och myeliten beskrivs typiskt som allvarligare än dem man normalt ser vid MS och med mer restsymtom som följd. Myeliten vid NMO har en typisk utbredning på mer än 3 kotsegment i höjdled, s k longitudinellt extensiv transversell myelit, vilket är en mycket atypisk manifestation av MS-myelit [1].
Fall av recidiverande förlopp beskrevs på 1900-talet, och i dag vet vi att syndromet vanligtvis går i skov (dock beskrivs 5–10 procent av fallen som monofasiska [1]).
Intresset för syndromet ökade markant 2004 när det upptäcktes att majoriteten av patienter med NMO har serumautoantikroppar riktade mot vattenkanalen akvaporin-4 (AQP4-IgG), vilka uppvisade hög specificitet för NMO [2]. Akvaporin-4 uttrycks företrädesvis på astrocyternas fotutskott och ependym; det senare förklarar en del av lesionernas preferentiella utbredning [3].
Möjligheten att analysera AQP4-IgG hjälpte till att bredda det kliniska och radiologiska spektrumet av NMO. 2007 introducerades termen »neuromyelitis optica spectrum disorders« (NMOSD) (neuromyelitis optica-spektrumtillstånd) för att inkludera AQP4-IgG-seropositiva patienter med begränsade former av NMO (t ex den första attacken av isolerad transversell myelit) [4].
2015 publicerades nya diagnostiska kriterier där International Panel for NMO Diagnosis (IPND) beslutade att förena NMO och NMOSD under en term, NMOSD, med tanke på att kliniskt förlopp, immunpatogenes och behandling inte skiljer mellan de två grupperna [1]. Seropositivitet för AQP4-IgG spelar stor roll för den diagnostiska säkerheten.
Man rekommenderar i dag testning med cellbaserade analyser (mikroskopi eller flödescytometri), eftersom sensitiviteten är högre än med indirekt immunfluorescens av vävnadssnitt (IIF) och ELISA (enzymkopplad immunadsorberande analys) [1]. Analys av ΑQP4-IgG kan beställas hos avdelningen för klinisk immunologi på de flesta universitetslaboratorier eller hos Wieslab AB (Lund). Medelvärde för sensitivitet är 76,7 procent för cellbaserade analyser, 62,8 procent för IIF och 64 procent för ELISA [5].
Kriterierna tillåter för första gången NMOSD-diagnos för patienter som inte har haft engagemang av vare sig optikusnerven eller ryggmärgen [1] (Fakta 1).
Area postrema – ett NMOSD-selektivt mål
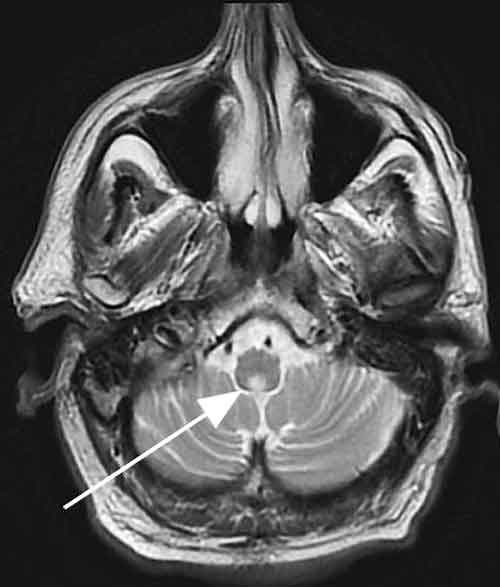
Area postrema består av två symmetriska strukturer lokaliserade dorsalt i medulla oblongata på den infero-posteriora delen av fjärde ventrikeln. Området anses vara kräkcentrum. Fjärde ventrikelns medullära golv och area postrema innehåller rikligt med AQP4 och är därför en sannolik lokalisation för NMOSD-lesioner [6].
I en neuropatologisk studie av hjärnbiopsier från 15 patienter med NMOSD, 5 patienter med MS och 8 friska personer uppvisade 6 patienter med NMOSD, men inga patienter med MS eller friska individer, unilaterala eller bilaterala lesioner som involverade area postrema och fjärde ventrikelns medullära golv [6]. De fynden tyder på att area postrema kan vara ett selektivt mål vid NMOSD och överensstämmer med kliniska fall där illamående/kräkningar föregått episoder med optikusneurit eller transversell myelit [6].
Area postrema saknar täta endoteliala cellförbindelser, och därför är centrala nervsystemet lätt tillgängligt för cirkulerande IgG-antikroppar i detta område. Area postrema är ett av de mest kärlrika cerebrala områdena; samtidigt sänks blodflödet av speciella perikapillära »pooler« av interstitiell vätska, vilket resulterar i en lokalt ökad exponering för cirkulerande ämnen [7]. Den endoteliala penetrationen och samtidigt försenad clearance av NMOSD-IgG leder eventuellt till att en väldigt hög koncentration bevaras kring astrocyternas fotutskott lokalt. På det sättet kan en ökad utsatthet för AQP4-ΙgG-inducerad patofysiologi uppstå i area postrema [6].
Fallbeskrivning
Vi rapporterar här ett fall där hicka och kräkningar var den enda manifestationen av första NMOSD-attacken. En 74-årig man med hypertoni och tablettbehandlad diabetes mellitus typ 2 sökte på akutmottagningen på grund av kräkningar och diffus yrsel sedan ungefär 1 vecka.
Rutinblodprov var normala förutom ett avvikande natriumvärde på 116 mmol/l (referensintervall 137–145 mmol/l). Patienten behandlades med hydroklortiazid för sin hypertoni, och detta misstänktes som eventuell orsak till hyponatremin. Patienten blev inlagd med rekommendation om utsättning av hydroklortiazid samt vätskekarens. Alla symtom bedömdes kunna förklaras av hyponatremin, men fullständigt nervstatus och undersökning med DT-angiografi av hjärnan gjordes ändå och båda utföll utan avvikelser.
På avdelningen rapporterade patienten att han även hade haft kontinuerlig hicka de senaste dygnen. Yrseln och kräkningarna förbättrades markant i samband med den successiva ökningen av S-natrium, men hickan kvarstod. Därför gjordes även en datortomografi av buken, vilken också utföll utan anmärkning. Ingen säker etiologi till hickan kunde hittas, och patienten skrevs ut 1 vecka senare när S-natrium var på acceptabel nivå. I detta skede konsulterades ingen neurolog.
Patienten sökte ånyo 2 veckor senare på akutmottagningen eftersom kräkningarna återkom bara något dygn efter utskrivningen och han inte hade kunnat behålla vare sig mat eller dryck. Natriumvärdet var denna gång helt normalt. I detta skede konsulterades en kirurg som rekommenderade gastroskopi, som också utföll utan avvikelser.
Neurolog konsulterades efter totalt 1 månad från första besöket på akutmottagningen. Klinisk misstanke om NMOSD uppstod då, och en MR-undersökning av hjärnan och bestämning av akvaporin-4-antikroppar i serum beställdes. MR-hjärna visade högsignalerande förändringar i nedre spetsen av fjärde ventrikeln, sannolikt omfattande area postrema (Figur 1), och serumanalys påvisade positivitet för AQP4-IgG. Patienten ville inte genomgå lumbalpunktion, vilket heller inte är nödvändigt för diagnostiken. Förekomst av oligoklonala band i cerebrospinalvätska är ett atypiskt fynd vid NMOSD och återfinns hos <20 procent av NMOSD-fall men >90 procent av MS-fall [1].
Enligt de nya diagnostiska kriterierna kunde diagnosen NMOSD ställas (Fakta 1).
Patienten behandlades på basis av klinik och MR-fynd med metylprednisolon 1 gram intravenöst i 3 dagar, varpå hans besvär upphörde momentant.
Diskussion
Detta fall demonstrerar vikten av att överväga NMOSD-diagnos när en patient uppvisar refraktär hicka/kräkningar. Diagnosen bör vara känd inom alla internmedicinska/kirurgiska specialiteter med tanke på att patienter med hicka/kräkningar i de flesta fall bedöms av internmedicinare eller kirurg och inte av neurolog. Diagnosen är lätt att missa i detta tidiga skede, vilket kan leda till försening av behandling och risk för mera allvarliga NMOSD-manifestationer (t ex blindhet/paraplegi).
Enligt de nya diagnostiska kriterierna är area postrema-syndrom (episod av annars oförklarad hicka eller illamående och kräkning) inkluderat som ett av de kliniska huvudsymtomen (Fakta 1) [1]. I en nyligen publicerad analys av 100 patienter som sammanlagt uppvisade 157 attacker av area postrema-syndrom var detta det första symtomet hos 54 av patienterna [8]. 64 attacker inträffade utan andra neurologiska symtom och 91 attacker föregick ett traditionellt NMOSD-skov (optikusneurit/transversell myelit) med ett medianintervall på 10 dagar (0–90) [8]. Den första bedömningen gjordes av en gastroenterolog för 44 av patienterna. Dessa genomgick gastroskopi och datortomografiundersökning av buken [8], exakt som vår patient.
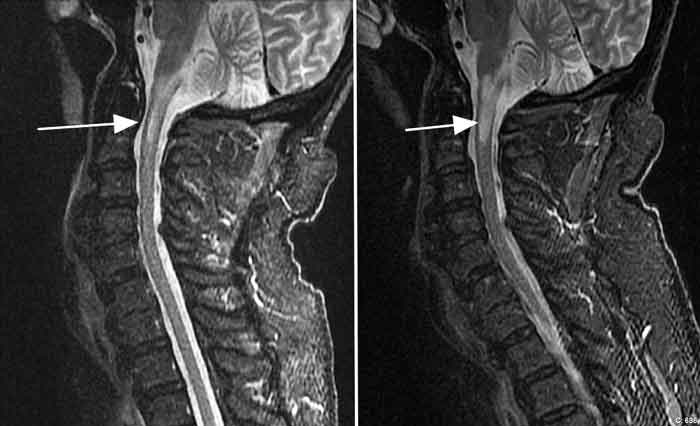
Area postrema-syndrom kan således vara en viktig varningssignal för nära förestående tvärsnittsmyelit eller svår optikusneurit. Behandlingsrefraktär hicka eller illamående/kräkningar utan gastroenterologisk förklaring bör därför utredas skyndsamt med MR av hjärnan. Vår patient utvecklade myelitsymtom (Figur 2) ungefär 3 månader efter den initiala perioden med hicka/kräkningar (tyvärr vägrade han förebyggande immunterapi när han hade symtom enbart från area postrema). I samband med detta insattes förebyggande behandling med rituximab, och patienten har inte haft flera recidiv av sin sjukdom därefter.
Hicka/kräkning som beror på NMOSD svarar generellt dåligt på symtomatisk behandling (t ex primperan), men immunterapi (metylprednisolon, plasmaferes) resulterar i snabb regress av symtom [8].
Kort om behandlingen
Sequelae sekundära till NMOSD beror på ackumulerade skador under de akuta skoven snarare än ett progressivt förlopp, varför prevention av recidiv har terapeutisk prioritet [9]. Behandlingen består av hantering av akut skov för att begränsa dess skada och förebyggande av NMOSD-skov genom långsiktig immunsuppression. Det finns enstaka randomiserade prospektiva studier [10], men ingen ger klass 1-evidens avseende förebyggande behandling av NMOSD. Behandlingsrekommendationer baseras således huvudsakligen på kohortstudier och fallserier [11, 12].
Akut standardbehandling vid en första NMOSD-attack eller ett recidiv är högdos metylprednisolon intravenöst (1 gram/dag i 3–5 dagar). Om patienten inte svarar kliniskt har plasmaferes visats vara effektiv [11]. Angående förebyggande behandling rekommenderas immunsuppressiv behandling med i första hand azatioprin eller rituximab, i andra hand mykofenolatmofetil, metotrexat eller mitoxantron och i tredje hand IL-6-inhibition med tocilizumab [12].
Inte heller duration av förebyggande behandling är tillräckligt studerad. AQP-4-seropositiva patienter som bara har haft en NMOSD-attack bör behandlas med immunsuppression i 5 år; dock är denna tidsgräns ungefärlig [11]. För patienter med recidiverade sjukdom rekommenderas immunsuppression tills vidare [11]. I Sverige används numera vanligen rituximab i första hand vid konstaterad NMOSD. Studier som jämför de olika regimerna och avgör den optimala förstahandsbehandlingen emotses.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Diagnostiska kriterier
NMSOD med AQP4-IgG
- Åtminstone ett kliniskt huvudsymtom
- Positivt test för AQP4-IgG
- Uteslutning av alternativa diagnoser
NMSOD utan AQP4-IgG eller okänt AQP4-IgG-status
- Åtminstone två kliniska huvudsymtom under en eller flera kliniska attacker; även alla nedanstående punkter måste uppfyllas:
– åtminstone ett kliniskt huvudsymtom måste vara optikusneurit, akut transversell myelit eller area postrema-syndrom
– spridning i rum
– uppfyllande av ytterligare MR-krav (se nedan)
- Negativt test för AQP4-IgG eller test inte tillgängligt
- Uteslutning av alternativa diagnoser
Kliniska huvudsymtom
- Optikusneurit
- Akut myelit
- Area postrema-syndrom: episod av annars oförklarad hicka eller illamående och kräkning
- Akut hjärnstamssyndrom
- Symtomatisk narkolepsi eller symtomatiskt diencefaliskt syndrom med NMOSD-typiska diencefaliska MR-lesioner
- Symtomatiskt cerebralt syndrom med NMOSD-typiska lesioner
Ytterligare MR-krav för NMSOD utan AQP4-IgG eller okänt AQP4-IgG-status
- Akut optikusneurit: MR hjärna visar a) normala fynd eller ospecifika vitsubstansförändringar eller b) lesion som sträcker sig över hälften av optikusnervens längd eller engagerar chiasma opticum
- Akut myelit: associerad intramedullär MR-lesion som sträcker sig över ≥3 sammanhängande segment (longitudinellt extensiv transversell myelit) eller ≥3 sammanhängande segment med lokal ryggmärgsatrofi hos patienter med anamnes som stämmer överens med akut myelit
- Area postrema-syndrom: associerade lesioner i dorsala medulla/area postrema
- Akut hjärnstamssyndrom: associerade periependymala hjärnstamslesioner