Spontan kranskärlsdissektion är en underdiagnostiserad orsak till akut koronart syndrom.
Diagnosen ska misstänkas vid avsaknad av riskfaktorer för kranskärlssjukdom, framför allt hos kvinnor före och efter förlossning.
Akut kranskärlsröntgen bör utföras, vid osäkerhet kan intravasalt ultraljud eller optisk koherenstomografi övervägas.
Vid bibehållet koronarflöde är konservativ behandling att föredra på grund av ökad risk för komplikationer vid revaskularisering.
Hos patienter med bekräftad kranskärlsdissektion rekommenderas utredning av extrakoronar vaskulopati.
Spontan peripartumrelaterad kranskärlsdissektion bör handläggas av ett multidisciplinärt team bestående av både kardiolog och gynekolog.
Spontan kranskärlsdissektion kan beskrivas som spontan akut tillkomst av falskt lumen i ett kranskärl, varvid blodflödet försämras [1]. Tillståndet kan ge upphov till hjärtinfarkt, och plötslig död förekommer. Iatrogen dissektion eller dissektion orsakad av aterosklerotisk plackruptur räknas inte som spontan kranskärlsdissektion. Två mekanismer som orsak till spontan dissektion har föreslagits: primär skada på intiman med efterföljande dissektion eller ruptur av vasa vasorum med blödning i kärlväggen och dissektion som följd [2].
Epidemiologi
Eftersom underdiagnostisering förekommer är den exakta incidensen av spontan kranskärlsdissektion svår att fastställa [2]. Spontan kranskärlsdissektion ses hos 0,07–0,2 procent av dem som genomgår kranskärlsröntgen, för dem som genomgår kranskärlsröntgen till följd av akut koronart syndrom är motsvarande siffra 1,4–4 procent [1]. Peripartumrelaterad kranskärlsdissektion utgör 10 procent av fallen av spontan kranskärlsdissektion [1, 3]. Det föreligger en kraftig överrepresentation av kvinnor, över 90 procent av samtliga fall [4, 5]. I en studie var spontan kranskärlsdissektion i 8,7 procent av fallen orsaken till akut koronart syndrom hos kvinnor yngre än 50 år [3].
Riskfaktorer
Graviditet innebär förhöjd risk, och flerbörd, fertilitetshormoner och preeklampsi kan ytterligare öka risken [6]. Spontan kranskärlsdissektion kan förekomma före förlossning, tidigt post partum (inom 6 veckor), sent post partum (6 veckor till 12 månader efter förlossning) och mycket sent post partum (12–24 månader efter förlossning).
Östrogen- och progesteronnivåer ökar under graviditeten, vilket leder till strukturella förändringar i kärlets media; kollagensyntesen minskar, andelen mukopolysackarider i median ökar liksom mediadegenerationen, vilket orsakar försvagad kärlvägg och inflammatoriska processer, däribland periadventitiell eosinofili [4, 6].
Det finns en koppling mellan spontan kranskärlsdissektion och specifika tillstånd: fibromuskulär dysplasi, hyperlipidemi, diabetes mellitus typ 2, systemisk lupus erythematosus, vaskuliter och andra bindvävssjukdomar. Det finns också beskrivningar i samband med extrem Valsalvas manöver, isometriska övningar och emotionell stress [1, 2, 7].
Symtom och klinik
Patienter med spontan kranskärlsdissektion söker vanligen vård på grund av symtom som vid akut koronart syndrom. Drygt hälften (56 procent) inkommer med ST-höjning, en fjärdedel (26 procent) som icke-ST-höjningsinfarkt, men även ventrikulära arytmier förekommer hos uppemot 10 procent [1]. Bröstsmärta och andfåddhet är de vanligaste symtomen (60–90 procent) (Fakta 1). Nästan alla patienter har förhöjda troponinnivåer [1, 8]. Hjärtinfarkt utan kranskärlsocklusion (myocardial infarction with nonobstructive coronary arteries, MINOCA) förklaras i 1,7–4 procent av fallen av spontan kranskärlsdissektion [2].
Utredning
Vid spontan kranskärlsdissektion är bästa referensmetod kranskärlsröntgen [1, 2]. Dock har undersökningen sina begränsningar: en tvådimensionell angiografi ger ingen detaljerad information om kärlväggen [2]. I stället kan arteriell väggstruktur kartläggas med intravaskulärt ultraljud eller ännu hellre optisk koherenstomografi. Dessa metoder ska dock användas med försiktighet, eftersom de kan förvärra pågående dissektion [2, 7].
Den vanligaste angiografiska klassifikationen av spontan kranskärlsdissektion är den s k Saw-klassifikationen [2, 7]:
- Typ 1: klassisk intima-flik med tydligt dubbellumen och kvarvarande kontrastmedel i kärlväggen (29–48 procent av fallen).
- Typ 2: lång diffus förträngning i kärlet (52–67 procent av fallen).
- Typ 3: fokal, stenosliknande förändring i kärlet (0–3,9 procent av fallen).
- Typ 4: totalocklusion av kärlet.
Kranskärlsdissektion uppstår i det vänstra främre nedåtstigande kranskärlet i 45–61 procent av fallen, i cirkumflexa kranskärlet i 15–45 procent och i det högra kranskärlet i 10–39 procent av fallen [2, 9]. Hos patienter med bekräftad kranskärlsdissektion rekommenderas utredning av extrakoronar vaskulopati. Det finns för närvarande begränsade data om användningen av datortomografi med angiografi (multislice computed tomography coronary angiography, CTCA) för att diagnostisera spontan kranskärlsdissektion. Metoden har fördelen av att vara icke-invasiv, men den är begränsad i sin upplösning, som har särskild betydelse för att kunna bedöma mellersta och distala delarna av kranskärlen [10, 11].
Behandling
Det saknas randomiserade kontrollerade studier och tydliga behandlingsriktlinjer vid spontan kranskärlsdissektion, men faktorer som dissektionens lokalisation, antal affekterade kärl och patientens kliniska status vägs in [1, 12, 13]. Det finns ofta goda skäl att behandla konservativt, eftersom majoriteten av fallen stabiliseras spontant [1].
Tyvärr medför perkutan koronarintervention (PCI) betydande komplikationsrisker. I en retrospektiv studie från Mayo-kliniken bedömdes PCI som lyckad i endast 57 procent av fallen [5, 14]. Vanliga komplikationer utgörs av bl a iatrogen dissektion, passage av ledare till falskt lumen, stentning i falskt lumen, persisterande distal dissektion och sidogrensocklusioner [1, 7].
Med tanke på ökad risk för komplikationer i samband med PCI hos patienter med kranskärlsdissektion har ett antal mindre konventionella interventionsmetoder rapporterats: användning av ballongangioplastik (plain old balloon angioplasty, POBA) och förlängd stentlängd för att minska risker för proximal eller distal blödning i kärlväggen [1]. Kranskärlsbypass används ibland, antingen efter ett misslyckat försök med PCI eller vid komplicerande lokalisation av dissektionen (huvudstamsdissektion), vilket utgör en riskfaktor för komplikationer vid PCI eller konservativ behandling [1]. Revaskularisering med PCI eller kranskärlsbypass förefaller inte minska risken för återkommande kranskärlsdissektion [5]. Trombolys anses vara kontraindicerad [15].
Trombocythämmande behandling är fortsatt kontroversiell hos patienter med spontan kranskärlsdissektion. Detta på grund av en konflikt mellan etablerade behandlingsstrategier vid akuta koronara syndrom och risken att trombocythämmare kan förvärra ett tillstånd vars primära patofysiologi kan vara en intramural blödning. Majoriteten av aktuella rekommendationer föreslår dock trombocythämning (till och med dubbel trombocythämning) i akut fas och fortsatt behandling under begränsad tid. Patienter med spontan kranskärlsdissektion kräver individualiserad handläggning. Ofta rekommenderas de som genomgår PCI 12 månaders dubbel trombocythämning [1].
En nyligen genomförd multivariatanalys från en prospektiv kohortstudie rapporterade ett samband mellan högt blodtryck och ökad risk för återkommande spontan kranskärlsdissektion. Betablockad minskar risken för återfall [1, 7]. Spontan peripartumrelaterad kranskärlsdissektion bör hanteras av ett multidisciplinärt team bestående av både kardiolog och gynekolog.
Sammanfattning
Spontan kranskärlsdissektion ska misstänkas vid akut koronart syndrom och avsaknad av riskfaktorer för aterosklerotisk kranskärlssjukdom. Kranskärlsröntgen kan ofta fastställa diagnosen, men ibland krävs intravasalt ultraljud eller optisk koherenstomografi. Tillståndet är överrepresenterat hos kvinnor, framför allt under peripartumperioden.
Potentiella bindningar eller jävsförhållanden: Peter Magnusson har erhållit föreläsararvoden från Abbott, Alnylam, Bayer, Boehringer Ingelheim, Medtronic, Novo Nordisk och Pfizer.
Fakta 1. Fallbeskrivning
En 36-årig kvinna som 3 dagar tidigare hade fött sitt tredje barn drabbades akut av bröstsmärta med utstrålning i armarna och bak i ryggen samt andfåddhet. Smärtan satt mitt i bröstet och förvärrades vid ansträngning.
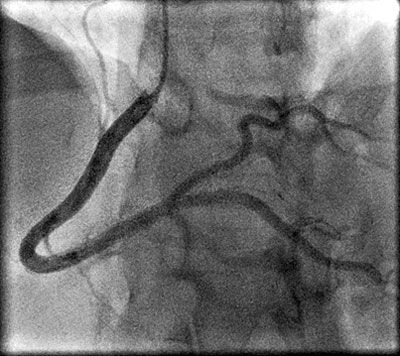
På EKG sågs T-vågsnegativiseringar i avledningarna II, III och aVF samt i V4–V6. Blodprov visade troponinläckage med dynamik: vid ankomst 89 ng/l, efter 3 timmar 297 ng/l och efter 9 timmar 139 ng/l) (referensvärde troponin T <15 ng/l). Patienten genomgick därför kranskärlsröntgen (Figur 1)och ekokardiografi, vilka visade normala fynd.
Undersökning med magnetresonanstomografi av hjärtat visade ett regionalt ödem midventrikulärt anteriort övergripande mer diffust anteroseptalt och anterolateralt. Sålunda uppstod misstanke om att det rörde sig om akut myokardit. Då patienten var välmående återgick hon till hemmet efter 4 dagar.
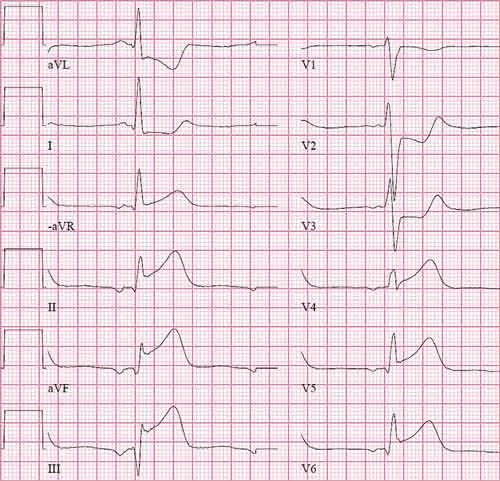
Dagen efter utskrivningen sökte patienten återigen på akutmottagning på grund av bröstsmärta. Denna gång påvisade EKG tydliga ST-höjningar i avledningarna II, III och aVF samt reciproka förändringar i avledningarna I och aVL (Figur 2).
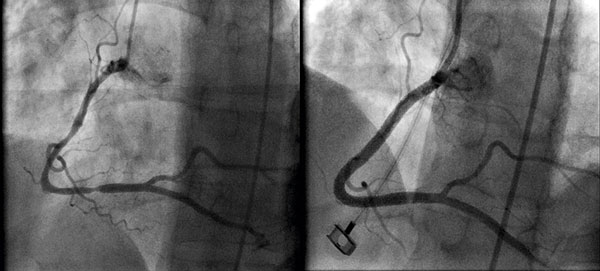
Patienten genomgick en akut kranskärlsröntgen, där höger kranskärl var klart förändrat jämfört med tidigare (Figur 3, till vänster). Från avgången fram till segment 3 såg kärlet tunnare ut, och det fanns vissa partier som var mer avsmalnade. Det gick dock inte att identifiera något tydligt dissektionsmembran eller dubbellumen.
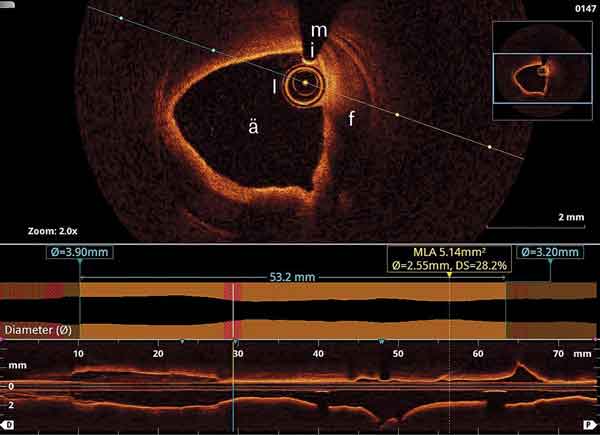
På grund av misstänkt kranskärlsdissektion utfördes optisk koherenstomografi (Figur 4), som visade misstänkt dissektion omfattande hela segmenten 1, 2 och 3 och att ledaren var i äkta lumen.
Detta bedömdes som spontan kranskärlsdissektion, vilken åtgärdades med tre läkemedelsstentar: i segment 3 anlades s k Promus Premier-stent 4,0 × 38 mm. Proximalt därom, omlott med denna, lades ytterligare Promus Premier-stent 4,0 × 28 mm och proximalt om denna, omlott, fram till ostiet av höger kranskärl anlades en Promus Premier-stent 4,0 × 24 mm.
Med stentballongen dilaterades ytterligare i området mellan de två sistnämnda stentarna. Ingreppet skedde komplikationsfritt och med gott slutresultat (Figur 3, till höger).
Förnyad ekokardiografi visade normalstor vänsterkammare med nedsatt väggrörlighet, framför allt inferoposteriort och septalt, global vänsterkammarfunktion bedömdes vara minst måttligt nedsatt med en ejektionsfraktion på 40 procent.
Sedvanlig hjärtsviktsbehandling sattes in med bisoprolol 2,5 mg (dosreducerad på grund av bradykarditendens) och kandesartancilexetil 4 mg samt dubbel trombocythämning i form av acetylsalicylsyra 75 mg och tikagrelor 90 mg × 2 i 1 år.
Uppföljande ekokardiografier visade förbättrad ejektionsfraktion på 50 procent men med nedsatt väggrörlighet posterioseptalt/inferiort/apikalt.
Efter 18 månader var patienten kliniskt välmående utan tecken till hjärtsvikt eller symtom på angina pectoris. Hon hade genomgått screening för fibromuskulär dysplasi med datortomografi av buken och bäckenet samt datortomografi med angiografi av hjärnan, vilka utföll invändningsfritt.