Visceral leishmaniasis är en allvarlig parasitsjukdom som utan behandling är dödlig.
Leishmania-parasiten finns i tropiska och subtropiska områden, som södra Europa, och överförs via bett från sandmyggan.
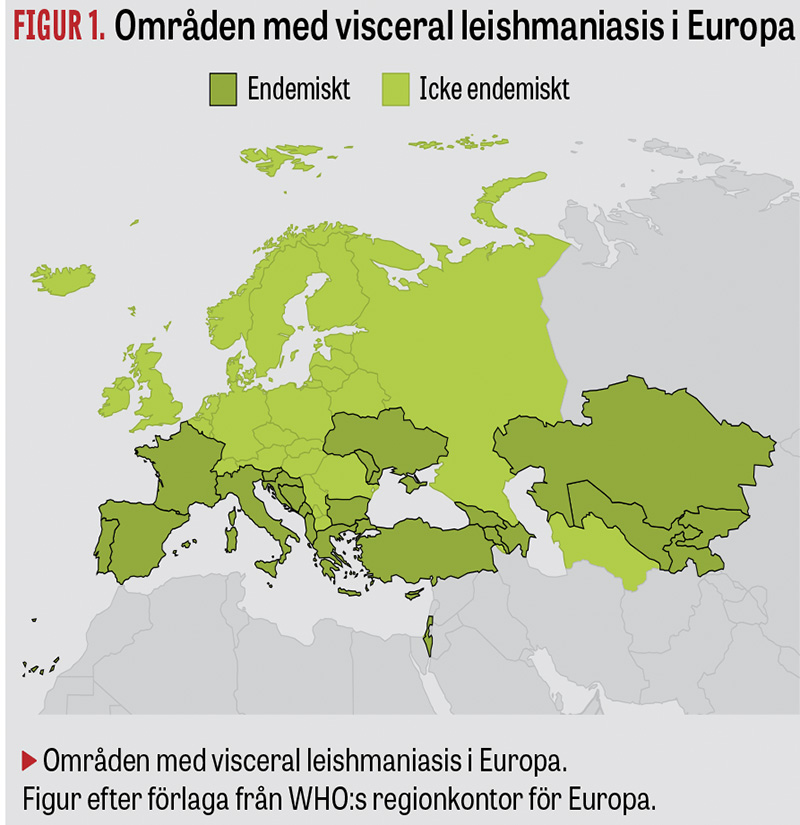
Vanliga resmål i Europa, såsom Spanien, Italien och Grekland, rapporterar årligen fall av visceral leishmaniasis.
Klimatförändringar leder till att nya områden med rätt livsbetingelser för sandmyggan tillkommer och riskerar att öka antalet leishmaniasisfall.
I Stockholm har vi under 2019 haft tre fall av visceral leishmaniasis hos barn under 3 år där samtliga varit i södra Europa. Kunskapen om denna parasitsjukdom i södra Europa behöver öka i den svenska sjukvården.
Med undantag för de senaste månaderna har resandet ökat år för år, och det har blivit allt lättare att resa bort med familjen. Då gör sig också gamla sjukdomar påminda. Infektionssjukdomar som vi mest kopplar ihop med fjärran länder finns även i vår relativa närhet, i Europa. Genom dessa tre patientfall vill vi belysa att parasitsjukdomen leishmaniasis är en realitet i södra Europa och att barn är en extra utsatt grupp.
Leishmaniasis är en endemisk parasitsjukdom som tillhör WHO:s bortglömda tropiska sjukdomar. Den orsakas av ett tjugotal olika subtyper inom släktet Leishmania [1]. Parasiten överförs genom bett av sandmyggan, som framför allt biter i gryning och skymning i tropiska och subtropiska områden. Sjukdomen finns rapporterad från 102 länder och områden, men sedan år 2000 har nya smittområden tillkommit. Flera faktorer påverkar den geografiska utbredningen, men varmare klimat tros gynna sandmyggans levnadsvillkor [2, 3].
De senaste åren har European Centre for Disease Prevention and Control (ECDC) rapporterat om en ökad spridning av sandmyggan i Europa (Figur 1), och antalet fall av leishmaniasis har ökat i endemiska områden i södra Europa [4]. Länder som Spanien, Italien och Grekland har en känd inhemsk spridning av leishmaniasis [5, 6], men nu ses också att antalet importfall till Sverige och norra Europa ökar [6].
Leishmania-parasiter uppvisar olika kliniska manifestationer beroende på subtyp och immunförsvaret hos den infekterade. Infektionen kan orsaka långvariga lokala sår (kutan leishmaniasis), destruktiva sår i slemhinnan i näsa, mun och svalg (mukokutan leishmaniasis) samt en generellt spridd sjukdom med feber, viktnedgång, hepatosplenomegali och påverkade blodvärden (visceral leishmaniasis) [1].
Flera diagnostiska metoder kompletterar varandra
Den kliniska diagnosen kan verifieras med olika diagnostiska analyser, men ingen av metoderna är hundraprocentig, utan de olika analyserna kompletterar snarare varandra. Om första provet är negativt men det fortsatt finns stark klinisk misstanke bör man analysera med ytterligare prov.
Direktmikroskopi används för att påvisa parasiten (amastigoten) med hjälp av Giemsafärgning i prov från hud, slemhinna, benmärg, mjälte, lever eller lymfkörtel beroende på klinisk manifestation. Metoden går snabbt att utföra, har hög specificitet och ger en uppskattning om hur mycket parasiter som finns, men känsligheten är beroende av att provtagningen är korrekt utförd och av erfarenheten hos mikroskopisten.
Molekylära metoder, som PCR (polymeraskedjereaktion) påvisar specifika DNA-sekvenser i parasitens arvsmassa och är en känsligare och mer specifik metod än direktmikroskopi, men också dyrare. PCR kan användas för att bestämma vilken subtyp patienten är infekterad med, men den kan inte användas för att bestämma mängden parasiter eller om de är viabla.
Genom att odla parasiten i specialmedium och på så sätt öka antalet parasiter kan man förbättra möjligheterna att påvisa och bestämma subtyp med molekylära metoder samtidigt som man får en uppfattning om parasitens viabilitet.
Påvisande av antikroppar riktade mot Leishmaniaparasiten i patientens blod kan ge information om aktuell eller nyligen genomgången infektion vid visceral leishmaniasis. Vid de andra kliniska formerna av leishmaniasis har serologi en sämre sensitivitet. Serologi har ett stort värde vid uppföljning efter behandling, då antikroppsnivåerna bör sjunka och slutligen försvinna. Sensitiviteten och specificiteten hos de serologiska testen är för låg för att de ska kunna användas som ensam diagnostisk metod i icke-endemiska länder. Serologiska »snabbtest«, där antikroppar mot subtyper av Leishmania-parasiten som orsakar visceral leishmaniasis mäts, används i endemiska områden som screeningmetod vid kliniska symtom. I endemiska områden har man sett att inte alla med antikroppar riktade mot parasiten insjuknar med symtom. Parasitinfektionen tycks då läka ut utan symtom, vilket betyder att inte alla som infekteras med parasiten blir sjuka [7, 8].
En souvenir från Solkusten
Under åren 2017–2018 uppmärksammades ett mindre utbrott av kutan leishmaniasis orsakad av Leishmania infantum bland svenska resenärer med reumatiska sjukdomar, där samtliga behandlades med biologiska läkemedel och hade varit på en rehabilitering i Spanien [9]. Den kliniska manifestationen var densamma som hos immunfriska individer; däremot såg man en fördröjd inkubationstid: upp mot 2–3 år jämfört med normalt inom 6 månader. Den förlängda inkubationstiden har rapporterats tidigare i liknande fall, hos personer som behandlas med biologiska läkemedel [10, 11].
En sällsynt diagnos i Sverige
Trots att leishmaniasis är en vanligt förekommande sjukdom globalt och orsakar lidande och dödsfall i stora delar av världen, är kunskapen ofta bristfällig i icke-endemiska länder och behandlingsmöjligheterna är begränsade. I Sverige diagnostiseras 5–8 patienter årligen, och vanligast är kutan leishmaniasis. Under perioden 1996–2016 diagnostiserades 156 fall med leishmaniasis där 94 procent utgjordes av kutan leishmanisis. Endast 2 patienter under denna period hade visceral leishmaniasis [12].
Här presenterar vi tre fall av visceral leishmaniasis. De tre patienterna är barn i åldern 1,5–3 år som samtliga har diagnostiserats med visceral leishmaniasis och behandlats och/eller följts upp i Stockholm under 2019. De tre barnen har vistats 2–4 veckor i södra Europa under sommar/höst 2017 och 2018. Inkubationstiden var 11–21 månader, vilket är längre än det som vanligtvis anges, 6–12 månader.
Fall 1. Akut leukemi hos ett infektionsdrabbat barn?
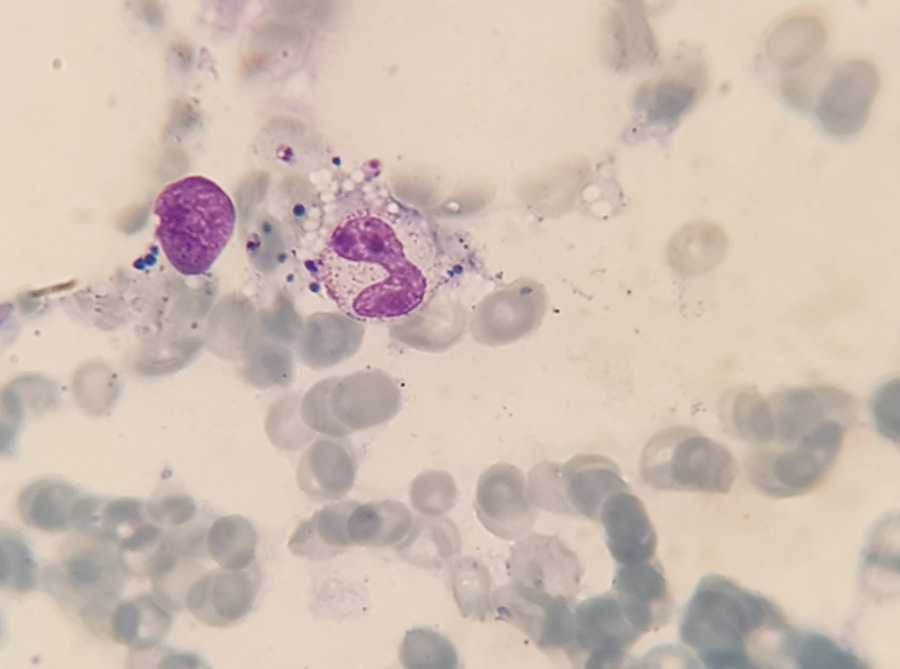
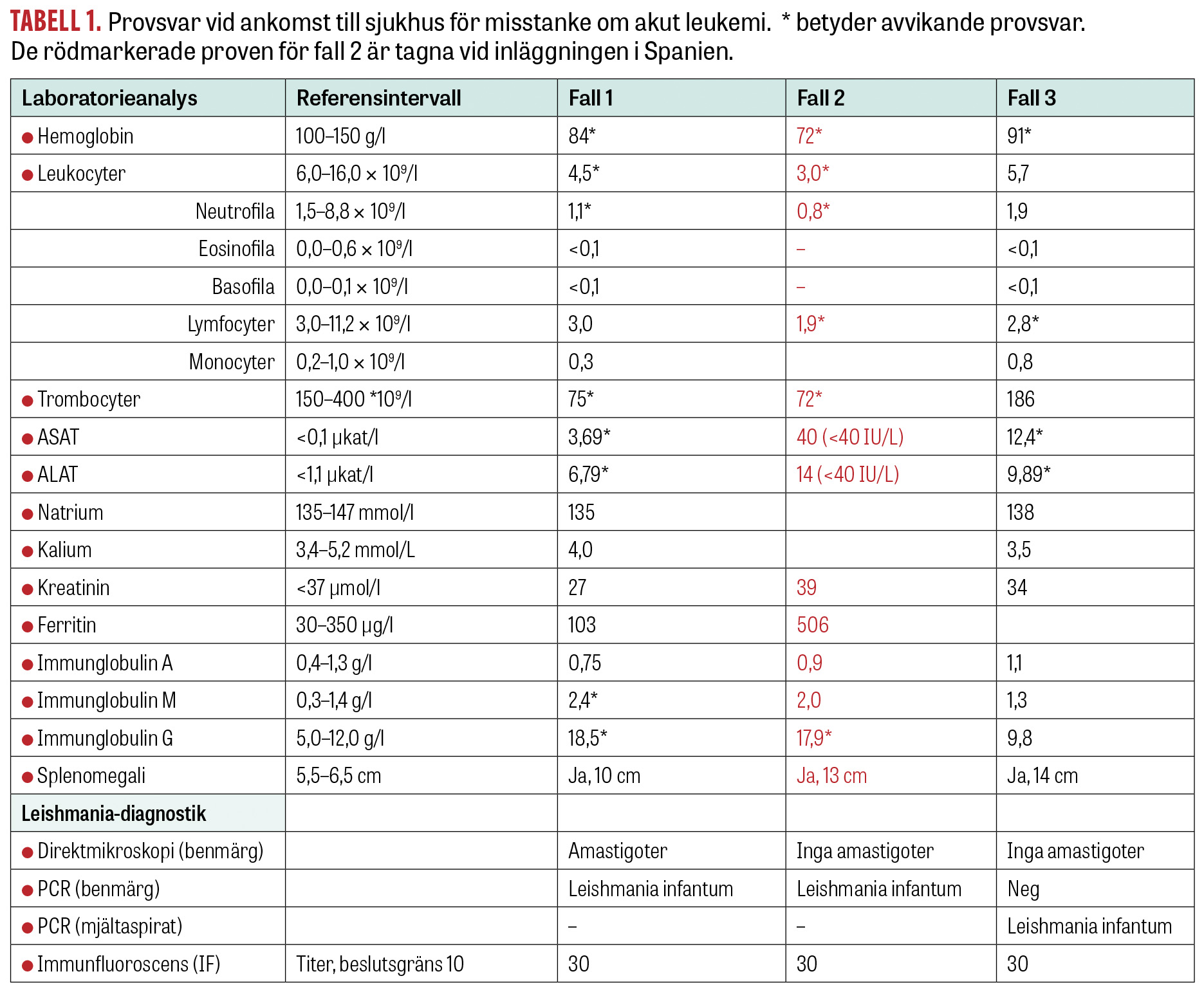
Den första patienten är en pojke som vid 15 månaders ålder insjuknade med vattkoppor och en efterföljande svår streptokocksepsis. Vid utskrivning uppmärksammades en mikrocytär anemi, och pojken ordinerades järnsubstitution. Månaderna efter streptokockinfektionen ändrades pojkens beteende, han blev mer tillbakadragen och försiktig, och i status fann man några månader senare en hepatosplenomegali. Trots behandling med järnsubstitution sjönk blodvärdet; till slut var blodbilden förenlig med en benmärgssvikt (Tabell 1) och han lades in för utredning för misstänkt akut leukemi eller lymfom på barnonkologisk avdelning. Pojken var vid det här laget trött och tagen. Vikten hade stått still under en längre tid. Förutom en benmärgssvikt sågs även ett inflammatoriskt påslag i blodprov och han uppfyllde kriterierna för hemofagocyterande lymfohistocytos. Vid fråga om utlandsvistelse de senaste månaderna sa föräldrarna nej. Utredning med benmärgsprov visade inga maligna celler, som vid leukemi eller lymfom. Man såg dock strukturer i makrofagerna som liknade amastigoter (Figur 2). Vid ny förfrågan om utlandsvistelse framkom att familjen varit på en gård i bergen utanför Malaga, Spanien, några veckor hösten 2017, då patienten var 8–9 månader gammal. Kompletterande serologiska prov för leishmaniasis var positiva, och PCR på benmärgsprov var positiv för Leishmania infantum (Tabell 1). Behandling inleddes med liposomalt amfotericin B, 3 mg/kg intravenöst dag 1–5 samt dag 14 och 21, och barnet blev snabbt både kliniskt och laboratoriemässigt förbättrat. Efterföljande immunologisk utredning har inte kunnat påvisa något avvikande i barnets immunförsvar.
Fall 2. Smittad utanför Malaga, insjuknar på Mallorca
Hösten 2017 åkte patient 2, en 8 månader gammal pojke, med föräldrarna på några veckors semester till ett hus på landsbygden i en mindre by utanför Malaga, Spanien. Ett och ett halvt år senare åkte familjen på nytt till Spanien, men denna gång till Mallorca. Redan första dagen på Mallorca fick pojken hög feber. Febern fortsatte, och efter några besök på den lokala vårdcentralen remitterades pojken till det regionala sjukhuset där blodprover togs. Blodbilden var avvikande (Tabell 1), och man misstänkte akut leukemi, varpå han flyttades till barnonkologiska kliniken på universitetssjukhuset i Palma de Mallorca för fortsatt utredning. Som en del av en normal utredning vid akut leukemi i Spanien utförs även diagnostik för leishmaniasis. Man såg inga synliga amastigoter i benmärgen, men benmärgsprovet var positivt i PCR för Leishmania infantum. Behandling med liposomalt amfotericin B påbörjades på plats, 3 mg/kg intravenöst dag 1–5 och dag 10. Patienten förbättrades redan under de första dagarna av behandlingen. Några dagar efter sista dosen på Mallorca följdes patienten upp på barninfektionsmottagningen vid Astrid Lindgrens barnsjukhus. Vid detta besök togs serologiska prover som var svagt positiva (Tabell 1). Patientens blodprover blev bättre, benmärgsproduktionen återhämtade sig, och allmäntillståndet återhämtade sig på några veckor. Utredning kring immunologisk sjukdom eller nedsatt immunförsvar har visat ett normalt immunförsvar hos pojken.
Fall 3. Smittad på ö i Italien
En 16 månader gammal pojke sökte i mitten av augusti 2019 med återkommande feberepisoder och försämrat allmäntillstånd. Han ville inte gå eller leka som tidigare, han hade blivit tröttare och hade ingen matlust. I prover fann man en avvikande blodbild (Tabell 1) och på ultraljud av buken sågs flera förstorade lymfkörtlar och hepatosplenomegali. Akut leukemi misstänktes, men benmärgsprovet visade inga maligna celler. Vid reseanamnes framkom att familjen varit på ön Elba i Italien september 2018 och på Sicilien i Italien juli 2019. Man kompletterade provtagningen med leishmaniasisdiagnostik med tanke på reseanamnes samt tidigare fall under året med visceral leishmaniasis. Man såg inga amastigoter vid direktmikroskopi av benmärgsprovet och PCR var negativ, men serologin var svagt positiv.
För att öka sensitiviteten på provmaterial gjordes en ultraljudsledd finnålspunktion av mjälten som var positiv i PCR för Leishmania infantum. Behandling med liposomalt amfotericin B påbörjades, 3 mg/kg intravenöst dag 1–5 samt dag 14 och 21. Pojken förbättrades snart i sitt allmäntillstånd, började åter leka och fick tillbaka matlusten. Dock kvarstår en betydande hepatosplenomegali, ett kraftigt ökat bukomfång, trots avsaknad av ascites, och förhöjda leverenzymer i skrivande stund flera månader efter avslutad behandling.
Diskussion
Genom att beskriva dessa tre patienter vill vi öka medvetenheten inom den svenska sjukvården om denna ovanliga men mycket allvarliga parasitsjukdom, som är vanligare i områden i södra Europa, dit många svenskar reser för en trygg semester, ofta med småbarn. Spanien ligger sedan flera år tillbaka på första plats på svenskarnas resetopplista [13] och ses ofta just som ett »säkert« resmål, en förlängning av Sverige. Många svenskar har också semesterhus i dessa områden. Inom sjukvården uppmärksammas ofta exotiska resmål vid reseanamnesen, medan länderna i södra Europa ofta glöms bort.
Sandmyggor är framför allt aktiva i gryning och skymning och infekterar när de suger blod. Historiskt har olika bekämpningsmedel, som exempelvis DDT, varit effektiva mot leishmaniasis i endemiska områden. I dag rekommenderas myggmedel och långärmad klädsel för att minska risken att bli biten av sandmyggan [14].
Barn i endemiska områden har en större risk att insjukna än vuxna. I Indien, Afrika och länder kring Medelhavet har visceral leishmaniasis mest drabbat små barn, i likhet med de fall vi beskriver här. Spanien beräknas ha en incidens av visceral leishmaniasis på 0,41 fall/100 000 invånare, och barn är den största gruppen; en tredjedel < 10 år, 19,3 procent < 5 år (1,9/100 000 personår) [15, 16]. Undernäring är i endemiska länder en bidragande orsak till försämrat immunförsvar. Mycket talar dock för att barns nedsatta cellulära immunförsvar medför högre risk att drabbas [17]. Efter småbarnsåldern minskar risken för insjuknande, och många som infekteras blir heller aldrig sjuka [18]. Har man en gång haft visceral leishmaniasis är man immun, liksom om man haft en asymtomatisk infektion [8, 19].
Bättre kunskap och snabbare diagnos
Vi tror att mörkertalet kring denna ovanliga sjukdom i Sverige är lågt, då differentialdiagnoserna främst är hematologisk malignitet som kräver snabb utredning. Ett benmärgsprov är av stor vikt i utredningen för båda diagnoserna, och parasiterna ses oftast i benmärgsprovet. Detta även om sensitiviteten i benmärgsprovet är något lägre, 85 procent, jämfört med mjältaspirat, 95 procent, vid visceral leishmaniasis [20], vilket illustreras i fall 3. Kännedom bland patologer om amastigotens karaktäristiska utseende i benmärgsutstryk är avgörande för att nå en snabb diagnos. PCR är en annan bra metod och kan upptäcka mindre mängd parasiter än direktmikroskopi. I de fall vi beskriver här fann man amastigoter vid direktmikroskopi i ett fall, medan samtliga var positiva i PCR. Olika material användes, benmärg och mjältaspirat, vilket påvisar vikten av att upprepa provtagningen om stark misstanke föreligger, även om första provet, benmärgsprovet, var negativt för direktmikroskopi och PCR, som i fall 3.
Samtliga tre beskrivna patienter hade endast svagt positivt serologiskt utfall (Tabell 1). Serologi har ett värde för att följa patienter som får behandling, då antikroppsnivåerna efter behandling bör sjunka och försvinna, vilket i skrivande stund hunnit ske i första fallet.
Med dessa fallbeskrivningar hoppas vi att visceral leishmaniasis, trots sin sällsynthet, inkluderas i differentialdiagnoserna till feber och avvikande blodvärden hos patienter som rest eller bott i södra Europa.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2020-07-08)