Q-feber är en svårdiagnostiserad sjukdom då symtomen ofta är ospecifika och varierande.
Kronisk Q-feber visar sig i regel som odlingsnegativ endokardit eller infektion i kärlgraft/aortaaneurysm.
Fördröjd diagnos och behandling är associerade med hög mortalitet.
Q-feberendokardit drabbar framför allt män över 40 år och patienter med preexisterande klaffsjukdomar inklusive klaffprotes, men även gravida och immunsupprimerade patienter har högre risk.
Q-feberendokardit bör misstänkas vid tidigare genomgången akut Q-feber efter vistelse i endemiskt område eller yrkeskontakt med får, getter och även nötboskap och symtom på endokardit, samt övervägas vid alla fall av blododlingsnegativ endokardit.
Q-feber (query fever) beskrevs första gången 1935 av Edward Derrick i Australien under ett feberutbrott hos en grupp slakteriarbetare. Sjukdomen är en global zoonos som orsakas av den intracellulära bakterien Coxiella burnetii [1].
Patienter med akut Q-feber varierar från att vara helt asymtomatiska (upp till 60 procent) till att ha influensaliknande symtom. Hepatit, atypisk pneumoni och myokardit förekommer. Kronisk Q-feber är den allvarligare formen och manifesterar sig framför allt som odlingsnegativ endokardit eller infektion i kärlgraft/aortaaneurysm [2].
Patientfall
I september 2017 inkom en man i 40-årsåldern till akutmottagningen på grund av ett par månaders anamnes med feber, frossa, lätt hosta, ledvärk, viktnedgång på 5 kg samt nattliga svettningar. Han hade ursprung i Mellanöstern och hade kommit till Sverige 2015. Han var rökare och hade obehandlad hypertoni. 2016 hade han opererats i Sverige med insättande av en biologisk aortaklaff på grund av aortainsufficiens. Redan i hemlandet hade det 2010 påbörjats en utredning av aortainsufficiens och eventuell systemisk lupus erythematosus.
Patienten blev inlagd för utredning av oklar inflammation. Provtagning visade förhöjt kreatininvärde på 150 μmol/l och CRP 60 mg/l. Vid inskrivningen noterades inga blåsljud på hjärtat. Ultraljud av njurar utföll normalt, men man fann en förstorad mjälte på 19 cm. DT av torax/buk visade gränsförstorade lymfkörtlar i torax, förstorad mjälte och en lågattenuerad zon i mjälten, vilket bedömdes vara förenligt med mjältinfarkt eller lymfom. Blododlingar med förlängd odlingstid togs. Transtorakal ekokardiografi (TTE) visade välfungerande aortaklaff, ejektionsfraktion (EF) på ca 60 procent och inga tecken på endokardit. Transesofageal ekokardiografi (TEE) avstods på grund av låg endokarditmisstanke och negativa blododlingar. S-elfores visade ospecifik inflammatorisk reaktion. Hiv-serologi och IGRA-test (interferon-gamma release assay) för tuberkulos (Quantiferon) utföll negativt. Under vårdtiden sjönk CRP och kreatininvärdet spontant och patienten förblev feberfri utan antibiotika. Patienten mådde väl och kunde skrivas ut. Vidare poliklinisk utredning med bland annat benmärgsbiopsi kunde inte påvisa någon hematologisk eller reumatologisk diagnos.
Patienten sökte ånyo akut i januari 2018 på grund av illamående och kräkningar i samband med varje måltid samt ytterligare viktnedgång på 4 kg. CRP var 63 mg/l, SR 59 mm och kreatininvärdet 204 μmol/l. Provtagning visade även mikrohematuri och lätt proteinuri. Inga blåsljud noterades vid hjärtauskultation. Njurbiopsi rekommenderades på grund av misstänkt nefrit, men patienten avböjde. Under vistelsen avklingade illamåendet, CRP halverades spontant utan antibiotika och kreatininvärdet sjönk till 171 μmol/l.
I mars 2018 inkom patienten med en veckas anamnes på hög feber, frossa, hosta, andningsbesvär och ansträngningsrelaterad bröstsmärta. EKG visade ett nyupptäckt vänstersidigt grenblock, och BNP (natriuretisk peptid av B-typ) var förhöjd till 1 466 ng/l. Han blev inlagd med telemetriövervakning och för ischemiutredning. Influensa A påvisades med PCR i nasofarynxprov; blododlingar visade ingen växt. Behandling sattes in med oseltamivir (Tamiflu). Patientens njursvikt hade försämrats ytterligare med ett kreatininvärde på 294 μmol/l. Patienten behandlades initialt med penicillin på grund av misstänkt lunginflammation. Han förbättrades dock snabbare än väntat, och CRP minskade från 59 till 34 mg/l vid utskrivningen. Kreatininvärdet minskade samtidigt till 240 μmol/l. Penicillinbehandlingen sattes ut i förtid och tillståndet bedömdes som enbart influensa. Vid utskrivningen planerades arbets-EKG, gastroskopi, då patienten även uppvisade anemi med Hb på 95 g/l, och njurmedicinsk uppföljning.
Patienten inkom återigen i april 2018 då han var ödematös och dyspnoisk. Han besvärades av buksmärta och hade försämrad njursvikt med kreatininvärde på 335 μmol/l. CRP var enbart lätt förhöjt till 47 mg/l. Kirurgiska åkommor kunde uteslutas efter kirurgbedömning. Kreatinin fortsatte att stiga till 572 μmol/l dagen efter, och man noterade stegrade levertransaminaser. Patienten genomgick TTE som visade nytillkommen nedsatt vänsterkammarfunktion med EF på enbart 15 procent. Nytillkommen var även en kraftig aortainsufficiens med stort läckage mot septum. Den kliniska bilden samt ultraljudsfynden väckte misstanke om eventuell protesavlossning. Patienten flyttades till IVA och erhöll akut dialysbehandling samt inotropi. Endokarditbehandling startades först med bensylpenicillin + tobramycin (Nebcina) vid misstanke om långdragen, lågvirulent och odlingsnegativ endokardit. Behandlingen byttes dagen därpå till cefotaxim + vankomycin. Patienten blev kvar på IVA en dag och fick sin hjärtsviktsbehandling optimerad. Han flyttades till torax-IVA på regionsjukhus och opererades dagen därpå.
Man konstaterade under operationen att protesavlossning samt ett paravalvulärt hål förelåg. Vid klaffborttagning hittade man även en stor aortarotsabscess. Nekrotisk vävnad avlägsnades medan patienten fick en aortarot-bioprotes (Freestyle aortic root bioprosthesis). Postoperativt fortsatte patienten att vara instabil, och trots fulla åtgärder fortsatte tillståndet att försämras med tilltagande hypoperfusion och tillkomst av extremitetsischemi. Dagen efter toraxoperationen avled patienten i sviterna av odlingsnegativ endokardit. Fyra vävnadsodlingar tagna under operationen visade negativt resultat. Bakteriespecifik PCR (16S rRNA-PCR), som utförs rutinmässigt av laboratoriet vid negativa klaffodlingar, visade fynd av bakterien Coxiella burnetii i 2 vävnadsprov, vilket resulterade i att man kunde ställa diagnosen Q-feber.
Fyndet medförde också att den första operationsberättelsen från 2016 eftergranskades. Peroperativt hade man då sett en trikuspid aortaklaff med kraftigt läckage samt dilaterad kammare. Toraxkirurgen hade noterat »här och var lite sklerotisk klaff och det finns ett litet förkalkat område. Har möjligen haft endokardit i detta område tidigare«. Vid toraxoperationen 2016 utfördes ingen PAD eller odling/PCR från den bortopererade aortaklaffen. Sammantaget kan patienten ha haft kronisk Q-feber med endokardit under flera års tid.
Klinik, diagnostik och behandling
Smitta med Coxiella burnetii sker främst via luftburen aerosol från kontaminerat djursekret, feces, placentavävnad och fostervätskor. Får, getter och nötboskap anses utgöra de viktigaste reservoarerna för C burnetii.
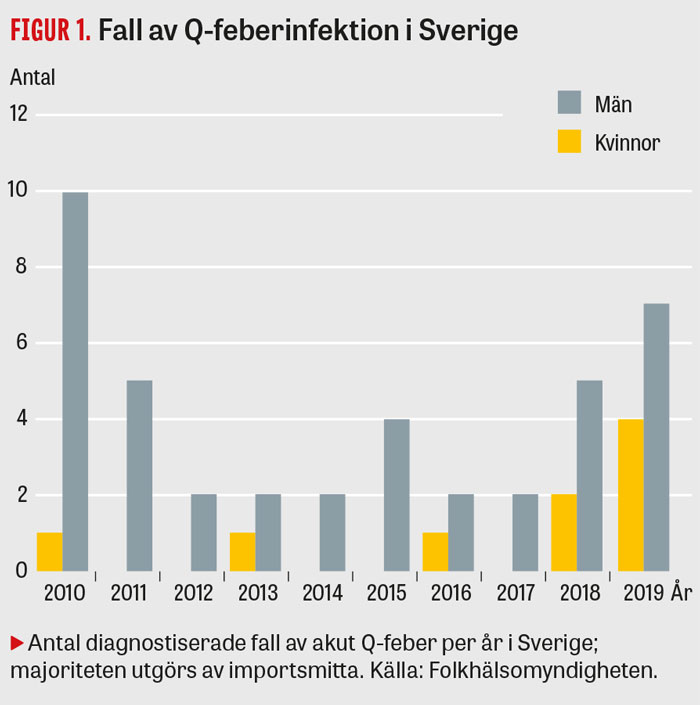
C burnetii-sporer är resistenta mot yttre påverkan, och spridning upp till ca 10 km med hjälp av starka vindar är möjlig. Boende nära djurbesättningar har därför också en ökad risk för smitta [3]. Endemiska utbrott förekommer, det största i Nederländerna 2007–2010 med över 4 000 patientfall med akut Q-feber [4]. Q-feber är endemisk i Mellanöstern. I Sverige diagnostiseras en handfull fall av akut Q-feber per år (Figur 1), och majoriteten utgörs av importsmitta [3].
Kronisk Q-feber med endokardit utvecklas hos upp till 5 procent av människor smittade med C burnetii. De viktigaste riskfaktorerna för utveckling av endokardit inkluderar hjärtklaffsjukdom. Risken för utveckling av endokardit efter en episod av akut Q-feber hos individer med hjärtklaffsjukdom är avsevärt ökad [5]. Kärlgraft och aneurysm ökar risken för vaskulärt engagemang. Andra riskfaktorer är graviditet, ålder ≥ 60 samt immunsuppression [6].
Utveckling till Q-feberendokardit kan ske månader till flera år efter en akut infektion. Mortaliteten är hög, och även med behandling har tillståndet en 10-årsdödlighet på 10–20 procent [7]. Q-feberendokardit angriper framför allt aorta- och mitralisklaffar [8].
Feber är det dominerande symtomet i 68 procent av fallen och är ofta låggradig och pendlande. Andra symtom är ospecifika och inkluderar viktnedgång, muskelvärk, trötthet, anorexi och nattliga svettningar. 67 procent av patienterna uppvisar akuta hjärtsviktssymtom i form av andfåddhet, lungödem, palpitationer och bröstsmärta [9].
Icke-kardiella manifestationer såsom splenomegali, trumpinnefingrar samt purpura, särskilt på extremiteter och slemhinnor, är vanligt förekommande. Njurengagemang yttrar sig som immunkomplex-glomerulonefrit [6]. Septiska emboliska manifestationer har observerats i upp till 20 procent av fallen och inkluderar stroke och embolisering i armar/ben [9]. Höga nivåer av kardiolipinantikroppar (aCL) är associerade med snabb progression från akut Q-feber till endokardit, vilket har prognostisk signifikans när det gäller profylaktisk behandling [10]. Övriga laboratoriefynd presenteras i Tabell 1.
Odlingar för C burnetii är negativa om inte specialteknik används (inte tillgänglig i Sverige). Diagnosen ställs som regel genom serologi. C burnetii existerar i två antigenfaser, fas I och fas II, och vid kronisk Q-feber är IgG-antikroppar mot fas I betydligt högre (vanligtvis ≥ 1:800) än antikroppar mot fas II. Höga nivåer av fas I-antikroppar kopplade till konstanta eller fallande nivåer av fas II-antikroppar är förenliga med kronisk Q-feber. Ett annat alternativ för diagnostisering är PCR för C burnetii av vävnad, exempelvis opererade hjärtklaffar men även blod [9].
TTE är en stöttepelare i diagnostisering av endokardit och bör ingå i den initiala utredningen. Vegetationer vid Q-feberendokardit är dock små eller saknas. Vegetationer ses endast hos ca 12 procent av patienterna. Andra eventuella fynd inkluderar förtjockning av klaff, förkalkningar, abscess, stenos och paravalvulärt läckage i protesklaff [6]. TEE har högre sensitivitet för att upptäcka vegetationer [11], men med den låga andelen vegetationer är även TEE av begränsat värde. PET/DT kan vara användbar i syfte att lokalisera infektionsfokus hos patienter med serologiskt bekräftad Q-feberendokardit [12]. Uppföljande PET/DT kan vara användbar vid komplikationer under antibiotikabehandling samt vid ställningstagande till behandlingsavslut [13].
År 2000 reviderades Duke-kriterierna för att inkludera Coxiella-serologi, med fas I-IgG-titer över 1:800 som ett huvudkriterium. Senaste åren har det tillkommit kriterier från Dutch Q Fever Consensus Group [14]. De sistnämnda har ökad sensitivitet i diagnostisering av kronisk Q-feber samt är det enda system som ger rekommendationer när det gäller behandling och uppföljning [15]. I Sverige utförs Coxiella-serologi av Folkhälsomyndigheten baserad på ELISA. Positiva resultat bekräftas med MIF (mikroimmunfluorescens). Antikroppsbestämning med MIF kan även användas för uppföljning av patienter samt utvärdering av behandling [16].
Behandlingen av kronisk Q-feber är komplicerad med långa behandlingstider, förekomst av biverkningar och hög återfallsrisk efter avslutad antibiotikatillförsel. I dag är standardregimen doxycyklin 100 mg × 2 i kombination med hydroxiklorokin 200 mg × 3 dagligen. Denna kombination möjliggör kortare behandlingstid och minimerar återfallsrisken [17]. Behandlingstiden för nativa klaffar är minst 18 månader; vid hjärtklaffprotes bör behandlingen förlängas till minst 24 månader [7]. Indikationer för klaffbyte är desamma som vid andra typer av endokardit [18]. Vissa argumenterar även för att patienten helst ska behandlas med antibiotika i minst 3 veckor inför operation för att minimera risken för infektion av ny klaff [6].
Preventiv antibiotikabehandling med doxycyklin och hydroxiklorokin hos patienter med känt klaffvitium eller kardiomyopati som insjuknar i akut Q-feber anses av vissa vara motiverad; behandlingstiden är då 12 månader. Effekten av antibiotikabehandlingen bör monitoreras, och fortsatt hög IgG-titer talar för terapisvikt. Q-feberendokardit kan anses utläkt om fas I-IgG ≤ 1:256.
Diskussion
Detta fall beskriver en patient som avled i sviterna av Q-feberendokardit och där diagnosen ställdes post mortem. Q-feberendokardit är en blododlingsnegativ endokardit med diffus symtomatologi som kan försvåra samt fördröja diagnosen. En viktig riskfaktor för utveckling av endokardit efter genomgången Q-feber är dock förekomst av klaffvitium.
Den aktuella patienten härstammade från ett land med känd förekomst av Q-feber. Han var dessutom klaffopererad på grund av oklar klaffinsufficiens som diagnostiserades redan i hemlandet. Patienten uppvisade också oklar njurinsufficiens, men närmare utredning försvårades då patienten avböjde njurbiopsi ett flertal gånger. Om dessa faktorer hade fört tankarna till kronisk Q-feber så hade man med Q-feberserologi kunnat ställa diagnosen i ett betydligt tidigare skede.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.