Statinassocierad immunmedierad nekrotiserande myopati är en sällsynt form av idiopatisk inflammatorisk myopati som kännetecknas av symmetrisk proximal muskelsvaghet och signifikant förhöjda nivåer av kreatinkinas med sparsam inflammation i muskelbiopsi.
Tillståndet är, till skillnad från självbegränsande statinmyopati, allvarligare med ihållande symtom trots utsättning av statiner.
Under det senaste decenniet har man identifierat en autoantikropp mot hydroximetylglutaryl-koenzym A-reduktas, som är diagnostiskt för statinutlöst immunmedierad nekrotiserande myopati.
Optimal behandlingsstrategi är oklar, men tidig och intensiv immunsuppression har visat sig vara effektiv.
Statiner, hydroximetylglutaryl-koenzym A-reduktas (HMGCR)-hämmare, minskar signifikant risken för kardiovaskulära händelser och är säkra men associerade med muskelbiverkningar, oftast övergående [1, 2].
I sällsynta fall kan statiner utlösa en autoimmun myopati som är persisterande trots utsättning. År 2010 identifierades en autoantikropp mot HMGCR, som kan detektera statinassocierad autoimmun myopati, identisk med immunmedierad nekrotiserande myopati (IMNM) [3, 4]. Det är en subtyp av idiopatiska inflammatoriska myopatier (IIM), där förekomsten av statinassocierad IMNM uppskattas vara cirka 2–3 per 100 000 statinanvändare [5, 6].
Fallbeskrivning
Patient 1. En 71-årig hjärt–kärlsjuk kvinna inremitterades från vårdcentralen på grund av förhöjda nivåer av alaninaminotransferas (ALAT) (11 μkat/l; referensvärde 0,15–0,75 µkat/l) och aspartataminotransferas (ASAT) (8,9 μkat/l; referensvärde 0,25–0,60 µkat/l). Patienten behandlades med atorvastatin 20 mg dagligen som sekundärprevention efter ischemisk stroke ett år tidigare. Under 5 veckors tid hade patienten haft progredierande proximal muskelsvaghet i ben och armar. Ingen myalgibild beskrevs.
Ultraljud av buk var normalt. Fosfatidyletanol i blod (B-Peth) var inom normalgränsen, och hepatit-, Epstein–Barr- och cytomegalovirus samt borreliaserologi var negativa. Man såg stegrat kreatinkinas (CK) (169 μkat/l; referensvärde 0,6–3,5 μkat/l) och myoglobin (4 255 μg/l; referensvärde 25–58 μg/l). Kreatinin var normalt. Vaskulitprov, inklusive antinukleära antikroppar (ANA) och antikroppar mot extraherbara nukleära antigener (anti-ENA) var negativa. På misstanke om statinutlöst muskelbiverkan sattes statiner ut.
Trots utsättning försämrades allmäntillståndet med muskelsvaghet och stigande CK-värden, varvid prednisolon 1 mg/kg/dag inleddes. Vidare utredning med EMG visade inslag av myopati. Muskelbiopsi påvisade bild som vid nekrotiserande myopati med muskelfiberregeneration, stort antal nekrotiska muskelfibrer och få inflammatoriska celler. Statinutlöst IMNM bekräftades med hjälp av ELISA (enzymkopplad immunadsorberande analys) (QUANTA Lite HMGCR) via Wieslab, som påvisade positiva HMGCR-autoantikroppar (AK) med värde >200 U/ml.
Intravenös behandling med humant normalt immunglobulin (IVIg) påbörjades, 0,4 g/kg/dag i 5 dagar var fjärde vecka i 6 månader, därefter varannan månad i totalt 1 år. I tillägg till IVIg gavs immunsupprimerande behandling med tablett metotrexat, initialt 10 mg/vecka med dosökning till 25 mg/vecka.
Patienten är i dag i klinisk remission (normal muskelstyrka och normala CK-värden) på metotrexat 15 mg/vecka. Muskelstyrka uppmättes med hjälp av självskattningsintrumentet Myositis activities profile (MAP) och myositstatus med bedömningsintrumentet Functional index 2 (FI 2).
Patient 2. En 66-årig man med kronisk ischemisk hjärtsjukdom som behandlades med atorvastatin 80 mg sedan 3 år tillbaka sökte vårdcentral på grund av 3–4 månaders generell muskelvärk samt muskelsvaghet i armar och ben.
Blodprov visade stegrat (424 μkat/l; referensvärde 0,7–4,7 μkat/l) samt stegrade levertransaminaser. Atorvastatin sattes ut, eftersom man misstänkte statinutlöst muskelbiverkning.
Patienten upplevde de kommande veckorna minskad värk och bättre kraft, men hade kvarvarande svaghet i lårmuskulatur, vilket motiverade remiss till reumatologimottagningen. Blodprov inför besöket hos reumatolog visade sjunkande CK och levertransaminaser samt negativa ANA och anti-ENA. Patientens tillstånd bedömdes vara statinmyopati, och han återremitterades till primärvården.
Kontrollprov efter ett halvår visade CK 168 μkat/l, varpå utredningen fullföljdes polikliniskt med muskelbiopsi där man såg nekros i enstaka spridda muskelfibrer samt regenerationstecken, men ingen övertygande inflammation. Utvidgad immunologisk diagnostik, inklusive myositspecifika autoantikroppar, visade sig vara normala. Däremot hade patienten positiva autoantikroppar mot HGMCR med värde >200 U/ml, som påvisades med ELISA (QUANTA Lite HMGCR) via Wieslab. Elektromyografi med neurografi visade tecken på myopati. Diagnosen statininducerad immunmedierad nekrotiserande myopati fastställdes cirka 1 år efter insjuknandet.
Patienten fick initialt prednisolonbehandling 1 mg/kg/dag i 3–4 månader med klinisk förbättring, men hade fortfarande reducerad kraft i lårmuskulatur. Muskelstyrka uppmättes med hjälp av MAP och ett myositstatus. I tillägg gavs behandling med IVIg 0,4 g/kg/dag i 3 dagar var fjärde vecka i 3 månader, därefter IVIg 0,4 g/kg/dag i 2 dagar var fjärde vecka kontinuerligt i drygt 2 år. Behandlingen kunde trappas ned till 0,4 g/kg/dag i en dag var fjärde vecka i ytterligare ett år och sedermera sättas ut. Emellertid fick patienten, under pågående prednisolon- och IVIg-behandling, rediciv och stigande CK-nivåer, varvid tablett metotrexat 15 mg/vecka sattes in.
Patienten har i dag behandling med prednisolon 7,5 mg/dag samt metotrexat 25 mg/vecka.
Patofysiologi
Mekanismen bakom statininducerad myopati är inte helt kartlagd, men troligen är det ett heterogent tillstånd som innefattar bland annat statinegenskaper, interaktioner med andra läkemedel samt genetiska, metabola och immunologiska egenskaper hos patienten. Förutom den toxiska effekten kan statiner vara en utlösande faktor i en autoimmun process, dels genom bildandet av en autoantikropp mot HMGCR, dels genom att statiner ger ett ökat uttryck av autoantigenet HMGCR [7]. Vid ökat uttryck av HMGCR i närvaro av statiner kan det genereras en immunogen HMGCR-härledd peptid via HLA-DRB1*11:01, en genetisk riskfaktor som har visat sig ge en signifikant ökad risk att utveckla anti-HMGCR-myopati [8]. Det faktum att patienter med anti-HMGCR-myopati svarar prompt och gynnsamt på immunsuppression stödjer en immunförmedlad process.
Diagnostik
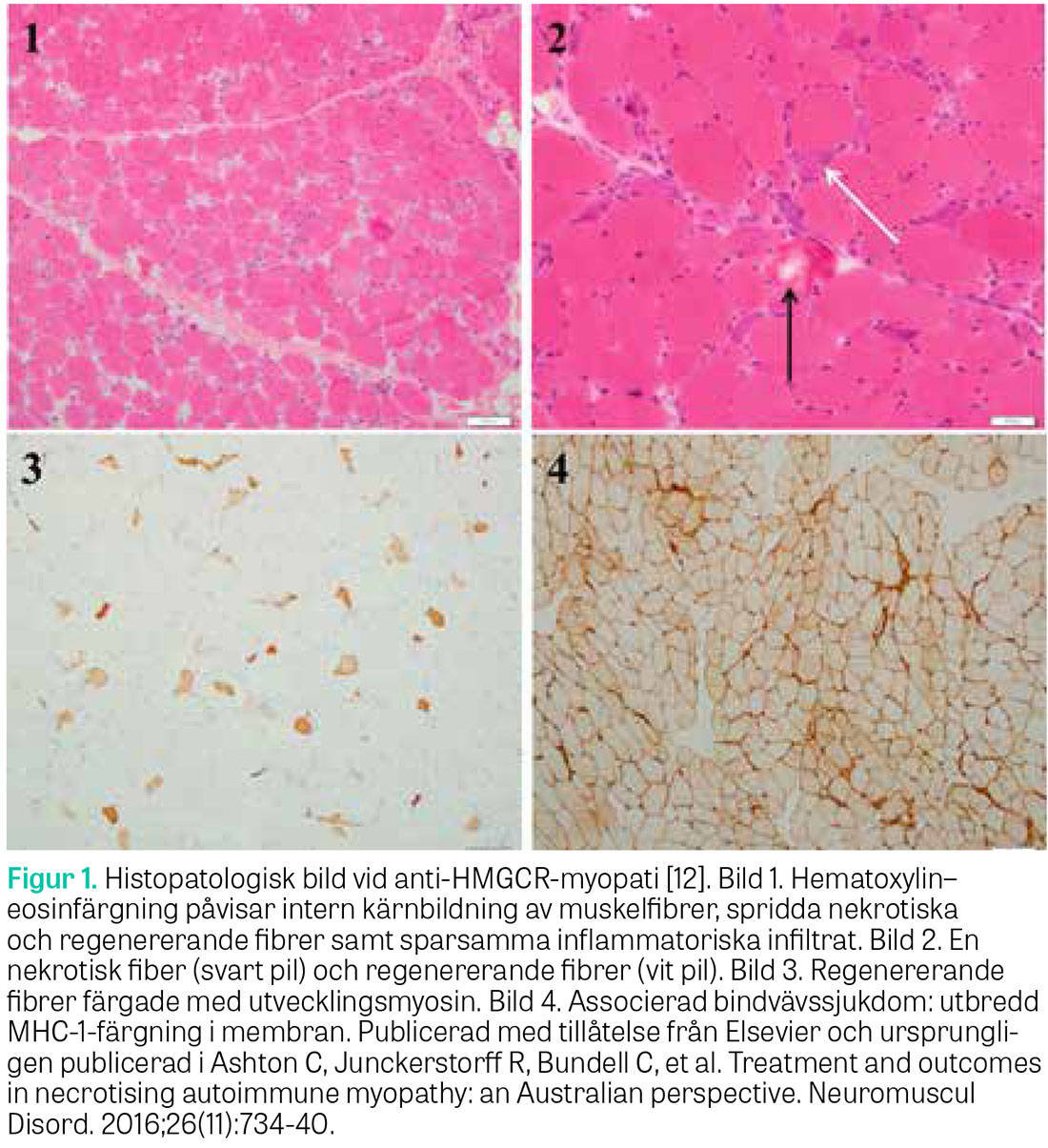
Den kliniska bilden av anti-HMGCR-myopati presenterar sig som en subakut progressiv symmetrisk muskelsvaghet med signifikant ökade nivåer av CK, som kvarstår trots utsättning av statiner. Hos cirka en tredjedel kan myalgi och dysfagi förekomma [5, 7, 9]. Kreatinkinasnivåer har visat sig ha koppling till muskelstyrka och kan användas som surrogatmarkör för sjukdomsaktivitet [9, 10]. De histopatologiska fynd som karakteriserar anti-HMGCR-myopati är nekrotiska muskelfibrer och regenerationsfibrer med sparsam inflammation (Figur 1) [9, 11, 12]. Andra karakteristiska immunologiska fynd är uppreglering av MHC (major histocompatibility complex) klass I på muskelfibrer samt deponering av membranattackkomplex i de små blodkärlen och på sarkolemmala ytan av icke-nekrotiska fibrer [9, 13]. Påvisandet av autoantikroppar mot HMGCR är diagnostiskt och har visat hög sensitivitet och specificitet för statininducerad immunmedierad nekrotiserande myopati (94,4 procent respektive 99,3 procent), utan association med självlimiterade statinmyopati eller genetisk muskelsjukdom [14-16].
Behandling
Statiner ska sättas ut, eftersom återupptagandet av statinbehandling har visat sig försämra sjukdomstillståndet, vilket gör statiner kontraindicerade [3, 8].
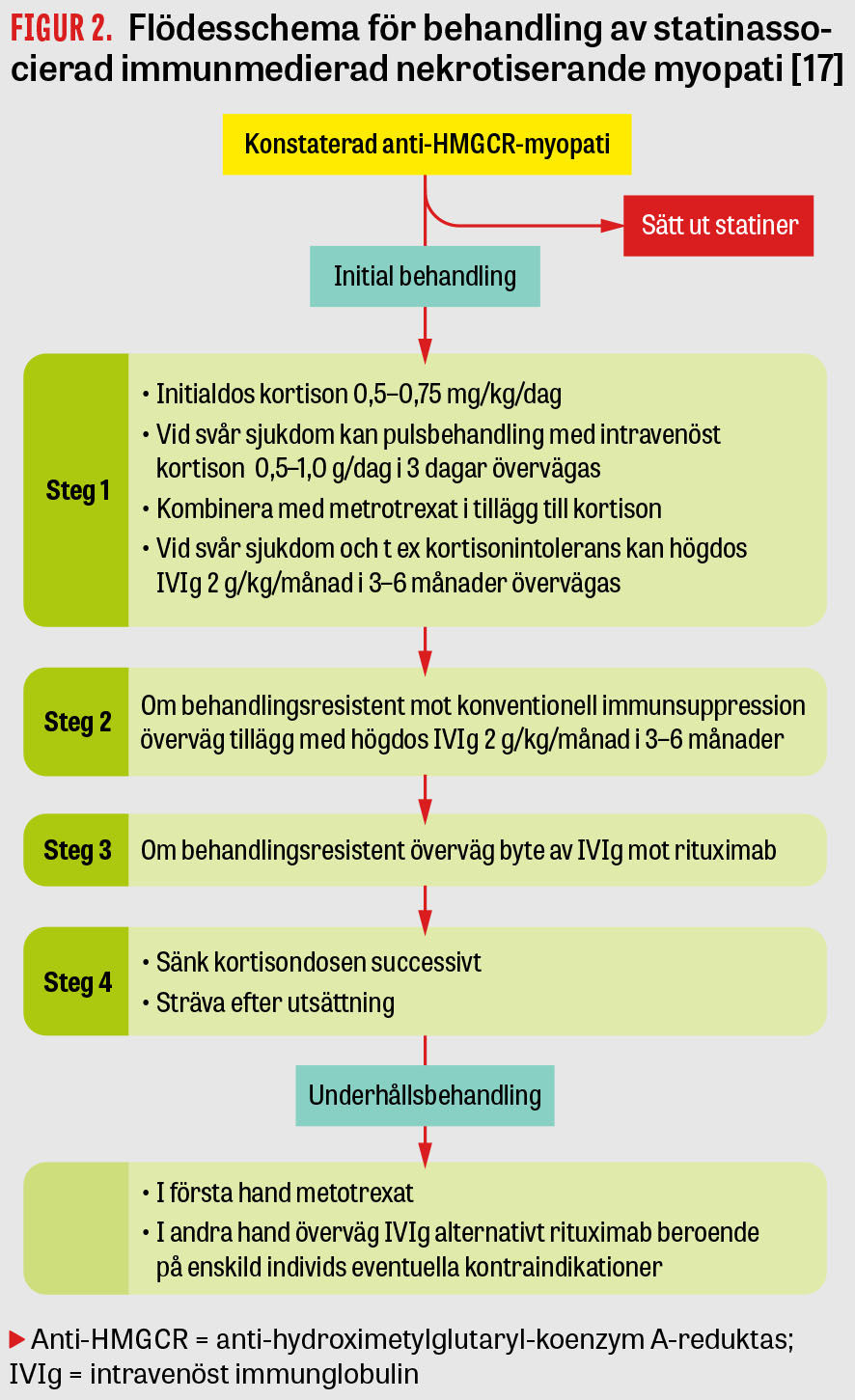
En rad olika immunsuppressiva läkemedel samt immunmodulerande behandling har använts vid statininducerad immunmedierad nekrotiserande myopati; dock saknas randomiserade kontrollerade studier som stöd. Förstahandspreparat är högdos steroider tillsammans med ett annat preparat, vanligtvis tablett metotrexat, samtidigt eller inom en månad beroende på svårighetsgrad och behandlingsrespons (Figur 2). Intravenöst immunglobulin kan ges i stället för, eller i allvarliga fall tillsammans med, tablett metotrexat för att uppnå snabbare remission. Behandling med högdos IVIg vid sjukdomsdebut kan övervägas vid mycket uttalad muskelsvaghet, sväljningssvårigheter eller när högdos kortison är kontraindicerat. Högdos IVIg kan även övervägas vid utebliven behandlingseffekt av konventionell immunsuppression efter 3–6 månader beroende på sjukdomens svårighetsgrad. En tredje behandlingslinje som har diskuterats är rituximab, men erfarenheten är begränsad [17, 18].
Optimal behandlingstid är okänd, men konsensus är att hitta lägsta effektiva steroiddos och successivt sänka steroidsparande läkemedel först efter minst två år av välkontrollerad sjukdom. Många patienter med anti-HMGCR-myopati kan dock behöva kronisk IVIg-behandling [17].
Konklusion
Anti-HMGCR-myopati är en ovanlig men allvarlig form av myopati till följd av statinbehandling. Diagnosen bör övervägas hos statinbehandlade patienter med muskelsymtom och signifikant stegrade CK-värden, som kvarstår trots utsättning av statiner. Anti-HMGCR-myopati kan diagnostiseras vid detektion av anti-HMGCR-antikroppar. Muskelbiopsi och EMG kan vara till hjälp vid osäkerhet i diagnostiken.
Tillståndet är svårt att behandla, men tidig och intensiv immunsuppressiv terapi med kortikosteroider, immunsuppressiva medel och IVIg kan vara effektiv. Fler studier behövs för att fastställa optimal behandlingsregim och duration.
Lipidsänkande läkemedel som inte följer mevalonatvägen, exempelvis ezetimib, PCSK9-hämmande läkemedel eller kolestyramin kan ersätta statiner, med låg startdos och upptitrering till maximal tolerabel dos [19, 20].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.