Mutationer i genen för SOD1 är globalt den vanligaste kända orsaken till ALS. Mutationerna medför att SOD1-proteinet förvärvar en ny funktion som är toxisk för det motoriska nervsystemet. Mycket talar för att muterat SOD1-protein har prionliknande egenskaper.
Typ av ALS och prognos korrelerar till vilken SOD1-mutation patienten är bärare av; det finns en korrelation mellan ökad halt av muterat SOD1-protein och tidig sjukdomsdebut och snabbt sjukdomsförlopp.
Antisens-oligonukleotiden tofersen minskar syntesen av SOD1-protein. Behandling med tofersen har visat en kliniskt kraftig bromsning av sjukdomsutvecklingen. Parallellt minskas halten av skademarkörerna neurofilament L och H.
Årligen insjuknar mellan 250 och 400 personer i Sverige i amyotrofisk lateralskleros (ALS), ett heterogent neurodegenerativt syndrom där de nervceller som styr skelettmuskulaturen förtvinar. Klassisk ALS debuterar asymmetriskt distalt, oftast i hand eller fot, och om tal eller röst först påverkas kallas debuten för bulbär. Karakteristiskt är att sjukdomsprocessen successivt sprids från myotom till intilliggande myotom, och inom 1–3 år från första symtom är flertalet myotom involverade. Dödsorsaken är oftast koldioxidnarkos med eller utan pneumoni, sekundär till pares av andningsmusklerna [1]. Genomsnittsöverlevnaden är 2–4 år, men beror på ALS-variant. Ingen effektiv bromsande behandling har hittills funnits för någon typ av ALS.
Etiologiskt är ALS en heterogen sjukdom. Viktiga riskfaktorer är manligt kön, ålder och ärftlighet. 2–5 procent av all ALS orsakas av en mutation i genen som kodar för antioxidantenzymet superoxiddismutas-1 [2]. Forskning om SOD-enzymer har bedrivits vid Umeå universitet sedan 1972, då professor Stefan Marklund upptäckte enzymet SOD3. När forskare vid Harvard i mars 1993 rapporterade att missensmutationer i SOD1 är associerade med ALS [2] kunde forskargruppen vid Umeå universitet redan nästa dag börja studera SOD1 hos svenska patienter med ALS. Denna forskning har resulterat i att 28 olika SOD1-mutationer kunnat identifierats hos patienter i Norden, varav 18 i Sverige. Vanligast globalt och i Norden är D90A-mutationen. Övriga mutationer finns oftast bara i en familj, till exempel i Mälardalen (A4V), Bohuslän (A4P) eller Skåne–Blekinge (G114A). Vissa mutationer ger ett snabbt förlopp, medan andra ger ett långsamt sjukdomsförlopp. Särskilt mutationer i aminosyraposition alanin-4 (A4) associeras med aggressivt sjukdomsförlopp, ofta innefattande plötslig sjukdomsdebut och kort överlevnadstid [3].
Upptäckten av SOD1-mutationer 1993 gav stöd för den då rådande teorin att ALS orsakas av oförmåga att metabolisera fria radikaler. D90A-mutationen var den första som identifierades i Europa, och forskargruppen vid Umeå universitet lyckades visa att D90A-muterat SOD1-protein är stabilt med intakt förmåga att metabolisera fria radikaler. Slutsatsen kunde dras att muterat SOD1-protein orsakar ALS via en ny, förvärvad toxisk funktion (»gain-of-function«) som är specifik för nervsystemet, även om SOD1 finns i alla celler i kroppen [4]. Denna teori bekräftades i studier på transgena möss, där tillsättning av muterat humant SOD1 i musgenomet medförde en ALS-sjukdom hos mössen [5, 6]. Forskargruppen vid Umeå universitet lyckades rena fram SOD1-aggregat både från obducerade ALS-patienter och transgena möss. Genom injektion i ryggmärgens framhorn på transgena möss [7] kunde man påvisa att felveckat SOD1 sprids vidare i CNS som en prion och orsakar ALS hos mössen [8, 9]. Den toxiska effekten är dosberoende, och inriktningen för ny behandling av ALS med SOD1-mutationer blev att reducera produktionen av SOD1.
Tofersen (Qalsody) är en antisens-oligonukleotid som minskar produktionen av SOD1 genom nedbrytning av SOD1-mRNA. Tofersen ges via lumbal punktion 1 gång i månaden, och effekten räcker endast så länge läkemedlet ges. I läkemedelsprövningar och »early access«-program har fler än 220 patienter med SOD1-mutation behandlats med tofersen. Biverkningarna har varit få (oftast lumbago, postpunktionell huvudvärk), men 4–7 procent av patienterna har utvecklat intrakraniell tryckstegring, papillödem, pleocytos och enstaka myelit (oftast lindrig). Biverkningarna har ofta behandlats genom att avbryta tofersenbehandlingen, som sedan i flera fall kunnat återupptas. Dödsfall på grund av behandling med tofersen har inte rapporterats. I dubbelblindade studier har 100 mg tofersen givet intratekalt var 4:e vecka medfört en signifikant förlångsammad försämring mätt med funktionsskalan ALSFRS-R (Amyotrophic lateral sclerosis functional rating scale – revised) [10]. Anmärkningsvärd är även effekten på koncentrationen av neurofilament »light« (NFL) och fosforylerat neurofilament »heavy« (pNFH), som är skademarkörer för neuronsönderfall [11]: redan efter 3–4 injektioner av 100 mg tofersen ses sänkning av neurofilament jämfört med baslinjenivåer [12, 13], och effekten ökar med upprepade injektioner [14]. Parallellt reduceras SOD1-proteinhalten i ryggmärgvätskan med 30–40 procent jämfört med baslinjen.
Nedan beskrivs ett fall med SOD1-medierad ALS där forskargruppen vid Umeå universitet efter 4 års månatlig behandling med 100 mg tofersen observerar ett lovande kliniskt resultat som aldrig tidigare setts hos en ALS-patient i Sverige.
Fallbeskrivning
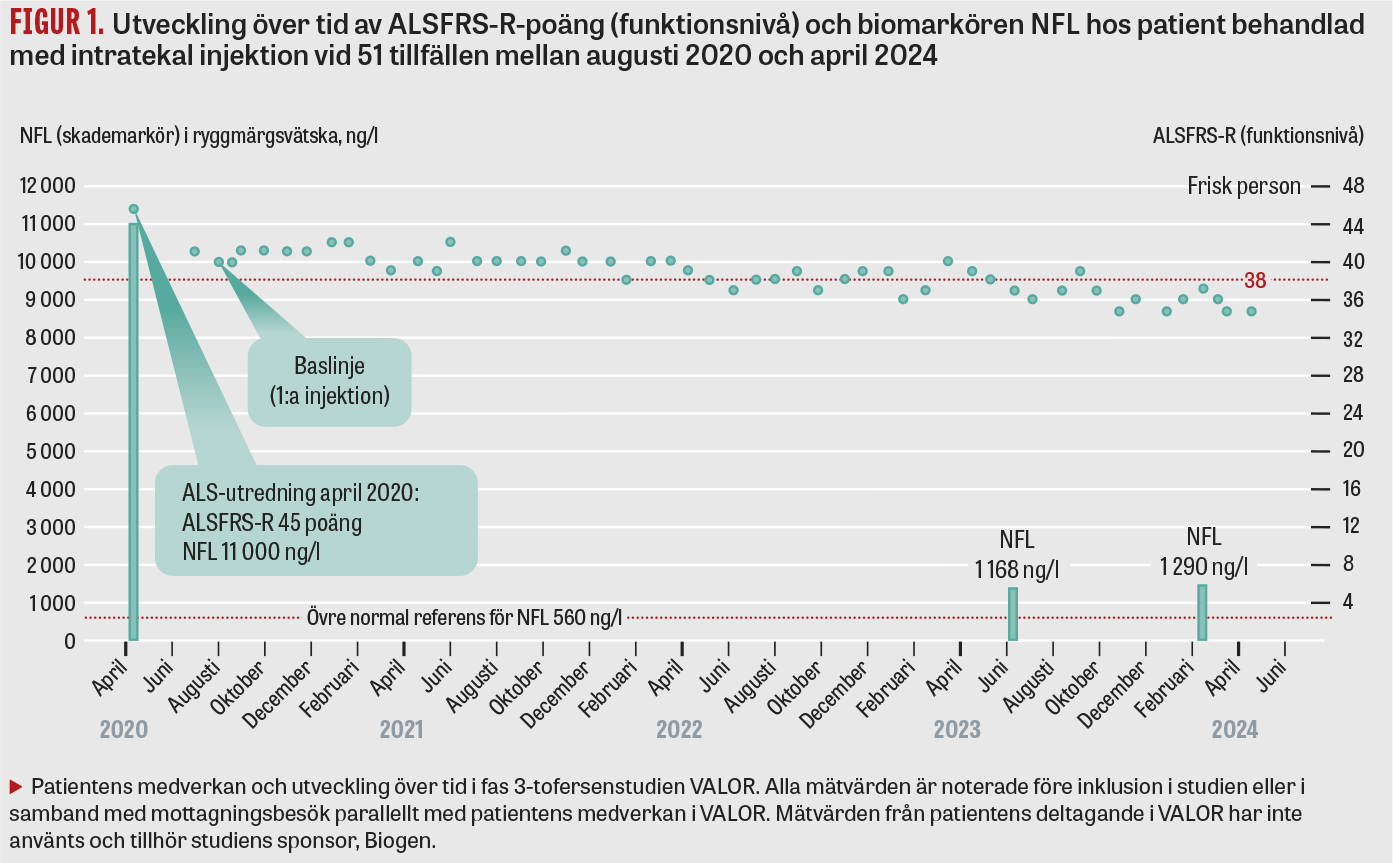
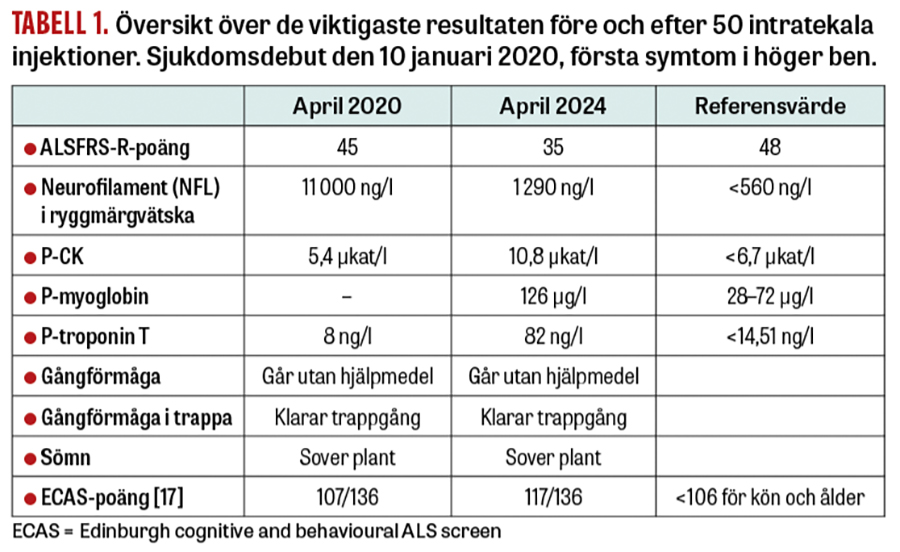
Patienten är en tidigare frisk person i 30-årsåldern som tillhör en släkt i södra Sverige med ALS i 3 generationer orsakad av heterozygoti för den erkänt aggressiva A4S-SOD1-mutationen. Patientens första kontakt med forskargruppen vid Umeå universitet skedde när en anhörig blev sjuk i ALS och A4S-mutationen identifierades hos båda individer. Året därpå kontaktades forskargruppen av patienten då hen under loppet av en vecka utvecklat pares i höger ben. En snabb utredning vid Norrlands universitetssjukhus visade tecken på ALS i tidigt stadium med skada på första och andra motorneuronet men intakta sensoriska, autonoma och kognitiva funktioner. ALSFRS-R-poäng hade sjunkit från 48 (normalt värde) till 45 på mindre än 3 månader efter symtomdebut. Halten av NFL i ryggmärgsvätskan var 11 000 ng/l (övre referensvärde <560 ng/l), talande för en aggressiv sjukdomsprocess, att jämföras med flertalet ALS-patienter med relativt stabilt NFL i intervallet 3 000–6 000 ng/l under sjukdomstiden. Etikprövningsmyndigheten hade tidigare godkänt svensk medverkan i en läkemedelsstudie på tofersen, men av administrativa och geografiska skäl bestämdes att denna patient skulle inkluderas i fas 3-tofersenstudien VALOR på Bispebjerg universitetssjukhus i Köpenhamn, och sommaren 2020 screenades och randomiserades patienten för medverkan. Hen har sedan dess erhållit 51 injektioner av placebo eller testläkemedel (Figur 1) med 4 veckors intervall. Biverkningarna har varit få och främst relaterade till själva lumbalpunktionerna. Våren 2021 hade patienten en period med besvärande lumbago. Myelit misstänktes, men kunde inte bekräftas radiologiskt eller vid analys av ryggmärgsvätska. Efter 8 injektioner i den placebokontrollerade delen av VALOR har patienten från februari 2021 fortsatt i den öppna förlängningsdelen. ALSFRS-R-poängen har under 4 år stabiliserats kring 35–37. Samtidigt har NFL sjunkit från 11 000 ng/l april 2020 till 1 200 ng/l i mars 2024. Patienten går fortfarande utan hjälpmedel. Gången är lätt haltande, men hen går i trappor, tar hand om sina barn och har endast lättare respiratoriska och bulbära tecken (Tabell 1).
Diskussion
Detta är den första ALS-patienten från ett nordiskt land med SOD1-medierad ALS, där behandling med tofersen kraftigt bromsat den kliniska sjukdomsprocessen. Dock talar lätt förhöjda NFL-nivåer kring 1 200 ng/l (referensvärde <560 ng/l) och förhöjda nivåer av troponin T, CK och myoglobin i plasma (Tabell 1) för en kvarvarande sjukdomsaktivitet som patienten förmår kompensera via okända mekanismer. I detta fall observerades tidigt en klinisk effekt. Hos några patienter i den placebokontrollerade delen av VALOR-studien observerades initialt bara en begränsad icke-signifikant klinisk effekt, sannolikt på grund av att den 6 månader långa placebokontrollerade delen var för kort för att både a) effektivt minska SOD1-syntesen, b) reducera skadeprocessen i nervsystemet (mätt som reduktion av NFL) och c) möjliggöra reinnervering och därmed reparation av det motoriska nervsystemet (mätt som stabilisering av ALSFRS-R-poäng och lungfunktion) [10]. Liknande goda resultat som hos ovan beskrivna patient har uppmätts hos ett 40-tal belgiska och tyska patienter som sedan 2022 medverkar i ett öppet »early access«-program. Särskilt intressant är att en relevant bromsande klinisk effekt med korresponderande biokemisk reduktion ses även hos patienter med långsam utveckling av ALS-sjukdomen [13, 14]. De lovande resultaten på patienter med manifest ALS och relativt få biverkningar har lett till den nu pågående ATLAS-studien, med syftet att klargöra om tidig behandling med tofersen av friska anlagsbärare av SOD1-mutation kan bromsa insjuknande i symtomatisk ALS [15, 16]. ATLAS-studien godkändes av Läkemedelsverket och Etikprövningsmyndigheten 2021 och pågår med syftet att förebygga ALS.
Potentiella bindningar eller jävsförhållanden: Karin Forsberg är huvud- och medprövare i läkemedelsstudier sponsrade av Amylyx, Biogen, Ionis Pharmaceuticals, PTC Therapeutics, Sanofi och ITB-Med. Merete Karlsborg är huvudprövare och medprövare i läkemedelsstudier sponsrade av Biogen, Cytokinetics och AB Science. Lisette Salvesen är huvud- och medprövare i läkemedelsstudier sponsrade av Biogen, Cytokinetics, AB Science, Takeda och Theverance Biopharma. Peter Andersen är huvudprövare för läkemedelsprövningarna VALOR och ATLAS, som sponsras av Biogen, har sedan 2014 erhållit arvoden för deltagande i rådgivande kommittéer (privat eller till arbetsgivaren) samt är huvudprövare för flera andra läkemedelsstudier sponsrade av konkurrenter till Biogen. Han är även rådgivare för EMA.
Denna artikel är skriven på eget initiativ av författarna. Biogen har inte haft någon roll i planering, innehåll eller publicering av artikeln.