Nya perorala antikoagulantia (NOAK) är alternativ till warfarin som strokeprofylax vid icke-valvulärt förmaksflimmer samt vid profylax och behandling av venös tromboembolisk sjukdom.
Begränsade möjligheter att monitorera effekterna av NOAK och avsaknad av specifika antidoter komplicerar handläggningen vid allvarlig blödning och i samband med invasiva procedurer.
Den tromboemboliska risken vid utsättning av NOAK måste vägas mot blödningsrisken vid ställningstagande till uppehåll i behandlingen eller överbryggning med lågmolekylärt heparin.
På grund av preparatens relativt korta halveringstider kan utsättning av läkemedlet och understödjande behandling ofta vara tillräckligt.
Koagulationsjour bör om möjligt kontaktas vid handläggning av allvarlig blödning hos en patient som behandlats med NOAK. Behandling med protrombinkomplexkoncentrat kan övervägas vid allvarlig blödning hos framför allt patienter behandlade med faktor Xa-hämmare, men detta är ofullständigt dokumenterat avseende effekt, och viss trombosrisk kan föreligga.
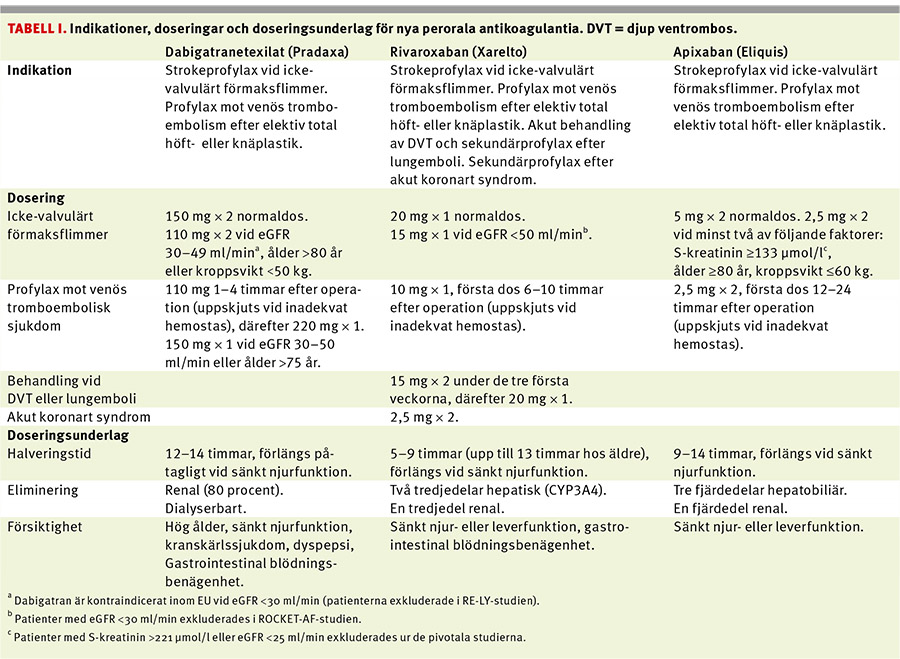
Nya perorala antikoagulantia (NOAK), dvs trombinhämmaren dabigatran [1] samt faktor Xa-hämmarna rivaroxaban [2] och apixaban [3], har under de senaste åren introducerats med indikationerna strokeprofylax vid icke-valvulärt förmaksflimmer samt profylax och behandling av venös tromboembolisk sjukdom. Tabell I sammanfattar de godkända indikationerna och doseringarna. Förhoppningen att NOAK skulle kunna användas vid behandling av patienter med mekaniska hjärtklaffproteser har inte infriats på grund av den ökade risken för klafftrombos, stroke och blödning vid omsorgsfullt monitorerad högdosbehandling med dabigatran jämfört med warfarin [4].
De fördelar som framhålls med NOAK- jämfört med traditionell warfarinbehandling är kort anslagstid och att regelbunden monitorering med individuell dosering inte krävs. Det finns dock situationer där monitorering vore av värde för att uppnå hög patientsäkerhet och optimal effekt även med NOAK. Framför allt finns behov av tillförlitliga test för att bedöma antikoagulationens intensitet i akuta situationer med allvarlig blödning eller risk för sådan. Medan warfarineffekten kan mätas och reverseras finns det fortfarande sparsamt med data om handläggningen av NOAK vid blödningar och akut kirurgi. Handläggningen kompliceras i dessa situationer av att möjligheten att mäta effekterna av NOAK är begränsade och att specifika antidoter ännu inte finns tillgängliga. Rutinkoagulationstest har begränsat eller inget värde; mer specifika analyser finns på vissa laboratorier.
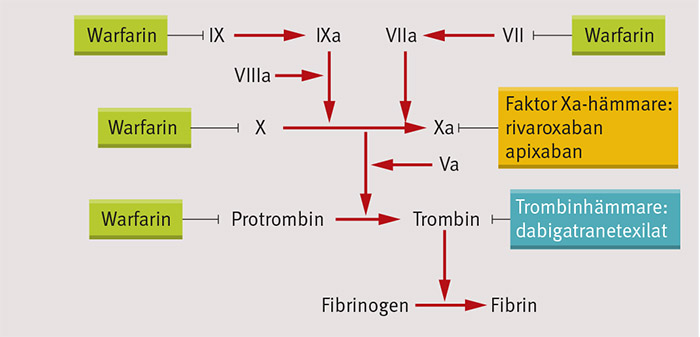
Verkningsmekanismer
Faktor Xa och trombin är viktiga delar i koagulationskaskaden. Faktor Xa omvandlar tillsammans med faktor Va protrombin till trombin (Figur 1). Trombin medierar slutsteget i koagulationskaskaden, omvandlingen av fibrinogen till fibrin, och aktiverar faktor V, VIII och XI. Trombin aktiverar också trombocyter, som i sin tur genererar mer trombin.
Dabigatranetexilat (Pradaxa) är en prekursor som efter absorption spjälkas till den direktverkande, kompetitiva trombinhämmaren dabigatran. Biotillängligheten är mycket låg (3–7 procent), men plasmakoncentrationen ökar snabbt efter intag och når maximum efter 0,5–2 timmar. Eliminationen av dabigatran sker till ≥80 procent via njurarna. Halveringstiden är 12–14 timmar vid normal njurfunktion, med stor interindividuell variation och kan förlängas avsevärt vid njurfunktionsnedsättning [5].
Rivaroxaban (Xarelto) är en direktverkande peroral faktor Xa-hämmare som når maximal plasmakoncentration 2–4 timmar efter intag. Rivaroxaban utsöndras delvis via njurarna (35 procent) med en halveringstid på 5–9 timmar hos yngre personer; längre hos äldre [6]. Biotillgängligheten är god men beroende av födointag.
Apixaban (Eliquis) är den i Sverige senast godkända direkta faktor Xa-hämmaren. Maximal plasmakoncentration nås 1–3 timmar efter intag, och preparatet utsöndras till 25 procent via njurarna med en halveringstid på 9–14 timmar [7]. Dabigatran och apixaban administreras två gånger dagligen, medan rivaroxaban trots sin kortare halveringstid vanligen tas en gång dagligen (Tabell I).
Läkemedelsinteraktioner
Läkemedelsinteraktioner är ett välkänt problem som måste beaktas vid behandling med warfarin och även med NOAK. Samtliga NOAK interagerar med läkemedel som påverkar transportproteinet P-glykoprotein, t ex antiarytmika, såsom amiodaron, dronedaron, verapamil och diltiazem, som höjer NOAK-koncentrationen. Dessa läkemedel används inte sällan vid förmaksflimmer. Faktor Xa-hämmarna rivaroxaban och apixaban metaboliseras dessutom av leverns cytokrom P450-enzymer, vilket medför risk för interaktioner med läkemedel som hämmar eller inducerar dessa enzymer. Interaktionerna kan både höja plasmahalterna av NOAK och fördröja deras eliminering i samband med allvarlig blödning eller kirurgi. Man måste även beakta farmakodynamiska interaktioner med läkemedel som ökar blödningsrisken, framför allt trombocythämmare.
Blödningsrisk
I en metaanalys av NOAK-behandling vid förmaksflimmer skilde inte incidensen allvarlig blödning och gastrointestinal blödning vid behandling med dabigatran i lägre dosering (110 mg × 2 dagligen) eller apixaban jämfört med warfarin [8, 9]. För dabigatran i standarddosering (150 mg × 2 dagligen) och för rivaroxaban var risken för gastrointestinal blödning ökad [8, 9]. NOAK-behandlade patienter hade i de pivotala studierna minskad risk att drabbas av intrakraniell blödning jämfört med warfarinbehandlade [9].
I en amerikansk observationsstudie av dabigatran noterades färre intrakraniella och gastrointestinala blödningar hos dabigatran- än hos warfarinbehandlade patienter [10]. Vid dessa jämförelser är det viktigt att betona att framgångsrik warfarinbehandling är beroende av hur stor andel av tiden som PK(INR) befinner sig inom terapeutiskt intervall (time in therapeutic range, TTR). I de pivotala förmaksflimmerstudierna som jämförde NOAK med warfarin var TTR kortare i studierna i sin helhet och i vissa regioner mycket kortare än hos inkluderade svenska patienter [8]. Resultat från internationella studier som jämför effekter och blödningsrisker vid NOAK- och warfarinbehandling behöver således inte vara generaliserbara till en svensk population.
Särskilda riskgrupper
Särskilda riskgrupper att beakta vid behandling med antikoagulantia är äldre patienter, patienter med njurfunktionsnedsättning och patienter med samtidig trombocythämmande behandling [11, 12]. Det finns begränsad klinisk erfarenhet av behandling med NOAK hos äldre patienter.
I en subgruppsanalys i RE-LY-studien var risken för allvarlig blödning hos patienter äldre än 75 år med förmaksflimmer jämförbar mellan warfarinbehandlade patienter och patienter med dabigatran 110 mg × 2 dagligen [13]. Hos patienter behandlade med dabigatran 150 mg × 2 dagligen sågs en trend mot högre risk för blödning än hos warfarinbehandlade. I de studier där warfarin jämfördes med rivaroxaban respektive apixaban vid förmaksflimmer kunde man inte påvisa ökad risk för blödning hos de äldre [14, 15].
I Sverige rekommenderas reducerad dos dabigatran (110 mg × 2 dagligen) till patienter äldre än 80 år, medan dosjustering för äldre behandlade med rivaroxaban inte anses nödvändig [5, 6]. För apixaban är ålder en av flera faktorer som ska vägas in vid beslut om dosering [7].
Blödningsrisken är ökad hos antikoagulantiabehandlade patienter med måttlig njurfunktionsnedsättning [15-17]. Blödningsrisken i denna patientgrupp var likartad vid warfarin- och dabigatran- eller rivaroxabanbehandling [16, 17] men lägre vid behandling med apixaban än med warfarin [15]. Då dabigatran till största delen utsöndras via njurarna är det av stor vikt att ta hänsyn till njurfunktionen vid behandling med detta preparat. I Sverige och övriga europeiska länder är dabigatran kontraindicerat vid en skattad glomerulär filtrationshastighet (eGFR, i studierna beräknat enligt Cockcroft–Gault) mindre än 30 ml/min [5]. Rivaroxaban och apixaban är kontraindicerade vid eGFR mindre än 15 ml/min men kan användas med försiktighet vid eGFR 15–29 ml/min [6, 7]. Inget av medlen har dock studerats avseende nytta och risk vid eGFR under 25–30 ml/min. För apixaban gäller dosreduktion vid minst två av följande faktorer: ålder ≥80 år, kroppsvikt ≤60 kg eller serumkreatinin ≥133 μmol/l [5].
Behandling med trombocythämmare ökar risken för blödning, men studierna av samtidig behandling med NOAK och trombocythämmande läkemedel är få. Behandling med acetylsalicylsyra (ASA) ökade risken för intrakraniell blödning vid behandling med dabigatran på indikationen förmaksflimmer [18]. Vid akut koronart syndrom var blödningsrisken ökad då apixaban gavs i förmaksflimmerdosering till patienter med dubbel trombocythämmande behandling med ASA och klopidogrel [19]. Låg dos rivaroxaban (2,5 mg × 2 dagligen) hade gynnsam effekt avseende kardiovaskulära komplikationer, utan ökad risk för letal blödning men med ökad risk för allvarlig eller intrakraniell blödning [20, 21]. I en metaanalys av akut koronart syndrom medförde tillägg av NOAK vid medicinering med två trombocythämmande läkemedel en nästan dubblerad risk för blödningskomplikationer [12].
Monitorering av antikoagulation
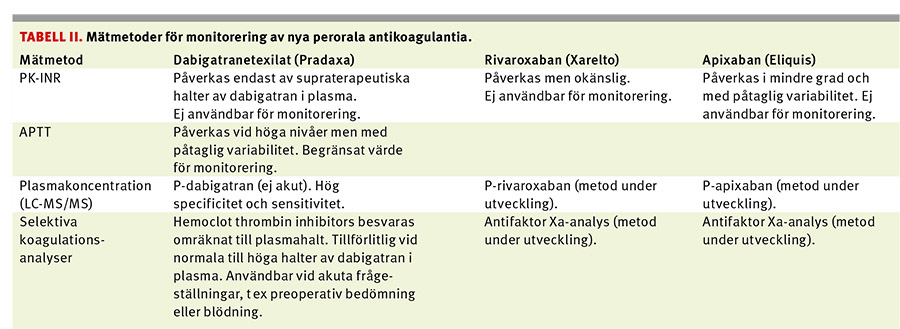
Vid allvarlig blödning (Fakta 1) och i samband med akuta ingrepp krävs snabb och tillförlitlig laboratoriediagnostik för att kunna uppskatta graden av antikoagulation. De analyser som används för att mäta effekterna av warfarin är inte lämpliga vid behandling med NOAK, där möjligheterna att mäta effekten för närvarande är begränsade.
Normal aktiverad partiell tromboplastintid (APTT) anses tala emot effekt av dabigatran och normal protrombintid tala emot effekt av faktor Xa-hämmare [22, 23]. Vid jämförelse med plasmahalter av dabigatran hade dock flera patienter normal APTT trots terapeutiska halter av dabigatran [24, 25]. PK-INR påverkas endast av supraterapeutiska koncentrationer av dabigatran [24]. För monitorering av dabigatran krävs ett specialtest (Hemoclot thrombin inhibitors, HYPHEN BioMed) som dock inte är tillförlitligt vid låga terapeutiska dabigatranhalter [24, 25]. Läkemedelsanalys ger tillförlitlig bestämning av dabigatran ned till avsaknad av medlet i provet [24, 25] men är inte generellt tillgänglig. För monitorering av rivaroxaban [26] eller apixaban [27] är antifaktor Xa-analys att föredra framför protrombintid. PK-INR påverkas av faktor Xa-hämning, vilket måste beaktas vid skiften mellan rivaroxaban eller apixaban och warfarin, men PK-INR lämpar sig inte för monitorering av faktor Xa-hämmare [26].
Rutinkoagulationstest är således inte tillförlitliga för bedömning av NOAK-behandling såvida plasmahalterna inte är höga eller mycket höga. Det är ännu för tidigt att fastställa vilka värden i de mer tillförlitliga specialkoagulationstesten eller läkemedelsanalyserna för NOAK som innebär acceptabel blödningsrisk inför en invasiv procedur [28]. Data från RE-LY-studien visar emellertid plasmakoncentrationsberoende risker för både stroke och allvarlig blödning med dabigatran, som kan tjäna som bedömningsunderlag [29]. Tabell II sammanfattar mätmetoderna för monitorering av NOAK.
Reversering
Möjlighet till reversering av antikoagulantiaeffekter kan vara livräddande vid pågående blödning och behov av akut kirurgi. K-vitamin och protrombinkomplexkoncentrat (PCC) är vedertagen behandling för att motverka effekten av warfarin, men i dagsläget saknas specifika antidoter för samtliga NOAK. Plasma har ingen dokumenterad effekt för reversering av NOAK och rekommenderas inte [30]. Rekombinant aktiverad faktor VII har associerats med ökad risk för tromboemboliska komplikationer, och användningen stöds generellt inte vid blödning hos NOAK-behandlade patienter [30, 31]. Det finns inga rapporterade erfarenheter av desmopressin, en syntetisk vasopressinanalog, som stimulerar frisättning av faktor VIII och von Willebrand-faktorn, eller tranexamsyra, som hämmar bildningen av plasmin från plasminogen, vid blödning hos NOAK-behandlade patienter.
Blödningar orsakade av faktor Xa-hämning bör teoretiskt vara lättare att reversera än blödningar orsakade av trombinhämmare som hämmar koagulationssystemets slutsteg. PCC innehåller de vitamin K-beroende koagulationsfaktorerna II, VII, IX och X. Hos friska försökspersoner normaliserades de laboratorieparametrar som används för skattning av antikoagulativ effekt av behandling med PCC vid rivaroxaban- men inte vid dabigatranbehandling [32]. Inga studier har utvärderat effekten av PCC vid blödning hos NOAK-behandlade, men användning av PCC vid allvarlig blödning har förordats i flera konsensusriktlinjer där råden grundas på fallbeskrivningar eller data från laboratoriestudier [30, 33]. Man måste även beakta att risken för tromboemboliska händelser ökar vid behandling med PCC, vilket visats hos warfarinbehandlade [34].
Specifika antidoter mot NOAK är under utveckling. En monoklonal antikropp mot dabigatran har studerats i djurmodeller, och kliniska studier påbörjas snart [35]. Även en antidot för reversering av faktor Xa-hämmare är under utveckling [36]. Andexanet alfa (PRT4445, Portola Pharmaceuticals) är ett hemostatiskt inaktivt protein som liknar faktor Xa och som kompetitivt blockerar effekten av faktor Xa-hämmare. Det krävs klinisk dokumentation och kommer att dröja innan dessa specifika antidoter blir tillgängliga i sjukvården.
Utsättning inför planerade ingrepp
Vid ställningstagande till utsättning av NOAK inför elektiva invasiva procedurer bör blödningsrisken vid fortsatt behandling vägas mot trombosrisken vid utsättning. Vid ingrepp med låg blödningsrisk (t ex mindre ortopediska och endoskopiska ingrepp) rekommenderas utsättning 1–2 dagar före ingreppet och vid måttlig till hög blödningsrisk (t ex buk-, torax- och neurokirurgi) 2–5 dagar före ingreppet beroende på njurfunktionen [37-41].
Svenska sällskapet för trombos och hemostas (SSTH) har tillsammans med specialistföreningarna sammanställt ett konsensusdokument som bl a innefattar detaljerade rekommendationer kring utsättning av NOAK inför planerade ingrepp [41]. Njurfunktionen bör följas vid både ut- och återinsättning i samband med kirurgi. Vid utsättning av NOAK bör tiden mellan utsättning och ingrepp förlängas om njurfunktionen är nedsatt; detta gäller i synnerhet dabigatran, som till stor del elimineras via njurarna [39]. Hos patienter med hög tromboembolisk risk har man rekommenderat överbryggning med lågmolekylärt heparin som initieras 12–24 timmar efter sista administrerade dos NOAK [28, 39].
I en nyligen publicerad subgruppsanalys i RE-LY-studien jämfördes blödningsrisken vid invasiva procedurer hos warfarin- och dabigatranbehandlade [42]. De senast administrerade doserna av warfarin och dabigatran gavs i medeltal 114 respektive 49 timmar före ingreppet. Man fann ingen signifikant skillnad i incidensen av allvarliga blödningar mellan patienter behandlade med dabigatran 110 mg (3,8 procent), dabigatran 150 mg (5,1 procent) eller warfarin (4,6 procent). Hos patienter som genomgick akut kirurgi var incidensen allvarlig blödning i warfaringruppen 21,6 procent jämfört med 17,8 och 17,7 procent hos patienter behandlade med dabigatran 110 mg respektive 150 mg. Studien var inte blindad avseende warfarin- eller dabigatranbehandling. Noteras bör att endast 5 procent av de warfarinbehandlade erhöll K-vitamin och att PCC inte användes alls, vilket kan ha medfört suboptimala resultat i warfaringruppen [43]. De kliniska erfarenheterna av utsättning av rivaroxaban och apixaban inför invasiva procedurer är begränsade.
Få rekommendationer finns kring återinsättning av NOAK efter invasiva procedurer, men generellt rekommenderas att tidpunkten för återinsättning baseras på postoperativ blödningsrisk, och de flesta rekommendationer stödjer återinsättning 1–3 dygn efter ingreppet [28, 38, 41, 44]. Vid återinsättning bör hänsyn tas till preparatens korta anslagstider och patientens njurfunktion.
Handläggning vid blödning eller akut kirurgi
Blödningar vid behandling med NOAK bör rapporteras till Läkemedelsverket. På grund av brist på vetenskaplig evidens är handläggningen vid blödning eller behov av akut kirurgi baserad på expertutlåtanden. Vid blödning och behov av akut kirurgi hos NOAK-behandlade bör tidpunkten för senaste dos efterfrågas och njurfunktionen skattas. På grund av preparatens relativt korta halveringstider kan utsättning av läkemedlet och understödjande behandling vara tillräckligt i många situationer [23, 30, 39]. Även några timmars förlängning av tiden mellan senaste dos av NOAK och ingreppet har betydelse om preparatens halveringstider är korta, som vid normal njurfunktion och frånvaro av allvarliga läkemedelsinteraktioner. Handläggningen varierar beroende på graden av blödning, enligt Figur 2. I den föreslagna handläggningen indelas blödningarna i icke-allvarliga och allvarliga. Allvarlig blödning definieras enligt kriterier från International Society on Thrombosis and Haemostasis (ISTH) (Fakta 1) [45]. Om inte kriterierna för allvarlig blödning uppfylls, men hög risk för sådan anses föreligga, bör blödningen handläggas som allvarlig blödning.
Laboratorieparametrar avseende koagulation (PK(INR) och APTT) bör kontrolleras men har begränsat värde för bedömning av behandlingsintensiteten. Om möjligt mäts koncentrationen av dabigatran i blod med specifik läkemedelsanalys eller specifik funktionell metod (Hemoclot thrombin inhibitors) [38]. Vid behandling med rivaroxaban eller apixaban kan en validerad anti-faktor Xa-analys eller specifik läkemedelsanalys användas, om sådan finns att tillgå.
Det bör noteras att man för de funktionella testen ännu inte fastställt vilka värden som innebär acceptabel blödningsrisk [28]. Europeiska läkemedelsmyndigheten (EMA) har emellertid yttrat att dabigatran- eller rivaroxabanhalter i plasma >200 ng/ml (över 90:e percentilen) medför ökad blödningsrisk [2, 3]. Data från RE-LY-studien talar för att detta är en tämligen högt satt gräns eftersom blödningsrisken ökar linjärt och påtagligt med ökande plasmahalter av dabigatran redan inom det »normala« intervallet [29]. För apixaban finns ännu inget bedömningsunderlag.
Patienter som behandlas med NOAK ska, liksom övriga patienter, vid behov erhålla understödjande behandling med volymersättning, företrädesvis blodprodukter, och eventuell kirurgisk intervention med lokala hemostatiska åtgärder. Vid större blödning kan transfusion av plasma krävas på grund av konsumtion eller utspädning av koagulationsfaktorer, men plasma är inte indicerat för reversering av NOAK-effekt [23]. Trombocytkoncentrat ges vid stor blödning men kan också övervägas vid uttalad trombocytopeni eller pågående behandling med trombocythämmare [23, 46]. Möjligheten att häva blödningar med trombocytkoncentrat är mindre vid behandling med ticagrelor än med övriga trombocythämmare [46]. Samtidig behandling med antikoagulantia och de nya, mer potenta trombocythämmarna rekommenderas inte.
Om mindre än två timmar förflutit sedan senaste dos kan ventrikelsköljning övervägas. Aktivt kol kan användas för att minska absorptionen av dabigatran men bör då ges inom två timmar efter läkemedelsintaget [23]. Hos patienter behandlade med hemodialys hade mer än 60 procent av dabigatranet eliminerats efter två timmars dialys [47]. Möjligheten att inleda hemodialys hos dabigatranbehandlade patienter är begränsad, och risk finns för blödning i samband med anläggning av central dialyskateter, men behandlingen bör övervägas hos framför allt patienter med nedsatt njurfunktion [30]. Elimineringen av rivaroxaban och apixaban, som till stor del är proteinbundna, påskyndas inte med hemodialys. I samråd med koagulationsjour kan PCC ges vid allvarlig blödning till framför allt patienter som behandlas med faktor Xa-hämmare, men både effekten och risken för tromboemboliska komplikationer är ofullständigt studerade [23, 30]. Vid behov av kirurgisk intervention bör endovaskulärt (coiling, embolisering) eller endoskopiskt ingrepp övervägas. Vid akut kirurgi rekommenderas inte profylaktisk administrering av PCC eller annan hemostatisk produkt [28].
Slutsatser
På grund av avsaknad av specifika antidoter mot NOAK kan blödningar hos patienter som behandlas med dessa preparat vara svårare att hantera än blödningar vid warfarinbehandling. Blödningar inducerade av faktor Xa-hämmarna bör på teoretiska grunder vara lättare att reversera än blödningar orsakade av en trombinhämmare. De kliniska erfarenheterna av handläggning i samband med kirurgi och vid allvarliga blödningar är ännu begränsade för NOAK.
På grund av preparatens relativt korta halveringstider kan utsättning av läkemedlet och understödjande behandling i många situationer vara tillräckligt. Ställningstagande till utsättning av preparatet och övrig handläggning bör göras i samråd med koagulationsjour. Behandling med PCC kan övervägas vid allvarlig blödning som inte svarar på övrig behandling, framför allt vid behandling med faktor Xa-hämmare, men är ofullständigt studerad avseende både effekt och tromboembolisk risk.
Fakta 1.
Definition av allvarlig blödning enligt International Society on Thrombosis and Haemostasis (ISTH) [45]
• Letal blödning och/eller
• Symtomatisk blödning i ett kritiskt område eller organ, såsom intrakraniell, intraspinal, intraokulär, retroperitoneal, intraartikulär, perikardiell eller intramuskulär med kompartmentsyndrom och/eller
• Blödning som orsakar ett Hb-fall ≥20 g/l eller som leder till transfusion av ≥2 enheter blod.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.



![Figur 2. Handläggning vid blödning hos patienter behandlade med nya perorala antikoagulantia (NOAK). Efter Majeed et al, Siegal et al, Levy et al, Siegal et al, Heidbuchel et al [23, 33, 39, 40, 44]. ASA = acetylsalisylsyra.](https://lakartidningen.se/wp-content/uploads/EditorialFiles/ZP/%5bCRZP%5d/2013-0172_02%E2%80%93webb.jpg)















