Preoperativ strålning och bättre kirurgi har förbättrat behandlingsresultaten vid rektalcancer.
Med magnetkameraundersökning kan riskerna för recidiv bedömas.
Rekommendationer om lämplig behandling görs multidisciplinärt.
Det finns anledning att ifrågasätta värdet av preoperativ strålning för vissa individer med medelstor risk för recidiv, vilket kan innebära att färre i denna grupp strålbehandlas.
Små tumörer kan i vissa fall reagera så gynnsamt på strålning att en operation med dess negativa konsekvenser kan undvikas. Detta kan innebära att dessa patienter strålbehandlas i större omfattning, och under längre tid och med samtidig cytostatikabehandling.
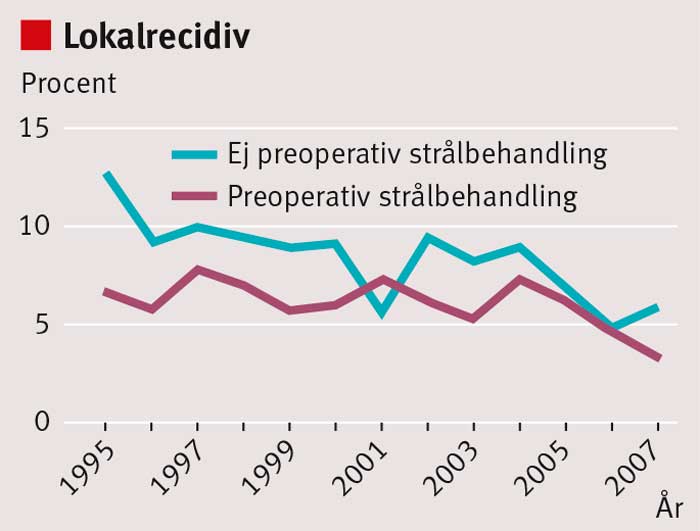
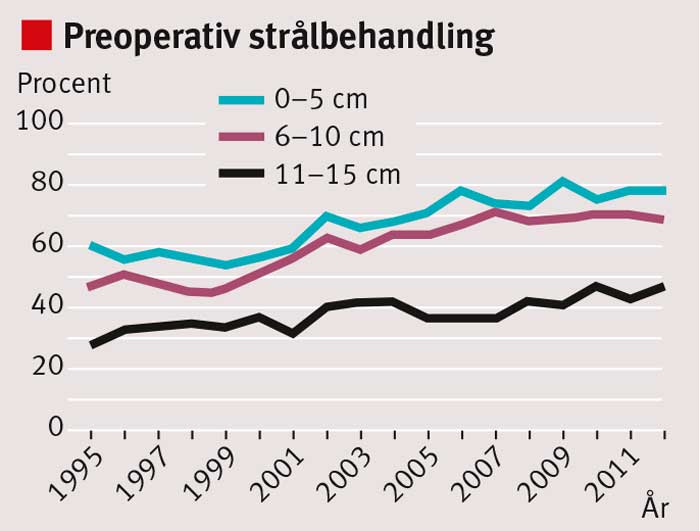
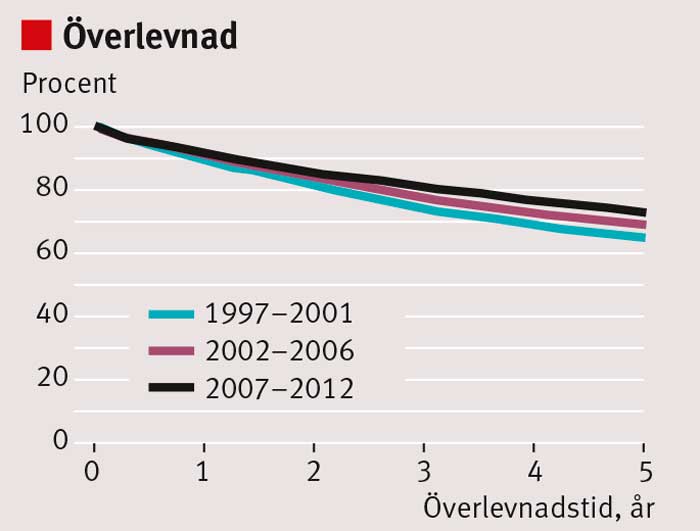
Sedan mitten av 1990-talet har behandlingsresultaten vid rektalcancer förbättrats i Sverige. Under 1970-talet och början av 1980-talet fick ca 35 procent av patienterna ett lokalt recidiv inom 5 år; i dag är risken för lokalrecidiv <5 procent [1] (Figur 1). De viktigaste orsakerna är att den kirurgiska tekniken förbättrats genom införande av s k total mesorektal excision (TME) och att en ökande andel patienter får preoperativ strålbehandling (Figur 2). Andra bidragande orsaker är bättre preoperativ stadieindelning med magnetresonanstomografi (MRT), förbättrad patologisk-anatomisk bedömning och återföring av behandlingsresultaten via det nationella kvalitetsregistret. Även överlevnaden har förbättrats, men inte i samma grad som risken för lokalrecidiv minskat (Figur 3).
Klassificering av rektaltumörer
Alla patienter med rektalcancer ska diskuteras vid multidisciplinär konferens, där radiologer, kirurger, onkologer, patologer och kontaktsjuksköterskor går igenom patientens sjukhistoria och utredningsresultat och rekommenderar behandling. Baserat på klinisk undersökning och resultatet av MRT-undersökningen hänförs varje patients tumör till en riskgrupp: mycket tidig, tidig, intermediär och lokalt avancerad.
De mycket tidiga tumörerna är ofta cancer i polyper, och dessa kan opereras eller (i en nära framtid) strålbehandlas lokalt transanalt endoskopiskt. De tidiga, intermediära och lokalt avancerade tumörerna (ofta benämnda »good«, »bad« respektive »ugly«) opereras med transabdominal tarmresektion hos nästan alla patienter.
Vid MRT-undersökningen bedöms dels tumörens djupväxt i tarmväggen (T-stadium), dels förekomst av lymfkörtelmetastaser (N-stadium) utanför tarmväggen i mesorektum och på bäckenväggar. Att med MRT klassificera lymfkörtlar som tumöromvandlade eller inte är mycket osäkert. Det räcker inte med att lymfkörtlar identifieras i mesorektum; de måste uppvisa radiologiska tecken på malignitet för att påverka riskgrupperingen.
Vad som klassificeras som tidig, intermediär eller lokalt avancerad tumör kan inte entydigt definieras utifrån tumörens T- och N-stadium. Andra faktorer som spelar roll är tumörens avstånd från anus, om den växer framåt, lateralt eller bakåt, mesorektums tjocklek, hur nära tumören och eventuella patologiska lymfkörtlar växer mot den mesorektala fascian, förekomst av kärlinväxt samt differentieringsgrad.
Kvaliteten på MRT-undersökningen och kirurgens kompetens är också betydelsefulla faktorer för att klassificera tumören och värdera behovet av preoperativ behandling.
Preoperativ (neoadjuvant) strålbehandling
Flera stora randomiserade studier har visat att preoperativ strålbehandling minskar risken för lokalrecidiv med minst hälften [2]. Den relativa effekten är bättre i tidiga tumörstadier och vid bättre kirurgi (ca 70 procent) och sämre vid mer avancerade tumörer (ca 50 procent). Strålbehandling har således effekt även på tidiga tumörer, opererade av de bästa kirurgerna. Ändå rekommenderas inte strålbehandling till patienter med tidiga tumörer med hänsyn till strålningens kort- och långsiktiga biverkningar. Operationen i sig innebär påtagliga risker för sena funktionella tarmbesvär, vilket negativt påverkar patientens livskvalitet, men tillägget av strålbehandling gör att tarmfunktionen kan bli ännu sämre [3].
Kunskapen om strålbehandlingens långsiktiga bieffekter baseras på studier gjorda för 10–30 år sedan [3]. Under det senaste decenniet har det skett en påtaglig teknikutveckling inom området, vilket innebär att stråldosen i mycket större utsträckning än tidigare kan begränsas till de kroppsvolymer (vid rektalcancer bakre delen av lilla bäckenet) som potentiellt innehåller tumörceller och som kirurgen inte med lätthet opererar bort [4]. Detta kommer att resultera i färre sena biverkningar, eftersom dessa biverkningar beror på given stråldos och behandlingsvolym. Den strålbehandling dessa patienter fått under de senaste ca 5 åren och kan förväntas få i en nära framtid på svenska centra är betydligt mer anpassad till måltumören än vad som tidigare var möjligt.
I en nära framtid finns också möjligheten i Sverige att ge behandling med skannade protoner vid den nationella protonterapianläggningen Skandionkliniken (www.skandionkliniken.se), vilket ytterligare kan minska stråldosen till intilliggande normalvävnad.
Om risken för lokalrecidiv sjunker från 6 procent till 2 procent slipper 4/100 ett besvärande lokalrecidiv, men 96/100 får strålbehandling »i onödan« och riskerar tidiga och sena biverkningar av behandlingen. Om risken för lokalrecidiv är 10–12 procent gagnas 7–8/100, och om risken är ännu högre, t ex 25 procent, sänker strålning risken till ca 12 procent, och motivationen för strålbehandling ökar. Med ökande risk för lokalrecidiv ökar således motivationen att ge preoperativ strålbehandling eller strålbehandling i kombination med cytostatika. Bättre strålbehandling ökar också motivationen för att ge strålbehandling även vid lägre risk för recidiv, eftersom riskerna för sena biverkningar minskar.
Under senare år har synen på strålbehandling vid rektalcancer skiftat, och argument har framförts för att strålbehandla vissa patientgrupper i lägre utsträckning och andra grupper i högre utsträckning.
Motiv för att strålbehandla färre patienter
I Sverige har strålbehandling med 5 Gy × 5 under 1 vecka varit standard till patienter med intermediära tumörer. Eftersom risken för lokalrecidiv med enbart optimal kirurgi är ca 10 procent och eftersom totalöverlevnaden i dessa intermediära stadier inte påverkas av strålbehandlingen i någon större utsträckning (överlevnadsvinsten kan uppskattas till hälften av vinsten i lokalrecidiv), är det troligt att vi bör strålbehandla färre patienter.
Diskussioner om att reducera andelen har förts under flera år, men utan att detta ännu noterats i statistiken. Ett lokalt recidiv är svårbehandlat och medför oftast mycket svåra lokala besvär. Kanske strålbehandlas många för att undvika lokala recidiv så långt som möjligt, trots att den absoluta nyttan är liten. Det finns ingen konsensus om vilken som är lägsta risk för lokalrecidiv för att läkarna, tillsammans med patienterna, ska tycka att det inte är värdefullt att ge strålbehandling. Vid andra diagnoser behandlas cancerpatienter regelmässigt med olika tilläggsbehandlingar med mindre absolut vinst.
Förutsatt att kirurgin är av god kvalitet, vilket det finns all anledning att tro att den är i Sverige, bör man vid MRT-undersökningen troligen titta mer på tumörens relation till den mesorektala fascian än på fyndet av patologi i mesorektum. Även om det finns metastassuspekta lymfkörtlar i mesorektum, är avståndet från dessa till den mesorektala fascian viktigast. Är avståndet >3–5 mm är risken liten att patienten får ett lokalrecidiv; risken är dock hög för att patienten har ockulta (icke-upptäckbara) fjärrmetastaser, som strålningen inte kan behandla.
Således kan man ifrågasätta om dessa patienter behöver strålbehandlas. En orsak till att fortsättningsvis ge preoperativ strålbehandling är risken för att laterala lymfkörtlar, dvs de utanför mesorektum, tumöromvandlas. Risken är högst vid lågt belägna tumörer, varför det kan finnas skäl till att fortsättningsvis strålbehandla dessa. För majoriteten av intermediära tumörer belägna ovan den peritoneala omslagsranden, ca 7–9 cm från anus och med bra marginal till mesorektal fascia är enbart optimal kirurgi sannolikt tillräcklig.
Om andelen patienter som strålbehandlas minskar i Sverige, är det oerhört viktigt med en minutiös nationell kontroll av resultaten; först avseende tumörstadium och bedömning av om operationen är radikal, senare av lokalrecidivfrekvens.
Motiv för att strålbehandla fler patienter
Abdominell operation med resektion av rektum och mesorektum (TME) är den viktigaste behandlingen för att bota rektalcancer, men operationen har också negativa effekter. Förutom risker för komplikationer i samband med ingreppet får många patienter senare funktionella tarmbesvär, som ibland kan vara mycket påtagliga. Hos 25–30 procent av patienterna tas både rektum och anus bort, och patienten måste ha en permanent stomi.
Det finns därför flera fördelar om det operativa ingreppet kunde minska i omfattning eller helt undvikas. Om patienten får preoperativ strålbehandling med eller utan cytostatika och tumören härefter försvinner, kan man tänka sig att avstå från operation helt och hållet och alltså bevara rektum. Tidigare har enstaka patienter som är för gamla eller för sjuka för operation eller de som av någon anledning inte kan tänka sig stomi eller operation över huvud taget behandlats i organbevarande syfte, men i övrigt har detta varit mycket sparsamt förekommande.
Är det då möjligt att ge preoperativ behandling i organbevarande syfte och att inte operera om tumören försvinner? Denna behandlingsstrategi har rönt allt större intresse. En vetenskaplig rapport publicerad 2004 [5] väckte initialt stor skepticism. Erfarenheten har ökat, och rapporter finns nu publicerade från en handfull centra [6-8]. Patientantalet är fortfarande mycket begränsat, och inga randomiserade studier existerar.
Svårigheten med denna behandlingsstrategi är att förutsäga vilka tumörer som kommer att försvinna och vilka som återkommer om de initialt försvunnit. Tumörer uppvisar stor heterogenitet i behandlingssvar på strålning, och trots intensiv forskning är möjligheten att bedöma vilka tumörer som svarar tillräckligt bra begränsad. Endast storleken ger viss vägledning; små tumörer svarar bättre än större. Förekomst av extramural kärlinväxt eller bild av tumörheterogenitet har i små serier korrelerat med dåligt svar. Fluorodeoxiglukos-PET (FDG-PET) före och under strålbehandlingen har också rapporterats vara av visst värde för att bedöma om tumören svarar på behandlingen [9].
De stråldoser som ges, 5 Gy × 5 enbart eller ca 50 Gy under 5–6 veckor tillsammans med cytostatika, förmår döda mikroskopisk, subklinisk sjukdom hos 60–80 procent av patienterna. Erfarenheterna har dock visat att även makroskopisk tumör till synes helt försvunnit när det är dags för operation 6–8 veckor efter strålbehandlingen. Dessa kliniskt kompletta remissioner har ibland också visat sig vara kompletta vid patologisk undersökning av preparatet efter operationen, där man således inte hittat några tumörceller. Dessa patienter har mycket god prognos [10]. En del patienter med komplett klinisk remission blev aldrig opererade och har förblivit i komplett remission, dvs botade av strålning.
För att anse att en komplett klinisk remission uppnåtts krävs att tumören försvunnit palpatoriskt, att rektoskopi visar normala fynd och att MRT inte visar kvarvarande tecken på tumöraktivitet [6]. Om fyndet vid bedömningen efter ca 6 veckor inte är helt normalt men regressen mycket god, kan det finnas motiv att göra en förnyad bedömning efter ytterligare 6 veckor. Om det inte finns någon tumörrest kvar endoskopiskt och palpatoriskt vid denna tidpunkt föreligger komplett klinisk remission, och det finns förutsättningar att patienten inte behöver opereras.
Chansen att nå komplett klinisk remission och att denna blir bestående utan operation är dåligt känd men har i studier rapporterats vara 20–40 procent, och hos hälften av dessa patienter har den blivit bestående [5-7, 11]. De tumörer som behandlats har i regel varit små, ca 2–3 cm, och chansen att nå varaktig komplett klinisk remission med kemoradioterapi är större om tumören är liten. Det finns ett samband mellan T-stadiet, tumörens storlek och klassificering i tidig, intermediär och lokalt avancerad tumör; i Sverige strålbehandlas vanligen inte de tidiga tumörerna. En liten, mycket lågt belägen tumör kan dock vara lokalt avancerad om den engagerar levatormuskulaturen eller externa analsfinktern; dessa patienter erbjuds då preoperativ kemoradioterapi.
Organbevarande behandling i två kliniska situationer
Organbevarande behandling kan principiellt ske i två kliniska situationer: antingen som ett positivt överraskningsfynd vid utvärdering efter given strålbehandling före planerad operation eller som ett led i en medveten behandlingsstrategi för att bevara organet.
I den förstnämnda situationen är frågan om operationen ska genomföras som planerat eller skjutas på framtiden. Om tumören var stor (>4 cm) är chansen liten att komplett klinisk remission blir bestående, trots det initialt goda behandlingssvaret. Om tumören primärt var mindre och om det kirurgiska ingreppet sannolikt innebär en rektumamputation med permanent stomi, kan benägenheten att avvakta med operationen öka.
I den andra situationen, med en medveten strategi för organbevarande behandling, kommer fler patienter med tidiga tumörer att primärt erbjudas kemoradioterapi, eller möjligen 5 × 5 Gy med fördröjd operation i stället för direkt operation. Av dessa tidiga och enstaka intermediära tumörer kanske 30 procent når komplett klinisk remission, och 20 procent blir bestående. För dessa individer är strategin framgångsrik med bevarande av rektum, även om de utsätts för akuta och sena biverkningar av strålbehandlingen. Dessutom måste de genomgå en mer noggrann uppföljning än efter operation, med återkommande endoskopier och MRT-undersökningar under minst 8–10 år. Resterande 80 procent av patienterna har fått kemoradioterapi men måste ändå opereras, och de riskerar därför att drabbas av biverkningar av båda behandlingsmodaliteterna.
Organbevarande behandling kräver kompetens och resurser
Risken att tumören återväxer hos dem som uppnått komplett klinisk remission efter strålbehandling är ca 30 procent, och därför måste uppföljningen vara minutiös. Dessa lokalrecidiv kan ofta opereras kurativt om uppföljningen fungerat som den ska, men exakt hur ett uppföljningsprogram ska se ut är oklart. Viktigast för att upptäcka återväxt är endoskopi och palpation, men högupplösande MRT krävs för att tidigt upptäcka eventuella lymfkörtelrecidiv. Baserat på den erfarenhet som finns tillgänglig verkar det som om det vanligaste är slemhinnerecidiv, vilket innebär att uppföljningen bör vara likartad den vid analcancer, plus tillgång till endoskopi.
Organbevarande behandling av rektalcancer kommer därför att kräva ökade sjukvårdsresurser för behandling och uppföljning på onkolog- och kirurgkliniker. Å andra sidan sparar man in kostnader för operationer och stomiförband.
De erfarenheter som hittills rapporterats internationellt visar att en medveten organbevarande behandlingsstrategi vid rektalcancer kräver kvalitetssäkringsåtgärder och återkommande kvalitetskontroll avseende uppföljning. Verksamheten måste centreras kring ett dedikerat team, som tar ansvar för många patienter för att få nödvändig erfarenhet av och kunskap om att hitta lokalrecidiv tidigt.
Nya rutiner bör utarbetas
Frågan är då om internationella och nationella erfarenheter nu är så positiva att det finns motiv att i Sverige initiera och bygga upp en behandlingsstrategi som syftar till att undvika stor rektalcancerkirurgi, med åtföljande bättre livskvalitet för de patienter vars tumörer försvinner efter kemoradioterapi.
Även om svenska patienter med rektalcancer har en högre tolerans för permanent stomi än patienter i många andra länder, finns en önskan hos många att slippa operation och stomi om detta inte är nödvändigt. Det är kanske dags att vi på ett mer strukturerat sätt ger neoadjuvant behandling till små, lågt sittande tumörer i syfte att undvika operation.
Trots att det fortfarande är en minoritet av tumörerna som försvinner efter neoadjuvant behandling, bör det enligt vårt förmenande ställas krav på de team som handlägger patienter med rektalcancer att utarbeta rutiner och bygga upp kompetens för att ta hand om patienter med komplett klinisk remission. Man måste på ett säkert sätt kunna dels följa dessa patienter, dels ta hand om majoriteten av patienterna som trots omfattande kemoradioterapi ändå måste opereras och därmed har högre risk för sena besvär.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.