Efter svår förvärvad hjärnskada utvecklar enstaka patienter långvarig och uttalad medvetandestörning (vegetativt tillstånd eller minimalt medvetandetillstånd), som hindrar aktivt deltagande i neurorehabilitering.
Internationella expertgrupper och modern forskning betonar att rehabiliteringsenheter ändå har en roll i vården av dessa patienter.
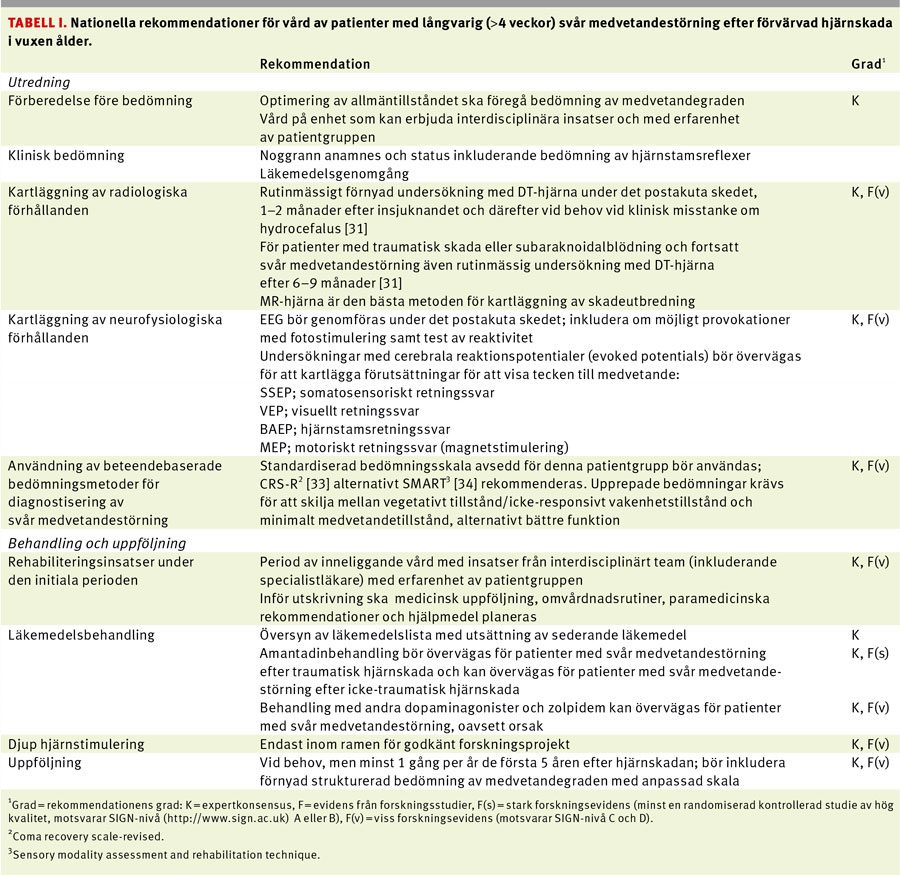
Här presenteras rekommendationer för vård av vuxna patienter med långvarig svår medvetandestörning.
Vissa patienter som överlever en svår förvärvad hjärnskada kan efter en tid öppna ögonen spontant utan att visa något eller endast diskreta tecken på medvetande. Sådana tillstånd kallas »svår medvetandestörning« (disorders of consciousness; DOC) och omfattar vegetativt tillstånd (VT) och minimalt medvetandetillstånd (MCS) (Figur 1). Tillstånden kan uppkomma efter trauma, anoxi, hypoperfusion (på grund av t ex intraoperativa komplikationer), subaraknoidalblödning, intracerebralt hematom, hjärninfarkt, svåra CNS-infektioner, förgiftningar och metabola tillstånd. Med långvarig menas i detta sammanhang en varaktighet >4 veckor efter hjärnskadan.
Uppdrag av Svensk förening för rehabiliteringsmedicin
På uppdrag av Svensk förening för rehabiliteringsmedicin har en arbetsgrupp med representanter med expertis och erfarenhet av patientgruppen och specialistkompetens inom rehabiliteringsmedicin, neurologi och medicinsk etik utarbetat rekommendationer vid svår medvetandestörning. Samtliga sjukvårdsregioner i Sverige finns representerade i arbetsgruppen.
Rekommendationerna baseras på
- en systematisk genomgång av litteraturen vad gäller behandlingsmetoder under 2007–2012 [1]
- en icke-systematisk genomgång av litteraturen fram till november 2013
- arbetsgruppens samlade erfarenhet
- synpunkter från specialister inom neurokirurgi, neurofysiologi och neuroradiologi.
Sökstrategin vad gäller behandlingsmetoder [1] sammanfattas i Fakta 1. Sökorden gällande andra aspekter inkluderade »vegetative state«, »minimally conscious state«, »disorders of consciousness«, »prognosis«, »treatment«, »rehabilitation«, »recovery« och »assessment«.
Forskningsunderlaget för samtliga rekommendationer graderas (Tabell I) som »starkt« (minst en högkvalitativ randomiserad kontrollerad studie) eller »visst« (minst en studie av acceptabel kvalitet). Där forskningsevidens saknas baseras rekommendationerna på expertkonsensus (Tabell I). Alternativa metoder för evidensgradering (såsom GRADE-systemet) är mindre lämpade med tanke på de ofta komplexa interventioner [2] som används för denna patientgrupp.
Patienter med progressiva sjukdomar, som MS och demens, omfattas inte av rekommendationerna.
Svårigheter vid omhändertagande och olikheter i vården
Patienter som utvecklar långvarig svår medvetandestörning vårdas i akutskedet på ett flertal olika vårdenheter beroende på hjärnskadans etiologi. Enskilda kollegor inom de flesta berörda specialiteter träffar endast få patienter med långvarig svår medvetandestörning under sitt yrkesliv. Rehabiliteringsmedicinska insatser kan te sig meningslösa för patienter som inte kan delta aktivt i funktionsträning, och inom läkarkåren varierar åsikterna om huruvida remittering till rehabiliteringsenhet över huvud taget bör ske [3]. Även inom rehabiliteringsmedicinen finns olika syn på om, och hur, slutenvårdsbaserade insatser ska utformas för dessa patienter [3].
Dessutom är medicinska komplikationer som måste hanteras parallellt med rehabiliteringsinsatserna vanliga under en längre period (veckor till månader) [4], och resurser för omhändertagande av dessa komplikationer finns inte på alla rehabiliteringsenheter.
Evidensbaserade rekommendationer bör kunna bidra till ett mer enhetligt omhändertagande och ligga till grund för utveckling av vården av patientgruppen.
Neuroanatomiska korrelat
Kunskaperna om de neuroanatomiska förutsättningarna för medvetande, såväl hos friska som hos individer med hjärnskada, har under senare år utvecklats. Med stöd av studier med funktionell magnetkameraundersökning (fMRI) och positronemissionstomografi (PET) vet vi att det s k externa medvetandet (dvs medvetande om omgivningen genom bearbetning av sinnesintryck) förläggs till ett lateralt frontoparietalt nätverk, vilket omfattar prefrontala och posteriora parietala associativa kortex.
Det s k interna medvetandet (dvs egna tankar som inte är relaterade till stimuli från omgivningen) baseras på ett medialt frontoparietalt nätverk, vilket omfattar anteriora cingulum/mesiofrontala kortex och posteriora cingulum/precuneus [5].
Två undergrupper av svår medvetandestörning är etablerade internationellt (Fakta 2):
- Vegetativt tillstånd (VT): Patienten har periodvis öppna ögon men visar inga tecken på att medvetet kunna bearbeta och förstå stimuli från omgivningen. Den mer neutrala termen »icke-responsivt vakenhetstillstånd« (IRV) har nyligen föreslagits [6]. I denna artikel benämns tillståndet fortsättningsvis vegetativt tillstånd/icke-responsivt vakenhetstillstånd.
- Minimalt medvetandetillstånd [7]: Patienten uppvisar minimala, inkonsekventa men reproducerbara tecken på medvetenhet om sig själv eller sin omgivning, men förmåga till funktionell kommunikation föreligger inte, och patienten saknar förmåga att använda föremål på ett funktionellt sätt.
Kodning och epidemiologi
I den internationella sjukdomsklassifikationen ICD-10 saknas koder för vegetativt tillstånd/icke-responsivt vakenhetstillstånd och minimalt medvetandetillstånd, vilket gör att planeringsunderlaget för sjukvården är begränsat. Koder finns dock med i arbetsversionen »ICD-11 beta«, vilket på lång sikt kan ge ett bättre underlag.
Siffror från aktuella studier medger ändå en uppskattning av incidensen av långvarig svår medvetandestörning. En multicenterstudie [8] har visat att svår medvetandestörning (>3 månader) efter hjärntrauma har en årlig incidens på 3/1 000 000 invånare i arbetsför ålder i Sverige. Förekomsten av icke-traumatiskt orsakad långvarig svår medvetandestörning är mer osäker, men den sammanlagda incidensen av vegetativt tillstånd/icke-responsivt vakenhetstillstånd med varaktighet ≥6 månader (av alla etiologier) har uppskattats till 5–25/1 000 000 och år [9].
Feldiagnostiseras som svår medvetandestörning
Vid »locked-in syndrome«, t ex efter en hjärnstamsinfarkt, kan väsentligen intakt kognition och medvetenhet föreligga, men förmågan att kommunicera och interagera med omgivningen begränsas av tetrapares och kranialnervspåverkan. Termerna akinetisk mutism och paramediant diencefalt syndrom har använts för att beskriva vissa kliniska fenotyper hos patienter som ger liten och variabel respons [10], men det saknas aktuella etablerade internationella definitioner, varför dessa tillstånd inte diskuteras mer här.
Diagnostisering och differentiering av undergrupperna
Det är svårt att vid en klinisk undersökning skilja mellan minimalt medvetandetillstånd och vegetativt tillstånd/icke-responsivt vakenhetstillstånd. Patienter som inte har svår medvetandestörning kan också felaktigt bedömas som medvetandesänkta. I en aktuell studie fann man att >40 procent av patienter med misstänkt svår medvetandestörning feldiagnostiserades när inte standardiserade, beteendebaserade bedömningsskalor användes, även av ett team med erfarenhet av dessa tillstånd [11].
Högteknologiska metoder (t ex fMRI och högdensitets-EEG) för att upptäcka tecken på medvetande har uppmärksammats alltmer [12-14]. Förmågan att kommunicera endast via modulering av fMRI-signaler har nyligen rapporterats [12], men förekommer endast i sällsynta fall. Metoderna kan också ge falskt negativa resultat genom att patienter som vid klinisk bedömning visar tydliga tecken till medvetande kan ha negativa fynd på fMRI [15].
Det är av både etiska och prognostiska skäl viktigt att ställa en korrekt diagnos avseende vegetativt tillstånd/icke-responsivt vakenhetstillstånd och minimalt medvetandetillstånd. Patienter med minimalt medvetandetillstånd har bättre prognos vad gäller långsiktigt globalt utfall än patienter med vegetativt tillstånd/icke-responsivt vakenhetstillstånd [16]. Patienter med minimalt medvetandetillstånd kan sannolikt uppleva smärta. Vid smärtstimulering av patienter med minimalt medvetandetillstånd liknar aktiveringsmönstret (registrerat med H215O-PET) nämligen det hos friska personer, vilket inte är fallet hos patienter med vegetativt tillstånd/icke-responsivt vakenhetstillstånd [17].
Prognosbedömning vid olika tidpunkter efter hjärnskadan
Läkare från olika specialiteter träffar patienten med långvarig medvetandestörning vid olika tidpunkter efter hjärnskadan. Bedömning av prognosen har dock genomgående en central roll i diskussioner med anhöriga för beslut om vårdinsatser och långtidsplanering. Här sammanfattas kunskapsläget om prognostisering av svår medvetandestörning vid olika tidpunkter efter hjärnskada.
De första dagarna efter skadan. Vid en svår traumatisk eller icke-traumatisk hjärnskada uppstår medvetandeförlust i skadeögonblicket. Majoriteten av de patienter som överlever återfår medvetandet efter en period på timmar till dagar. Moderna akutprognostiska modeller (t ex CRASH [18]) gör det möjligt att redan första dagen efter en traumatisk hjärnskada uppskatta risken för dåligt utfall baserat på akuta skadevariabler. Utfallsmåtten i dessa modeller är dock grova, t ex samlas avlidna patienter och patienter med vegetativt tillstånd och funktionsnedsättning i en grupp, och subakuta komplikationer eller eventuella rehabiliteringsinsatser beaktas inte.
Patienter med anoxisk hjärnskada efter hjärtstillestånd som inte vaknat upp inom några dagar har som grupp betraktad dålig prognos [19]. Klinisk neurologisk undersökning i kombination med neuroradiologiska och neurofysiologiska undersökningar som EEG och somatosensoriskt retningssvar medger vanligen en relativt säker bedömning av prognosen 4–5 dagar efter ett hjärtstopp [20].
Prognosbedömning vid fördröjd återhämtning av medvetandet tidigt efter andra hjärnskador har bristfälligt underlag i litteraturen.
Avslutad IVA-vård, oftast 2–6 veckor efter skadan. Fler faktorer än de akuta skadevariablerna kan teoretiskt påverka prognosbedömning vid denna tidpunkt (t ex förekomst av sekundära hjärnskador, svåra infektioner, spasticitetsutveckling m m). Erfarna specialister väger in sådana faktorer vid anhörigsamtal och rekommendationer om fortsatt vård, men en säker prognosbedömning är inte möjlig, och etablerade prognostiska modeller saknas. Klinisk erfarenhet och uppföljningsstudier talar för att prognosen generellt sett är sämre ju längre medvetandestörningen kvarstår.
Aktuella studier har dock också visat att upp till hälften av alla patienter med svår medvetandestörning vid övergång till rehabiliteringsenhet (ungefär 1 månad efter hjärnskadan) är självständiga i hemmet vid 1-årsuppföljning [16] och att några återgått i arbete [16, 21]. Efter icke-traumatisk hjärnskada är andelen patienter som återhämtar sig mindre (ca 15 procent vid 1 år) och tidsförloppet för eventuell förbättring mer utdraget [22].
Flera månader efter skadan. I äldre studier [22] angavs att möjligheten till återhämtning av medvetandet är obefintlig efter 3 månader i vegetativt tillstånd/icke-responsivt vakenhetstillstånd för patienter med icke-traumatiska skador och efter 12 månader för patienter med traumatiska skador. Man kunde då rimligen dra slutsatsen att det inte skulle vara motiverat med uppföljning eller rehabiliteringsinsatser under längre tid. Dessa studier publicerades dock innan minimalt medvetandetillstånd definierades och innan standardiserade beteendebaserade bedömningsinstrument utvecklades, vilka nu anses centrala för diagnostiken.
Flera moderna studier [16, 23, 24] har visat att en minoritet av patienter med fortsatt svår medvetandestörning flera månader efter hjärnskadan återfår medvetande i ett senare skede. Sannolikheten för återhämtning är lägre för patienter med vegetativt tillstånd/icke-responsivt vakenhetstillstånd än för patienter med minimalt medvetandetillstånd, och sannolikheten minskar med tiden [15, 24]. Efter 2 år i vegetativt tillstånd/icke-responsivt vakenhetstillstånd och 5 år i minimalt medvetandetillstånd är återhämtning mycket sällsynt; endast en fallbeskrivning där återhämtning från minimalt medvetandetillstånd konstaterades >5 år efter hjärnskadan finns i litteraturen [25].
En lägre andel av patienter med icke-traumatisk hjärnskada än av patienter med traumatisk hjärnskada återfår medvetandet, men sen återhämtning kan inte helt uteslutas för dessa patienter. En studie redovisar att 10 procent av patienter med vegetativt tillstånd/icke-responsivt vakenhetstillstånd ≥6 månader efter icke-traumatiska skador återfår medvetandet >1 år efter skadan [24].
Vård och behandling initialt efter IVA-behandling
Målet med vård och behandling i den initiala fasen är att stabilisera patientens allmäntillstånd för att möjliggöra adekvat bedömning av medvetandegraden. Patienter med svåra hjärnskador har små fysiologiska marginaler och är känsliga för såväl inre som yttre faktorer. Behandling av autonom instabilitet och reduktion av stressfaktorer är således viktig för att optimera förutsättningarna för patienten att visa tecken till medvetande. Cirkulationsstörningar, inkluderande hjärnskaderelaterad dysautonomi (dvs paroxysmal sympatikushyperaktivitet) [26], och respiratoriska komplikationer som sekretstagnation bör utredas och behandlas. Eventuell hypofysär störning behandlas.
Basala funktioner som nutrition och sömn bör optimeras. Kontraktur- och trycksårsprofylax, munhygien samt uppmärksamhet på störningar i slemhinnor, tarm och urinvägar är också av vikt.
Smärtlindring och behandling av tonusrubbning omfattar gynnsam positionering och farmakologisk behandling [27]. Neuro-/myopati vid allvarlig sjukdom kan göra det omöjligt för patienten att följa motoriska uppmaningar, och det bör beaktas. Läkemedelsbehandlingen bör ses över för att undvika onödig sedering eller negativ inverkan på hjärnans återhämtning [28].
Miljön runt patienten bör optimeras avseende sensoriska stimuli [29, 30]. Samarbete i ett interdisciplinärt team är en nödvändig förutsättning för denna s k rehabiliterande omvårdnad. I teamet kan bl a läkare, omvårdnadspersonal, dietist, sjukgymnast, arbetsterapeut, logoped, psykolog, kurator och musikterapeut ingå.
Radiologiska och neurofysiologiska förhållanden kartläggs
Behandlingsbara faktorer såsom hydrocefalus och epilepsi ska utredas och behandlas. Hydrocefalus kan ibland debutera flera veckor efter traumatisk hjärnskada [31] och är relativt vanligt förekommande också efter subaraknoidalblödning. Utebliven klinisk förbättring kan vara det enda tecknet på utveckling av potentiellt behandlingsbar hydrocefalus.
Radiologisk kartläggning av skadelokalisation samt neurofysiologisk utredning av transmission i perifera och centrala taktila, auditiva och visuella banor bör övervägas. Därmed skapas förutsättningar för en optimal klinisk bedömning med användning av standardiserade beteendebaserade bedömningsinstrument [15].
Bedömning av medvetandegrad
De enkla skattningsskalor för medvetandegrad som vanligen används i akutskedet (Glasgow coma scale och Reaction level scale) är för okänsliga för bedömning av möjlig svår medvetandestörning [11]. I stället rekommenderas Coma recovery scale–revised [32, 33]. I definitionen av minimalt medvetandetillstånd ingår att patienten visar »inkonsekventa men reproducerbara tecken till medvetande«, vilka kan missas om bedömning görs vid ett eller ett fåtal tillfällen. Bedömningen ska därför upprepas, exempelvis 5–10 gånger under 2–3 veckor [12, 15].
Sensory modality assessment and rehabilitation technique (SMART) är en alternativ metod som kan vara mer känslig [34] och kan övervägas för svårbedömda patienter. Den är dock mer resurskrävande och har liten spridning i Sverige.
Att optimera allmäntillstånd och främja medvetande
Rehabiliteringsinsatser och läkemedelsbehandling syftar till att öka graden av medvetande och respons på stimuli, att etablera någon grad av kommunikation, att optimera förutsättningarna för återhämtning samt att förebygga sekundära komplikationer. Det finns viss evidens för effekt av multimodala rehabiliteringsprogram [29, 35]. Kontrollerade studier av sådana program innebär dock mycket stora metodologiska och etiska svårigheter.
Licenspreparatet amantadin (dopaminagonist och NMDA-antagonist) har i en multicenterstudie visats vara en medvetandefrämjande behandling vid posttraumatisk svår medvetandestörning och utan allvarliga biverkningar [36]. Behandlingen gavs under samtidig interdisciplinär rehabilitering i slutenvård. Amantadin är olämpligt vid aktiv epilepsi (anfall under föregående månad). Evidensgraden för effekter av andra medvetandefrämjande läkemedel är betydligt lägre. Teoretiskt finns skäl att överväga även andra dopaminagonister, t ex bromokriptin [5]. Sömnläkemedlet zolpidem har också visats ge önskvärda paradoxala effekter i form av förhöjd vakenhet hos enstaka patienter med svår medvetandestörning [37]. En metaanalys av 22 fallbeskrivningar kunde inte påvisa någon medvetandefrämjande effekt av metylfenidat vid svår medvetandestörning [38].
Trots lovande fallbeskrivningar [39] saknas ännu evidens [40] för behandling med djup hjärnstimulering (deep brain stimulation) i klinisk verksamhet.
Svåra etiska frågor
Vården av långvarigt medvetandesänkta patienter omgärdas av svåra etiska frågor vad gäller såväl initial medicinsk utredning och prognostisering som livsuppehållande åtgärder, t ex infektionsbehandling, nutrition och vätsketillförsel, i senare skede [41]. Utredning enligt här föreslagna rekommendationer kan minimera risken för att subjektiva värderingar styr utredning och behandling och därmed risken för godtycklighet.
Vårdgivare bör ha kännedom om de begränsningar som avbildningsteknik och neurofysiologiska undersökningar är behäftade med och om att det vetenskapliga underlaget för långsiktig prognostisering ännu är begränsat [42]. Anhöriga bör informeras om detta och om förutsättningarna för återhämtning och risken för bestående funktionsnedsättning.
Vårdbegränsningar avseende hjärtåterupplivning, dialys och ibland respiratorbehandling föreligger ofta under intensivvårdsfasen och under den tidiga rehabiliteringen. Omprövning av dessa bör ske vid förbättrat kliniskt status och vid byte av vårdinstans. Utöver Socialstyrelsens föreskrifter och allmänna råd om livsuppehållande behandling (SOSFS 2011:7) finns inga formella eller juridiska stöd i dessa frågor. Enligt dessa ska patienten erhålla sakkunnig och omsorgsfull vård samt visas omtanke och respekt, oavsett eventuellt beslut om livsuppehållande behandling. Ett sådant beslut ska föregås av samråd med kollega och dokumenteras tydligt.
Kronisk fas och långsiktig uppföljning
Mot bakgrund av att moderna studier visar att sen återhämtning förekommer är en strukturerad uppföljning motiverad för att lämpliga rehabiliteringsinsatser ska kunna aktiveras vid upptäckt av förbättring av patientens tillstånd. Även optimering av patientens allmäntillstånd för att främja medvetande handlar inte bara om engångsinsatser i det postakuta skedet, utan också om aktiv uppföljning över tid. I senare skede behövs både fortsatt justering av läkemedelsbehandling (t ex mot spasticitet, epilepsi och fortsatt autonom instabilitet) och regelbunden översyn av patientens alla läkemedel för att undvika sedering samt anpassning av sittställning och hjälpmedel.
Nationellt patientregister
Svår medvetandestörning (vegetativt tillstånd/icke-responsivt vakenhetstillstånd respektive minimalt medvetandetillstånd) är en ovanlig men inte försumbar konsekvens av förvärvad hjärnskada. Tillståndet för med sig svåra etiska frågeställningar. Det är vår förhoppning att dessa rekommendationer kan bidra till att dessa patienter erbjuds ett mer likvärdigt och adekvat omhändertagande [42]. Ett nationellt patientregister enligt aktuella nationella riktlinjer i Storbritannien [15] kan med fördel utvecklas även i Sverige som underlag för utveckling av vården.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Sökstrategi för behandlingsstudier [1]
Inklusionskriterier
Sökord: »Vegetative state« och »treatment« eller »minimally conscious state« och »treatment«.
Grundkriterier: Ingår i PubMed, publicerade år 2007–2012, studier på människor, vuxna, språk: svenska eller engelska.
Artikeltyp: Orginalartiklar publicerade i referentgranskade vetenskapliga tidskrifter med följande studiemetodik: systematiska granskningar, randomiserade kontrollerade behandlingsstudier, kohortstudier, fall–kontrollstudier, fallserier.
Antal patienter: n ≥ 10.
Falldefinition: Vegetativt tillstånd/icke-responsivt vakenhetstillstånd eller minimalt medvetandetillstånd enligt etablerade kriterier.
Syfte med studien: Utvärdering av effekten av en specifik behandling för vegetativt tillstånd/icke-responsivt vakenhetstillstånd eller minimal medvetandestörning gällande funktionsnivå eller medvetandegrad.
Utfallsmått: Medvetandegrad, funktionsnivå, kommunikationsförmåga (en eller flera).
Exklusionskriterier
Studier med huvudfokus på hjärnskadans orsak eller på metoder att förebygga utveckling av vegetativt tillstånd eller minimal medvetandestörning.
Bedömning av den metodologiska kvaliteten på studierna gjordes enligt SIGN-systemet
http://www.sign.ac.uk
Fakta 2. Kliniska kännetecken
Kliniska kännetecken vid vegetativt tillstånd/icke-responsivt vakenhetstillstånd och minimalt medvetandetillstånd
Vid vegetativt tillstånd/icke-responsivt vakenhetstillstånd saknas
- tecken till medvetenhet om den egna personen och närmiljön
- förmåga att viljemässigt och målinriktat interagera spontant eller som respons på auditivt, visuellt, taktilt eller smärtsamt stimulus
- förståelig verbal kommunikation.
Vid vegetativt tillstånd/icke-responsivt vakenhetstillstånd kan följande kliniska kännetecken ses
- sömn–vakenhetscykler (cirkadiansk rytm) med ögonöppning spontant eller vid stimulering
- reflexer som grip-, sug-, palmomental-, bit- och skrämselreflexer
- bevarade hjärnstamsreflexer
- dysautonomi/autonom instabilitet med periodvis feber, takykardi, takypné, hypertoni, svettningar, förvärrad muskulär hypertonus
- svepande ögonrörelser
- tårproduktion och ljudproduktion utan relation till stimuli i omgivningen
- dekortikeringstecken (vid stimulering) med extension i nedre extremiteter och flexion/adduktion i övre extremiteter
- nedsatt/avsaknad av habituering. Habituering definieras som avtagande respons vid upprepade stimuleringar.
Vid minimalt medvetandetillstånd ses
- reproducerbar (dock inte konsekvent), viljemässig respons i relation till stimuli som tecken till medvetenhet.
Vid minimalt medvetandetillstånd kan följande kliniska kännetecken ses
- viljemässig förmåga att följa (enkla) uppmaningar
- gester eller verbalt förmedlad ja/nej-respons eller enkel verbalisering med enstaka adekvata ord utan att dessa möjliggör någon funktionell kommunikation
- målinriktade och viljemässiga diskriminativa eller affektiva beteenden (gråt, skratt) som kan uppfattas som adekvata i relation till presenterat stimuli
- ihållande visuella följerörelser.



![Figur 1. Vakenhet och medvetande. Efter Laureys [43].](https://lakartidningen.se/wp-content/uploads/EditorialFiles/EE/%5bCZEE%5d/2014-58_01_webb.jpg)