Dramatiska framsteg inom schizofreniforskningen har tillkommit genom stora internationella samarbeten.
Mer än 100 genvarianter kan i dag kopplas till schizofreni.
Dessa implicerar att t ex immunsystemet och kalciumsignalering samt glutamat- och dopamintransmission är involverade i schizofreni.
Inflammatoriska och autoimmuna processer blir allt viktigare och kan öppna dörren för nya terapier inom de närmaste åren.
Moderna avbildningstekniker kan koppla avvikelser till de nya genetiska fynden, vilket ökar kunskapen om mekanismer bakom schizofreni, t ex kognitiv dysfunktion och inflammation i hjärnan.
Fynden beräknas leda till klinisk användning av biomarkörer inom 5–10 år.
Den ökade kunskapen kommer förhoppningsvis att minska den stigmatisering som både de sjuka och deras familjer drabbas av.
Forskning om schizofreni har under de senaste åren tagit anmärkningsvärda kliv framåt. Även om vi ännu inte sett nya läkemedel baserade på de senaste årens genombrott, finns anledning till optimism.
En drivande kraft har varit »Psychiatric GWAS Consortium« med deltagande forskare från många länder [1]. Bakgrunden till detta konsortium var insikten att ärftligheten är så komplex att vi måste analysera DNA från tiotusentals patienter för att komma åt vilka gener som bidrar till schizofreni, och över 100 genvarianter har som resultat identifierats. Genetiska varianter kan nu kopplas till fenotyper som uppvisar olika läkemedelssvar, immunreaktivitet, hjärnmorfologi och kognition.
Den starkaste signalen från dessa genetiska studier ligger i HLA-regionen (humant leukocytantigen) [2]. Immunsystemets roll har tydliggjorts både med dessa genetiska studier och med studier av inflammation och autoimmuna processer. Schizofreni som debuterar i samband med stress och infektioner skulle kunna avhjälpas av nya behandlingsstrategier mot inflammation. Dock krävs då att man riktar in sig på rätt inflammatorisk komponent och att man använder läkemedel som passerar blod–hjärnbarriären.
Hjärnavbildning med funktionella analyser kan i kombination med genetik ge en bild av schizofrenisjukdomens dysfunktion. Sammantaget ser vi ett antal öppningar mot bättre diagnostik, behandling och omhändertagande av personer med sjukdomen. Goda förhoppningar finns att biomarkörer kan avgränsa olika undergrupper och ge vägledning om individanpassad terapi.
Den ökande kunskapen om sjukdomen som forskningen ger kan vara det som bryter stigmatiseringen vid schizofreni på samma sätt som inom andra medicinska områden där ökad kunskap och bättre behandlingsresultat minskat stigmatiseringen. Det finns således mycket goda skäl att satsa på forskning.
Farmakologi
Upptäckten under 1950-talet att klorpromazin kunde motverka psykotiska symtom blev början på en lång epok med dopamin D2-receptorantagonister. Denna behandlingsprincip är än i dag lika aktuell och utgör fortfarande den gemensamma nämnaren för antipsykotiska preparat [3]. Även om introduktionen av andra generationens antipsykotika har medfört förbättringar, har utvecklingen av dessa läkemedel dock inte väsentligt förändrat prognosen [4]. Fortfarande ser vi biverkningar, låg följsamhet och avsaknad av terapeutisk effekt hos många patienter.
Även om det fortfarande sker utveckling av läkemedel baserad på det mest effektiva läkemedlet klozapin, är frågan om vi nått vägs ände vad gäller utveckling av andra generationens antipsykotika. Dessutom har flera stora läkemedelsföretag lagt ned sin forskning om antipsykotiska läkemedel.
Helt klart är att läkemedelsutvecklingen har hämmats av begränsade kunskaper om den patofysiologiska bakgrunden till sjukdomen. En rad studier visar ett samband mellan immunaktivering i hjärnan och psykotiska symtom; framtidens antipsykotika kanske står att finna bland nya biologiska läkemedel som tagits fram mot autoimmuna sjukdomar. Här har skett en utveckling med selektiva cytokinantagonister, men någon klinisk studie av dessa läkemedel på patienter med schizofreni är ännu inte rapporterad [5].
Ett liknande läkemedel, minocyklin, har rapporterats ge goda effekter mot patienternas negativa symtom som adjuvans. Detta läkemedel har visats sänka aktiviteten i mikroglia och astrocyter, sannolikt genom att blockera de signaleringsvägar som initierar frisättning av cytokiner [6].
En annan möjlig måltavla för framtidens antipsykotiska läkemedel är kynureninmetabolismen, som regleras av cytokiner [7]. Denna metabolism ger upphov till N-metyl-D-aspartat (NMDA)-receptorantagonisten kynurensyra, som kan inducera psykotiska symtom. Det avgörande enzymet i syntesen av kynurensyra, kynurenin-aminotransferas II, är av intresse i detta avseende – blockad av detta enzym ger en sänkning av kynurensyra[8].
Genetik
Schizofreni har hög heritabilitet, dvs sårbarhet som kan hänföras till genetiska faktorer. Tvillingstudier har visat en heritabilitet på mellan 60 och 80 procent, bl a i ett svenskt material [9]. Det har dock visat sig vanskligt att identifiera de genetiska faktorer som bidrar till heritabiliteten. Genetikforskningen har därför varit mycket kritiserad, men stora teknologiska framsteg vad gäller metoder för genotypning och ett nytt sätt att arbeta i mycket stora konsortier har inneburit genombrott.
En stor internationell studie påvisade 2008 ökad förekomst av några ovanliga genvarianter, »varianter i antal kopior« (segmentella DNA-förändringar), vid schizofreni. Det har inte varit möjligt att identifiera dessa varianter tidigare på grund av otillräckliga patientmaterial. Ytterligare ett samverkansprojekt publicerades i Nature Genetics 2011 där ett antal riskgener för schizofreni och bipolär sjukdom beskrevs [10].
Det kanske största genombrottet inom genetik vid schizofreni kom sommaren 2014. Norska, svenska och danska forskare var centrala deltagare i ett stort internationellt konsortium som fann över 100 vanliga genvarianter med ökad risk för schizofreni [11]. För att få statistisk styrka ingick 36 989 patienter och 113 075 friska kontroller, den största genetiska studien, som gjorts inom psykiatrin. Studien visade att schizofreni har en polygen arkitektur, dvs att det finns en rad genvarianter som var för sig har liten effekt men tillsammans bidrar till ökad sjukdomsrisk. Till skillnad från de ovanliga kopiegenvarianterna har de vanliga genvarianterna mycket mindre effekt (ca 1,1–1,2 gånger ökad risk). Detta gör att de är vanskliga att hitta, men med ett stort antal personer och användning av s k helgenomundersökning (GWAS) kunde dessa varianter med små effekter identifieras.
Arbetet möjliggjordes genom att många forskare slöt sig samman i det internationella »Psychiatric GWAS Consortium« under ledning av professor Patrick Sullivan, nyligen rekryterad till Karolinska institutet i Stockholm. Konsortiet har nu utökat dessa genetiska multicenterstudier till att omfatta flertalet psykiska sjukdomar. Två jämförande studier har påvisat stor överlappning vad gäller genetiska riskvarianter mellan olika sjukdomar [9, 12]. Även läkemedelssvar studeras med denna typ av genetik [13].
Flera av genvarianterna är lokaliserade i gener som har biologiskt intressanta funktioner. Många av dem uttrycks i hjärnan och i nervceller, något som ökar chansen att utreda sjukdomsmekanismerna för schizofreni [14]. Dessutom har man funnit flera genvarianter som uttrycks i vävnader med viktiga roller i immunförsvaret, t ex HLA-regionen [2]. Detta ger stöd för att det finns en möjlig koppling mellan immunfaktorer och schizofreni [15]. Vidare har man kunnat bekräfta betydelsen av gener inblandade i dopaminerg funktion [16]. Andra genvarianter associerade till schizofreni påverkar jonkanaler för kalcium och glutamatreceptorer [17]. Resultaten måste följas upp med funktionella studier för att belysa patofysiologin vid schizofreni.
Dessa viktiga genombrott kommer att ge ny kunskap om sjukdomsmekanismer och bidra till utveckling av nya läkemedel samt ge fingervisningar om hur befintliga läkemedel kan användas på ny indikation. Många av fynden ger ännu inte någon praktisk klinisk nytta, och de ovanliga varianterna (varianter i antal kopior) har så låg prevalens att det inte är praktiskt användbart att screena för dem. De vanliga varianterna bidrar också otillräckligt till klinisk nytta, eftersom de har liten effekt och även finns hos många friska. Det är dock önskvärt att bygga vidare på dessa viktiga fynd för framtida klinisk nytta med fokus på att använda genetisk kunskap för att individualisera behandlingen [18].
Immunsystemet
De flesta av oss som haft en infektion vet att den påverkar vårt beteende. Vi blir trötta och initiativlösa och kan uppleva kognitiva problem, alltifrån försämrad uppmärksamhet till svårigheter att komma ihåg händelser i närtid. Orsaken anses vara en aktivering av det perifera immunsystemet som via cytokiner kommunicerar med hjärnan och inducerar ändamålsenliga beteenden [19]. Intresset för hjärnans cytokiner har ökat dramatiskt, och flera studier tyder på att dessa »immunsystemets signalmolekyler« kan medverka i patofysiologin bakom flertalet psykiska sjukdomar [20]. Upptäckterna inger hopp om att vi ska få bättre förståelse för sjukdomsmekanismerna och att nya läkemedel ska kunna utvecklas.
Utöver infektioner kan genetiska förändringar bidra till ökad produktion av cytokiner. Flera av de gener man funnit vid schizofreni har förmågan att öka aktiviteten i de signaleringsvägar som leder till att vissa cytokiner produceras i överskott. Många av de gener som är förändrade vid schizofreni uttrycks i vävnad som spelar en viktig roll för vårt immunsystem. I den stora GWAS-studien (se ovan) fann man också att flera gener som påverkade glutamaterg neurosignalering var förändrade hos patienterna [10].
Med molekylär hjärnavbildningsteknik, positronemissionstomografi (PET), har man nyligen kunnat påvisa aktivering av mikroglia hos patienter med schizofreni [21, 22]. Dock är dessa fynd i viss mån ifrågasatta. Intressant är att mikroglia har den viktigaste rollen för immunförsvaret i det centrala nervsystemet. Andra studier visar att vissa cytokiner är förhöjda såväl centralt som perifert vid schizofreni [23]. Studier av ryggmärgsvätska visar att både cytokinen interleukin (IL)-1b och IL-6 är förhöjda hos patienter [24, 25]. Epidemiologiska studier visar att det finns ökad risk att drabbas av schizofreni om man har haft en hjärninfektion under småbarnsåren [26]. Detsamma gäller influensaepidemier, som ger ökad risk för de barn som fötts under dessa perioder att i vuxen ålder drabbas av schizofreni [27].
Finns det då något samband mellan ett aktiverat immunförsvar och de två dominerande hypoteserna för schizofreni, dvs dopaminhypotesen och glutamathypotesen? Med stor sannolikhet är det så. Som nämnts ovan har flera olika cytokiner, bl a IL-1b och IL-6, förmågan att aktivera syntesen av s k kynureniner. Studier har visat att en av dess metaboliter, kynurensyra, bildas i högre utsträckning i hjärnan hos patienter med schizofreni [28] och hos patienter med bipolär sjukdom med psykossymtom. Kynurensyra har förmågan att blockera -NMDA-receptorer och har i experimentella studier visats leda till överaktivering av hjärnans subkortikala dopaminsystem och ge kognitiva besvär [7]. Kynurensyra skulle därför kunna vara en länk mellan immunsystemet och förändrad aktivitet i hjärnans dopaminerga och glutamaterga system.
Med hjälp av PET är det möjligt att in vivo mäta förekomst av proteiner i hjärnan. Metoden har använts för att bekräfta dopaminhypotesen vid schizofreni genom att visa på samband mellan blockad av dopaminreceptorer och behandlingseffekt [29]. Tidiga studier inom området ligger till grund för dagens riktlinjer om låg dosering. Vidare har ett flertal PET-studier påvisat förhöjd amfetaminutlöst dopaminfrisättning och ökad dopaminsynteskapacitet hos patienter med schizofreni [30]. Det sistnämnda har på senare tid visat sig kunna predicera både insjuknande i psykossjukdom och behandlingseffekt av antipsykotika. PET-forskningen har använts för studier av immunmarkörer såsom mikrogliaaktivering. Utvecklingen av mikro-PET-system för djurmodeller utgör även en unik möjlighet att underlätta kunskapsöverföringen mellan klinisk och preklinisk forskning.
Autoimmunitet
Tidigare trodde man att blod–hjärnbarriären hindrade passage av immunceller och antikroppar till hjärnan, men nu vet vi att barriärfunktionen kan rubbas och hjärnan utsättas för autoimmunt angrepp. Patienter med schizofreni och deras förstagradssläktingar har ökad förekomst av autoimmuna sjukdomar [31]. Ett expanderande forskningsfält är paramaligna och andra sjukdomar associerade med autoantikroppar riktade mot neuronala strukturer [32]. Beroende på antikroppens molekylära mål får man olika symtombilder. En antikropp kan t ex aktivera en receptor, blockera den för dess naturliga ligand(er) eller modifiera dess funktion [33].
Anti-N-metyl-D-aspartat-receptorencefalit (anti-NMDAR-encefalit) har blivit en modellsjukdom för antikroppsmedierade sjukdomar som angriper centrala nervsystemet [34, 35]. Anti-NMDAR-encefalit är i dag sannolikt underdiagnostiserad och kan förväxlas med schizofreni och bipolär sjukdom, eftersom vanföreställningar, hallucinationer och affektiva svängningar är vanliga symtom. I en retrospektiv analys av biobanksmaterial från 121 patienter med schizofrenidiagnos fick 2 patienter sin diagnos reviderad till anti-NMDAR-encefalit [36]. Oftast förekommer även neurologiska symtom i form av epileptiska anfall samt katatona symtom med avvikande motorik, mutism och autonom instabilitet. Diagnostiken baseras på en kombination av karakteristiska symtom tillsammans med förekomst av patologiska antikroppar i ryggmärgsvätska.
Evidensbaserade behandlingsriktlinjer saknas, men i observationsstudier svarade över 75 procent av patienter med verifierad anti-NMDAR-encefalit på behandling med antingen operation av tumör (i de fall en sådan orsakade autoimmuniteten) eller aktiv immunterapi med steroider, intravenöst immunglobulin (IVIg) eller plasmaferes och rituximab eller cyklofosfamid [37].
Under de senaste åren har autoimmunitet mot strukturer i hjärnan associerade med psykiska och neurologiska symtom identifierats (Tabell I), och det finns skäl att tro att det finns ytterligare oupptäckta liknande samband. Dagens forskning siktar på att karakterisera dessa sjukdomar, förbättra och standardisera diagnostik, utveckla modeller för att förstå sjukdomsmekanismer och optimera behandlingen.
Hjärnavbildning
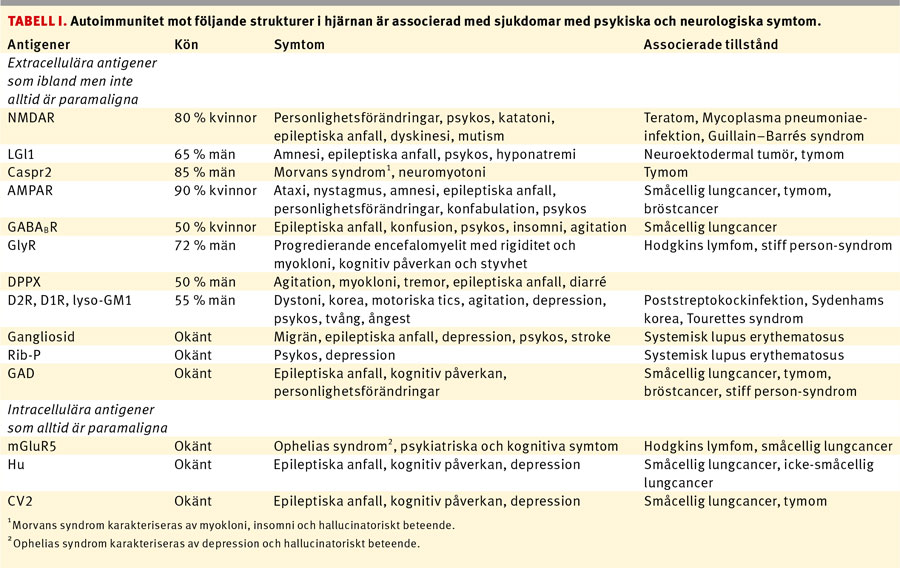
Magnetresonans (MR)-avbildning är en teknik som bidragit till framsteg i schizofreni- och kognitionsforskning. MR kombinerar avbildning med in vivo-kvantifiering av biokemiska vävnadskarakteristika och flödesdynamik och medger strukturella och funktionella hjärnstudier på hög detaljnivå. Fynden överlappar gentemot variationen hos friska. En MR-undersökning är därför inte tillräcklig för att ställa diagnos i det enskilda fallet; de relativt diskreta förändringarna kräver att man jämför mellan grupper av personer.
Hjärnvolymen vid schizofreni är på gruppnivå något mindre, och de tydligaste strukturella förändringarna är måttligt ökad volym av hjärnventriklarna, minskad hippocampusvolym och frontotemporal förtunning av hjärnbarken [38]. Hippocampus indelas i anatomiska komponenter, och reduktioner i dessa komponenter liksom i flera subkortikala hjärnstrukturer ses vid schizofreni och i något mindre grad vid bipolär sjukdom [39]. Temporalloberna är mindre, särskilt bakre delen av superiora temporala gyrus med auditiva kortex och Wernickes språkområde. Genom studier med funktionell MR-avbildning (fMRI) påvisas hyperaktivering i temporala neuronala nätverk under hallucinos [40]. De basala gangliernas volym kan öka vid behandling med antipsykosläkemedel [41]. Flera studier stödjer att minskningen av grå hjärnsubstans över lång tid (12 år) kan tillskrivas effekter av omgivningsfaktorer, t ex exponering för neuroleptika [42].
Redan i början av 1900-talet introducerades uppfattningen att de psykotiska sjukdomarna härrör från förändrade förbindelser mellan olika hjärnområden [43]. fMRI visar avvikelser i exekutiv funktion, verbalt minne, perception och affektreglering, men anmärkningsvärt få resultat sammanlänkar strukturella och funktionella förändringar. Genom vilo-fMRI observeras störningar mellan olika funktionella nätverk i hjärnan och även specifikt under rösthallucinos [44]. Med diffusionstensoravbildning påvisas förändringar i fiberbanor som förbinder prefrontal- och temporallober men även corpus callosum, cingulum och frontalloben [45]. Diffusionstensoravbildning är känslig för myelinisering och kan följas över olika åldrar. Hypoteser om tidiga störningar i hjärnutvecklingen stöds av avvikelser i hjärnbarkens veckning, vilken till stor del är färdig under den senare fostertiden [46]. Ett intensivt forskningsfält är att finna hjärnmarkörer som predicerar schizofreniutveckling hos en riskindivid, men detta saknar ännu klinisk tillämpning.
Glutamaterga avvikelser har påvisats med MR-spektroskopi och kan korreleras till funktion [47]. En särskild tillämpning av fMRI-tekniken som under det senaste decenniet gjort stora landvinningar är kognitiv neurovetenskap – en forskningsgren som kombinerar kognitionspsykologi och funktionell hjärnavbildning. Forskningen kartlägger vilka mekanismer som skapar psykotiska symtom baserat på kunskap om hjärnans informationsbearbetning. En av hjärnans främsta uppgifter är att jämföra inkommande signaler med tidigare kunskap och förväntan som finns lagrad i hjärnan. Hjärnans förväntan har stor betydelse för hur vi uppfattar omvärlden. Om de inkommande signalerna inte stämmer med hjärnans förväntan om världen måste den uppdateras. Denna balans har visat sig vara rubbad i den psykotiska hjärnan, och det pågår forskning som har potential att förklara utvecklingen av vanföreställningar på informationsprocessnivå [48].
Med tanke på den höga ärftligheten vid schizofreni pågår forskning om sambanden mellan hjärnans struktur/funktion och genvariation [49]. Det finns viss evidens för genetiska samband mellan hjärnfunktion och hippocampusvolym vid schizofreni [50].
I dag används ännu inte hjärnavbildning i schizofrenidiagnostik men däremot för att utesluta hjärnsjukdom av annan art. I framtiden är det dock sannolikt att användandet av multimodala analysmetoder, där man fusionerar information från olika MR-metoder med PET eller EEG, skulle kunna vara en del av både diagnostik och prediktion av utfall och behandling.
Kognitionsforskning
Flera metaanalyser visar lägre kognitiv nivå hos patienter med schizofreni än hos friska kontroller. Nyligen publicerades den första metaanalysen på neuroleptikanaiva patienter, vilken påvisar störst nedsättning i de kognitiva domänerna verbalt minne, processhastighet och arbetsminne [51]. Kognitiva nedsättningar har även konstaterats hos individer med förhöjd risk för psykos och hos anhöriga till patienter med schizofreni [52]. Detta tyder på att kognitiva nedsättningar skulle kunna utgöra en endofenotyp för schizofreni, och förhoppningen är att kunna koppla dem till biomarkörer inom genetik, inflammation, autoimmunitet, MR-fynd och neurotransmission. När väl psykosen debuterat verkar de kognitiva nedsättningarna vara relativt stabila, men det är fortfarande oklart om de funnits där sedan barndomen eller om det föreligger en försämring i samband med psykosdebuten [53].
I dag fokuseras läkemedelsutvecklingen till kognitionsförbättrande egenskaper, eftersom försämrad kognitiv förmåga tydligt kopplats till försämrat funktionellt utfall. Som ett led i detta tillskapades MATRICS (Measurement and treatment research to improve cognition in schizophrenia), som är det enda godkända testbatteriet för att utvärdera kognition i samband med läkemedelsprövningar. Det inbegriper sju kognitiva domäner: processhastighet, verbalt minne, visuellt minne, arbetsminne, uppmärksamhet, exekutiv förmåga och social kognition. Man har standardiserat utfallsmåttet för att kunna erhålla jämförbara data [54].
Djurstudier har visat ett samband mellan förhöjda inflammationsmarkörer och kognitiv dysfunktion. Man har kunnat visa att förhöjda nivåer av kynurensyra hos råttor har samband med sämre spatialt arbetsminne [55]. Det pågår forskning på patienter för att undersöka kopplingen mellan inflammationsmarkörer och kognition. Man har bl a kunnat påvisa att patienter med bipolär sjukdom med psykotiska inslag och förhöjda halter av kynurensyra uppvisar sämre exekutiv förmåga [56]. Om man kan påvisa ett samband mellan inflammatoriska processer i hjärnan och kognition, skulle helt nya behandlingsmöjligheter med antiinflammatoriska substanser kunna användas i syfte att bevara och förbättra patienternas kognition. Minocyklin utgör ett sådant exempel [6].
Stora prospektiva studier behövs
De mycket stora datamängderna från genetik behöver kopplas bättre till immunologi, farmakologi, avbildningstekniker och kognition med hjälp av avancerad bioinformatik. Epigenetiska studier är nödvändiga, men svåra, eftersom de kräver tillgång till hjärnvävnad. Det innebär att hjärnbanker behöver utvecklas.
Vidare behövs stora prospektiva studier som påbörjas redan vid sjukdomsdebut så att vi får en klar bild av progression och bättre kan förstå effekten av läkemedel över längre tid, gärna kombinerade med integrerade data från olika avbildningstekniker.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-05-26)