Ascites är i de flesta fall orsakad av bakomliggande levercirros.
Huvudpatofysiologi är portal hypertension med retention av natrium och vatten.
Anamnes, klinisk undersökning och analys av ascitesvätska säkerställer etiologin i de flesta fall.
Måttlig saltrestriktion och behandling med diuretika är hörnpelare i behandlingen.
NSAID och ACE-hämmare bör undvikas hos patienter med cirros.
Ascites (grekiskans askos; säck) är den vanligaste komplikationen till levercirros, och 75–85 procent av patienter med ascites har cirros som bakomliggande orsak. Inte sällan kommer patienten spontant till akuten med tilltagande bukomfång eller med remiss från primärvården med fråga om ascites. Debut av ascites är förknippad med ökad risk för utveckling av andra komplikationer till cirros samt låg livskvalitet och dålig prognos. 1-årsmortaliteten är ca 15 procent, och bara hälften av patienterna överlever 5 år [1].
Patofysiologi
Vid fibrosutveckling i levern ökar resistansen i portakretsloppet (portal hypertension) via lokal produktion av framför allt kväveoxid och andra vasoaktiva substanser [2]. Initiering av denna process är inte helt känd, men endoteluttänjning och bakteriell translokation är viktiga komponenter [3, 4]. Detta ger stark arteriell vasodilatation i splanknikusområdet och därmed minskning av systemisk kärlresistans och blodtryck.
I tidigt skede kompenseras detta genom aktivering av sympatikus och renin–angiotensin–aldosteronsystemet. Därefter ökar vasodilatationen och blodtrycket sjunker, antidiuretiska faktorer aktiveras och den glomerulära filtrationen minskar, vilket ger retention av vatten och natrium. Tillsammans med hypoalbuminemi utvecklas då ascites och ödem.
Här uppstår ofta hyponatremi, som i nästan alla fall är hypervolem (utspädningshyponatremi), om inte patienten behandlas med höga doser diuretika. Risken att drabbas av hepatorenalt syndrom är ökad.
Utredning och bedömning
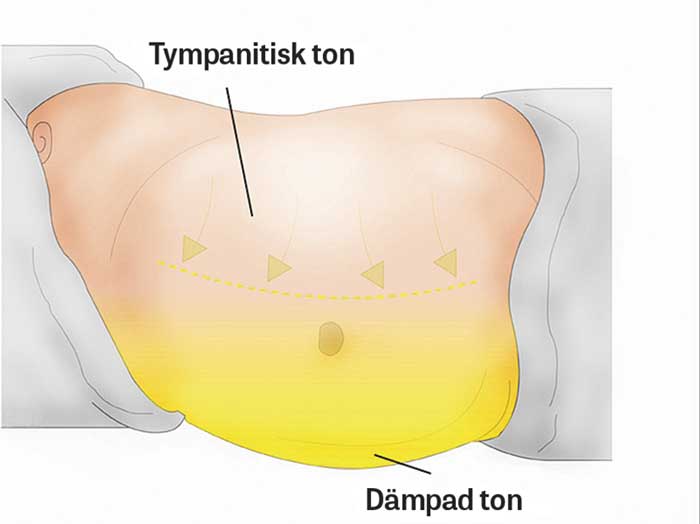
Den kliniska ascitesbedömningen kan vara svår, framför allt hos överviktiga patienter. Oftast ger noggrann anamnes med frågor om riskfaktorer för leversjukdom samt klinisk undersökning rätt diagnos. Ascites detekteras med perkussion och fynd av höjd gräns mellan dämpad och tympanitisk ton och förflyttning av denna gräns vid sidoläge (Figur 1). Vågslagsfenomenet är svårare att bedöma och kräver oftast större mängder ascitesvätska [5] (Figur 2).
Abdominell ultraljudsundersökning kan nu oftast genomföras bedside och har mycket hög sensitivitet för detektion av även liten mängd ascitesvätska. Den kan också påvisa t ex hepatocellulär cancer, portavenstrombos eller levervenstrombos (Budd–Chiaris syndrom) som orsak eller komplikation till ascites.
För att kartlägga ascitesetiologin och utesluta spontan bakteriell peritonit som orsak till försämring bör alla patienter med nydiagnostiserad ascites och cirrospatienter med ascites som läggs in genomgå diagnostisk laparocentes [6]. En albumingradient serum/ascites på >11 g/l säkerställer portal hypertension som genes med >95 procents säkerhet [7] (Tabell 1). Analys av LPK och polymorfkärniga leukocyter i ascitesvätska bör göras vid varje vårdtillfälle; förekomst av >0,25 × 109/l polymorfkärniga leukocyter bekräftar diagnosen spontan bakteriell peritonit [8], som ska behandlas med cefotaxim eller annan tredje generationens cefalosporin.
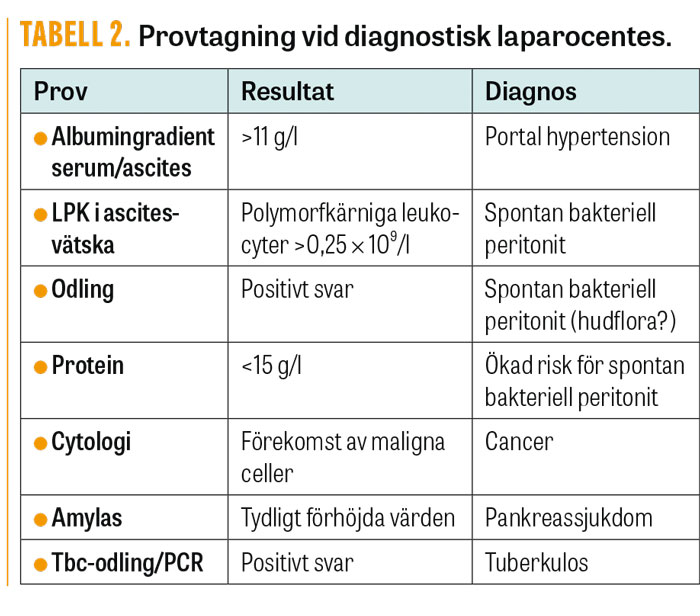
Aeroba och anaeroba odlingar (på varm ascitesvätska) ska alltid tas för att kunna smala av antibiotikabehandlingen. Total-protein <15 g/l i ascitesvätska medför ökad risk för utveckling av spontan bakteriell peritonit, och primärprofylaktisk antibiotikabehandling kan övervägas [9]. Övriga analyser som amylas, cytologi, PCR och odling för tbc görs vid oklar etiologi eller riktad misstanke (Tabell 2).
Behandling
Basala principer. Utsöndring av natrium måste överstiga intaget, varför saltintaget begränsas till ca 2 g (90 mmol) per dag. Av praktiska skäl rekommenderas att man undviker mat med hög salthalt och att man inte saltar extra.
Det är negativ saltbalans, inte negativ vätskebalans, som mobiliserar ascites, eftersom vätskan följer passivt med natrium. Ascites och normalt S-Na innebär därför inte nödvändigtvis vätskerestriktion, men minskning av vätskeintag till 1 500 ml/dag kan underlätta att uppnå negativ vätskebalans. Restriktionen är viktig hos patienter med utspädningshyponatremi (S-Na <125 mmol/l), och intaget begränsas då helst ner till 1 000 ml/dag. Låga natriumhalter i serum ska inte behandlas med natriuminnehållande dropp. Undantaget är patienter med hyponatremi och samtidig hypovolemi. En för snabb korrigering av hyponatremin är sannolikt mycket farligare för patienten än hyponatremin i sig [10].
De flesta patienter behöver sedan diuretika eller laparocentes i kombination med diuretika.
Diuretika. Eftersom aktivering av renin–angiotensin–aldosteronsystemet medför ökad reabsorption av natrium i distala tubuli, är spironolakton (aldosteronantagonist) förstahandsalternativet. Tillägg av loop-diuretika ger sedan ökad vattenutsöndring. Spironolakton i singelterapi ger mindre behov av dosjusteringar och lägre risk för kraftig diures med utveckling av hypokalemi och njursvikt. Denna terapi kan med fördel användas hos polikliniska patienter med mindre mängd ascitesvätska [11]. Målet med behandlingen är viktnedgång på max 0,5 kg per dag hos patienter utan perifera ödem och 800–1 000 g per dag hos ödematösa patienter.
Spironolakton och furosemid tillsammans ger snabbare mobilisering av ascites, och många patienter behöver kombinationsbehandling [12]. På grund av spironolaktonets långsamt insättande effekt anpassas dosen veckovis. Lämpliga initialdoser är 100 mg spironolakton och 40 mg furosemid.
Behandlingen kan justeras med hjälp av kvoten natrium/kalium i urin. Ett stickprov korrelerar väl med den totala natriuresen och är mycket enklare att genomföra än dygnsurinmätning. En kvot >1 talar för adekvat natriures, och patienten borde gå ner i vikt. Om inte, bör saltrestriktionen kontrolleras och/eller furosemiddosen ökas. En kvot <1 talar för fortsatt uttalad natriumreabsorption och borde föranleda dosökning av aldosteronantagonist. På grund av risken för elektrolytrubbningar och njurpåverkan bör kontroll av serumelektrolyter och kreatinin företas ofta.
Maxdoser för spironolakton och furosemid är 400 mg respektive 160 mg. Högre doser ger ingen ytterligare effekt utan ökar enbart risken för biverkningar. Eplerenon är en nyare aldosteronantagonist som är mer selektiv för aldosteronreceptorn än spironolakton. Risken för biverkningar, t ex gynekomasti, är lägre. Eplerenon är undersökt hos hjärtpatienter; någon kontrollerad randomiserad studie beträffande effekt hos patienter med ascites finns inte. Vid smärtsam gynekomasti kan byte till ekvipotenta doser testas.
Laparocentes. Vid spänd eller symtomatisk ascites behövs laparocentes i terapeutiskt syfte. Genom tappning av all vätska förkortas vårdtiden, och risken för komplikationer som encefalopati, hyponatremi och njursvikt är lägre än vid enbart diuretikabehandling [13]. Tappning av stora mängder (>5 l) ascitesvätska ökar risken för cirkulatorisk dysfunktion med komplikationer som snabb återkomst av ascites, hyponatremi och hepatorenalt syndrom. Detta motverkas genom administration av albumin, 8 g per liter avlägsnad ascitesvätska, efter eller under laparocentesen. Albumin har visat sig vara överlägset andra plasmaexpandrar vid tappning av stora mängder ascites även beträffande mortalitetsvinst [14].
Laparocentes görs i vänster (eller höger) fossa under navelnivå och lateralt om de epigastriska kärlen, ej på ställe med stor lever/mjälte eller operationsärr. Användning av plasma före laparocentes rekommenderas i allmänhet inte eftersom PK(INR) hos leversjuka patienter inte återspeglar blödningsrisk på grund av minskad produktion av både pro- och antikoagulativa faktorer. Trombocyter kan övervägas vid värden <50 × 109/l. I en större studie förekom inga blödningskomplikationer vid 1 100 laparocenteser trots förekomst av PK(INR) upp till 8,7 och trombocyter ner till 19 × 109/l (inte samma patient) [15].
Tappning av ascitesvätska löser inte det underliggande problemet, dvs natrium- och vattenretentionen. Efter tappningen behöver patienterna därför behandling med basala åtgärder och diuretika för att förhindra återkomst av ascites. Om refraktär ascites utvecklas eller patienten inte tål diuretika på grund av t ex kreatininstegring, kan transjugulär intrahepatisk portosystemisk shunt övervägas för att minska portal hypertension och ascitesbildning. Alternativet, återkommande tappningar, kan vara besvärande och ger ofta rekyleffekt med ökande symtom.
Fallgropar. Icke-steroida antiinflammatoriska läkemedel (NSAID) är kontraindicerade vid levercirros. NSAID hämmar njurarnas prostaglandinsyntes, minskar den glomerulära filtrationen och kan utlösa akut njursvikt. På grund av risken för njurpåverkan ska även andra läkemedel med känd nefrotoxicitet undvikas (t ex aminoglykosidantibiotika). ACE-hämmare och angiotensinantagonister orsakar hypotoni, ökad portal hypertension och njursvikt hos ascitespatienter som har kraftigt aktiverat renin–angiotensin–aldosteronsystem, och de bör därför sättas ut.
Många patienter behandlas med icke-selektiva betablockerare som blödningsprofylax mot esofagusvaricer. Nyare studier tyder på ökad mortalitet hos patienter med ascites, och mycket talar för att åtminstone patienter med refraktär ascites bör avstå från denna behandling [16]. Det finns också studier som visar att karvedilol, som även blockerar α-receptorer, ger mer effektiv sänkning av portatrycket än propranolol [17]. Dess användning kan dock begränsas av större sänkning av systemiskt blodtryck, med potentiellt negativa konsekvenser hos patienter med cirros.
Riktlinjer
Riktlinjer för utredning och behandling av cirrosorsakad ascites finns publicerade både på nationell nivå via Svensk gastroenterologisk förening [18] och internationellt via europeiska och amerikanska hepatologiska föreningar [6, 19].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs mer: