Under de senaste decennierna har flera sjukdomar överförda av stickmyggor, som denguefeber, chikungunyafeber och zikavirusinfektion, orsakat stora epidemier samtidigt som nya framsteg gjorts i malariakontrollen.
De moderna transportsystemen möjliggör snabb spridning av stickmyggor och patogener världen över.
Även i Europa och Norden finns ett antal arter av stickmyggor som är potentiella vektorer för olika sjukdomar.
Mot de flesta sjukdomar överförda av stickmyggor finns varken vacciner eller specifik behandling.
En bättre förståelse av situationen och transmissionsdynamiken behövs för effektiv övervakning och beredskap. Behovet av nya vacciner och global tillgång till information, vård och prevention är stort.
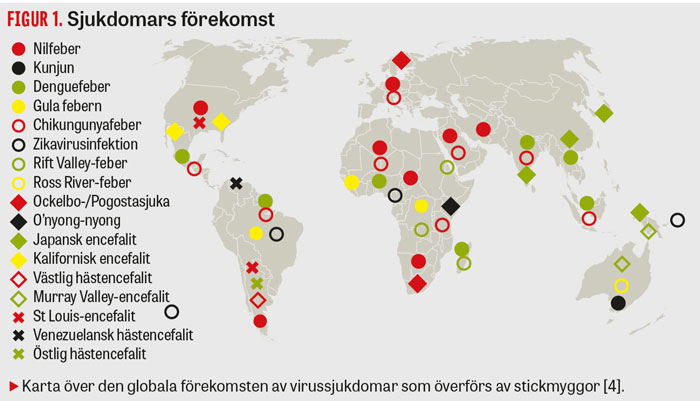
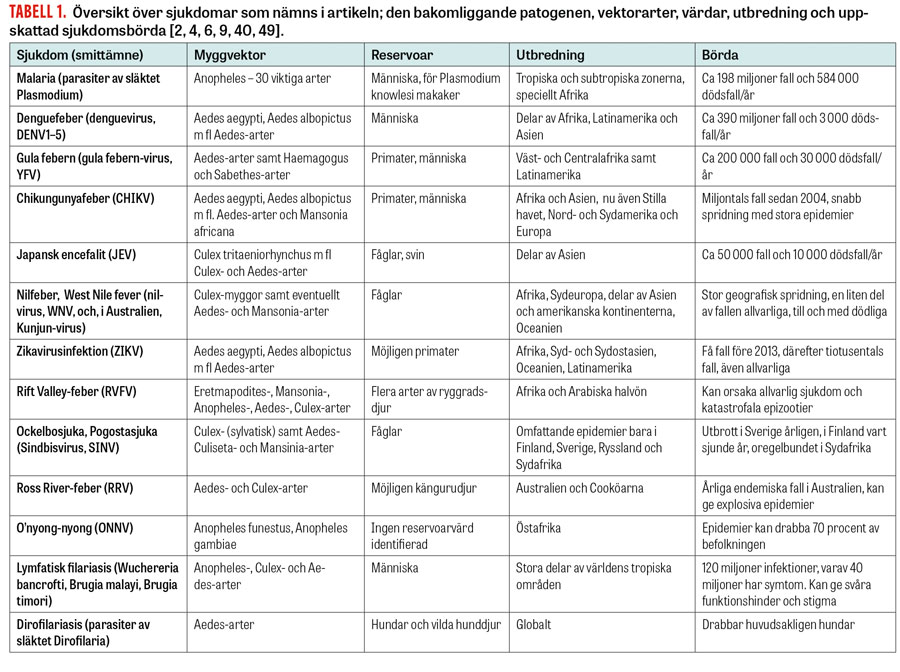
Utbredningen av de sjukdomar som orsakas av mikrober överförda av stickmyggor har förändrats mycket under de senaste decennierna. Många kända virus har orsakat större utbrott än tidigare och nått nya geografiska områden [1]. Denguefeber är den myggöverförda virussjukdom som spritt sig snabbast, med hundratusentals insjuknanden per år spridda över alla kontinenter. Även chikungunyafeber har under det senaste decenniet orsakat stora epidemier [2] och nyligen svept in över Centralamerika [3]. Denguefeber, chikungunyafeber och japansk encefalit har belastat Sydostasien tungt [4] och sedan början av 2012 också drabbat Stillahavsregionen, se Figur 1. Dessa virus har följts av det mindre kända zikaviruset [5] som nyligen även misstänkts orsaka fosterskador i Brasilien [6].
Det första utbrottet av chikungunyafeber i Italien 2007 visade att myggöverförda virus som tidigare uppfattats som tropiska även kan smitta i tempererade zoner [7]. Tre år senare rapporterades denguefeber för första gången ha överförts inom Frankrikes gränser [8].
Samtidigt som virusutbredningen visat sig svårkontrollerad har insatserna mot malaria, som fortfarande är den myggburna sjukdom som orsakar flest dödsfall, givit resultat. Mellan år 2000 och 2013 har den globala malariadödligheten sjunkit med 47 procent och prevalensen med 26 procent. Sjukdomen är ändå fortfarande ett enormt problem i Afrika söder om Sahara, och att helt eliminera den är ett komplicerat projekt [9].
Orsakerna bakom förändringarna i spridningen av sjukdomar som överförs av stickmyggor väcker allt större intresse. Den här artikeln ger en översikt av diskussionen kring ämnet.
Smittornas dynamik
Myggöverförda patogener upprätthålls i ekologiska system där minst en myggart med förmåga att sprida smittan (vektor) överför patogenen mellan individer i minst en mottaglig population av ryggradsdjur (reservoar). Största delen av sjukdomarna är zoonoser [1]. Till exempel nilviruset (West Nile virus) uppnår inte tillräckligt höga koncentrationer i människor för att bli smittsamt, utan viruset cirkulerar huvudsakligen bland fåglar [4]. Vektorburna zoonoser kan ibland infektera människor när så kallade brovektorer [10] för smittan över artgränsen.
De fyra viktigaste malariaparasiterna samt dengue- och o’nyong-nyongvirusen har människan som huvudsaklig reservoar [9, 4, 1]. Gula febern och chikungunyafeber kan cirkulera både bland människor och bland andra primater, och man skiljer mellan urban och sylvatisk transmission [4, 11, 3].
Man ofta talar om patogenernas transmissionscykler, men termen transmissionsnätverk ger en bättre beskrivning av systemen som mikroberna rör sig i. Risken för smitta är kraftigt beroende av ekologin och växelverkan i tid och rum mellan patogener, vektorer, människor och eventuellt andra ryggradsdjur [11, 12]. I och med sjukdomarnas ökade spridning ökar också insatserna för att förstå dessa komplexa system och hur de påverkas av aktuella förändringar i miljö och samhälle.
Ökad rörlighet hos människor, myggor och patogener
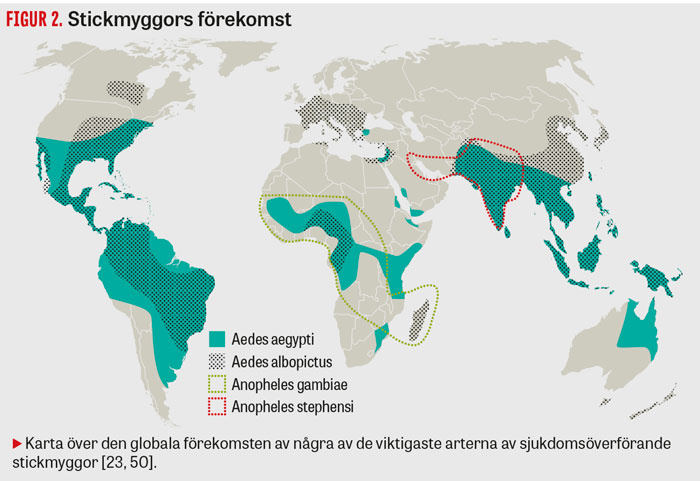
Växande handelsvolymer och allt snabbare transport av människor, djur och varor mellan länder i hela världen har haft en avgörande betydelse för utbredningen av stickmyggor och patogener [13], Figur 2. I subtropiska och tropiska fartygshamnar är gula febern-myggan, Aedes aegypti, ofta vanlig. Honorna av den arten kan lägga sina uttorkningståliga ägg i bildäck och andra regnvattensamlande strukturer på fartyg som trafikerar världshaven. När ett sådant fartyg anlöper en hamn i till exempel Sydeuropa eller södra USA kan nyligen kläckta, blodsökande gula febern-mygghonor lämna fartyget för att suga blod från människor på fastlandet [7, 14]. Den asiatiska tigermyggan Aedes albopictus har spridits från Asien med bland annat växter och begagnade bildäck och etablerats i nästan alla amerikanska länder samt i delar av Europa, Västafrika och Mellanöstern [14].
Också malariavektorn Anopheles stephensi verkar under de senaste åren ha spridit sig från sina tidigare utbredningsområden i södra Asien och på Arabiska halvön till den afrikanska kontinenten. Nya, allvarliga utbrott av urban Plasmodium falciparum-malaria i Djibouti på Afrikas horn har väckt oro för vad en ytterligare spridning av vektorn kunde innebära för Afrikas städer [15]. Den afrikanska malariamyggan Anopheles gambiae har däremot knappt spridits från sin hemkontinent där trafiken till andra regioner med lämpliga förhållanden har varit relativt begränsad [13]. Av de afrikanska malariavektorerna har Anopheles arabiensis fått störst utbredning tack vare att den tål torka och kan anpassa sitt beteende till olika miljöer. Arten har också en tendens att stickas utomhus, vilket gör den svår att kontrollera [16].
En ny vektorart kan öka risken för överföring av en sjukdom på ett område genom att själv bära med sig patogenen, eller genom att delta i överföringen av en patogen som sedan tidigare finns i området. Till exempel har dirofilariasis bland människor blivit vanligare i Italien sedan Aedes albopictus etablerade sig där [17]. Det händer också att nyintroducerade vektorarter konkurrerar ut gamla vektorarter från sina utbredningsområden, vilket kan öka eller minska sjukdomsrisken beroende på hur effektiva vektorer de olika arterna är [12].
Spridningen av patogener som har människan som reservoar främjas av migration och, i allt större utsträckning, turism. Etableringen av denguefeber på ett nytt område sker ofta genom att viruset importeras av en smittad människa. Chikungunya- och denguevirusen kan potentiellt importeras till Europa av hundratusentals resande årligen, och kan börja överföras lokalt på områden där lämpliga vektorer kommit åt att etablera sig [7]. Malaria har importerats till bland annat Grekland i samband med arbetskraftsinvandring [18]. Krig världen över har orsakat malariaepidemier genom att försvåra kontrollinsatser och mobilisera människopopulationer som soldater och flyktingar [19]. Även den nu pågående flyktingvågen utgör en möjlig rutt för import av patogener. En nyintroducerad patogen kan orsaka stora epidemier då befolkningen har låg immunitet [7, 4].
Myggöverförda patogener kan också introduceras genom andra värdarter som rör sig på egen hand eller transporteras av människor. De överraskande utbrotten av gula febern i Brasilien kan ha varit en följd av illegal handel med apor som fungerar som reservoar för viruset i djungeln [20]. Virus som cirkulerar bland flyttfåglar, som nil- och Sindbisvirus, kan infektera vektorer långt från området där fåglarna blivit smittade [21, 22].
I Norden är Sindbisviruset, som orsakar Ockelbosjuka i Sverige och Pogostasjuka i Finland, den viktigaste patogenen som överförs av stickmyggor. Också harpest smittar delvis via stickmyggor. Nordiska varianter av kalifornisk encefalit infekterar ofta människor via myggbett men orsakar bara i sällsynta fall hjärninflammation (Olli Vapalahti, Helsingfors, pers medd; 2016). Plasmodium vivax-malaria har inte på länge varit endemisk i Europa, men det finns alltjämt malariavektorarter med utbredningsområden som sträcker sig till Norden, och transmissionspotentialen för parasiten kvarstår [23, 18]. Potentiella vektorer för nil- och Rift Valley-virus finns också i Sverige och andra europeiska länder [10].
Förändringar i klimatet
Eftersom stickmyggor och patogener inte respekterar politiska gränser borde modeller för spridning och riskberäkning utgå från geografiska områden definierade enligt klimat och andra ekologiska faktorer [24]. Med dagens transportsystem utgör inte heller avstånd någon direkt barriär för spridningen av vektorer och patogener, medan klimatet kan avgöra om de invasiva arterna klarar av att etablera sig på nya områden [13].
Det är ytterst svårt att beräkna vilken inverkan de pågående förändringarna i klimatet har på sjukdomar som överförs av stickmyggor, eftersom epidemiologin påverkas av många faktorer i komplext samspel. Sambandet mellan klimat och utbredningen av vektorburna sjukdomar har debatterats flitigt sedan millenniets början. Förutom att forskningsdata brister i både kvantitet och kvalitet [25] har retoriken i den vetenskapliga litteraturen färgats av konflikter kring gränserna mellan de discipliner som deltar i debatten [26].
Man kan ändå inte frånse effekterna av klimat och väder eftersom de påverkar stickmyggornas fysiologi, beteende och populationstätheter som alla är centrala faktorer för sjukdomarnas spridning. Myggöverförda sjukdomar smittar i allmänhet under sommaren i tempererade regioner och under fuktiga perioder i tropiska områden [4]. Också malaria är i regel en säsongsbunden sjukdom i områden där transmissionen är låg [9].
Höga temperaturer gynnar ofta stickmyggors förökning och kan göra det lättare för tropiska arter att etablera sig på nya områden [27]. Eftersom insekter är växelvarma påverkas också mikroberna de bär på av förändringar i den omgivande temperaturen [25]. Replikationshastigheten för virus [4] samt utvecklingen av parasiter i myggan är ofta beroende av temperaturen och påverkar hur snart efter ett mål blod vektorn kan bli smittsam. Effekterna varierar beroende av både patogenen och myggarten eftersom också stickmyggans biologiska processer påverkas av temperaturen [25].
Temperaturens inverkan på transmissionen är inte linjär. För en del stickmyggor begränsas förökningen av temperaturen, och alltför höga temperaturer gör det svårt för stickmyggor att överleva [4, 28, 12]. I en studie konstaterades en stark korrelation mellan ovanligt höga temperaturer och förhöjd incidens av nilfeber i de flesta regioner i USA under åren 2004–2012, men graden av korrelation varierade inom landet [24]. Enligt en metaanalys kan temperaturhöjningar sannolikt öka risken för denguevirus i de subtropiska och tempererade klimatzonerna, men störst verkar risken vara i intervallet 22–29 °C [29]. I vissa fall har varmare temperaturer misstänkts bidra till att transmissionen av malaria blossat upp på nytt i områden där sjukdomen varit under kontroll [19].
Hur förändringar i nederbörden påverkar risken för sjukdomar överförda av stickmyggor är ännu sämre känt och varierar sannolikt beroende på vektorart [25] och område. Eftersom stickmyggornas utveckling från ägg till adult sker i vatten påverkas populationstätheten av regnmängd, översvämningar och tidvatten [4]. I fuktiga områden kan en minskad nederbörd göra att färre myggägg spolas bort och sjukdomsrisken ökar, men i torra områden kan mer regn i stället öka antalet kläckningsplatser [24]. Man tror att klimatförändringar och framför allt långa och intensiva perioder av regn bidrog till gula febern-epidemin i södra Brasilien 2008–2009 [20]. En studie hittade starka kopplingar mellan sommarens nederbörd och transmissionen av nilfeber och Sindbisvirus i Sydafrika [30].
Temperatur och nederbörd är de mest omdiskuterade klimatfaktorerna, men stickmyggor påverkas också av andra aspekter av klimatet. Luftfuktigheten är viktig för deras överlevnad [4], medan vindar kan störa sökandet efter ryggradsdjur [31] eller transportera myggor till nya områden [32]. Extrema väderförhållanden och naturkatastrofer kan snabbt öka risken för epidemier orsakade av patogener som överförs av stickmyggor [28, 33]. Klimatet och väderleken påverkar inte bara patogener och vektorer, utan också växtligheten i vektorernas livsmiljöer [1] samt ryggradsdjurens fysiologi och beteende [24, 25, 28]. Det är därför sannolikt att klimatförändringen har stora effekter på utbredningen av vektorburna sjukdomar [4].
Förändrad markanvändning
Befolkningstillväxten har på många håll i världen lett till skogsskövling och snabb urbanisering. När jordbruk och bebyggelse brett ut sig har myggpopulationer etablerat sig i människors livsmiljöer genom att utnyttja dammar, bevattningssystem och oskyddade vattenbehållare som kläckningsplatser [4]. Många bakslag i malariakontrollen har förknippats med utvecklingen av jordbruk och infrastruktur [19].
Mänskliga aktiviteter skapar ofta nya mikroklimat som ur insektsynvinkel kan skilja sig betydligt från det omgivande klimatet. Aedes albopictus, som annars främst rör sig utomhus, har noterats både suga blod och lägga ägg inomhus. Den kan också producera köldtåliga ägg, vilket ger möjlighet att klara lägre vintertemperaturer. Tropiska arter av stickmyggor har också hittats i växthus på svalare breddgrader [17].
Då skogsområden bebyggs ersätts ofta en del naturliga larvhabitat med konstgjorda kärl av olika slag. Aedes albopictus och Aedes aegypti hör till de arter som gärna utnyttjar dessa [17]. Förändringar i växtligheten påverkar tillgången till föda för mygglarver, och de nya förhållandena påverkar konkurrensen mellan larver av etablerade och invasiva arter [12].
Betydelsen av effektiva vårdsystem och interventioner
Mot de flesta sjukdomar som sprids av stickmyggor saknas specifik behandling, vaccin och preventiva läkemedel [4]. Därför, och tack vare sin kostnadseffektivitet, är interventioner som strävar till att minska kontakten mellan vektorer och människor centrala i bekämpningen av smittämnen som överförs av stickmyggor [2]. Också övervakning av både patogenernas och vektorernas spridning är viktig [7].
Mot gula febern har det länge funnits ett säkert och effektivt vaccin som hjälpt till att kontrollera sjukdomen [4]. Rutinmässig vaccination sker områdesvis enligt den uppskattade risken för transmission. Fortfarande sker då och då utbrott bland icke-immuna afrikanska och latinamerikanska populationer som ansetts löpa låg risk för epidemier [34, 20]. Sedan ett par år tillbaka råder nu global brist på vaccinet samtidigt som efterfrågan ökat, och Unicef förutspår att produktionen kommer att ligga efter ännu år 2017 [34, 35]. Det första vaccinet mot denguefeber (DENV1-4) godkändes för användning i Mexiko i början av december [36].
Upptäkterna av avermectin, som används mot lymfatisk filariasis, och artemisin, som blivit den främsta behandlingen för svår malaria, belönades med Nobelpriset år 2015 [37]. Det finns också andra läkemedel för att förebygga och behandla malaria [9]. I många länder i Afrika söder om Sahara leder ändå resursbrister inom vårdsystemet till att en stor del av alla febersjuka patienter, speciellt med låg socioekonomisk status, vårdas för malaria utan att diagnosen säkerställs med blodprov. Felaktig medicinering kan bidra till den växande läkemedelsresistensen. Parasiternas resistens mot läkemedel gör behandlingen av malaria dyrare och mer komplicerad och är en ytterligare belastning för redan överansträngda hälsovårdssystem [9, 38]. De senaste åren har det lyckligtvis skett stora framsteg i tillgången till diagnostiska test [9], och det första malariavaccinet (med begränsad effekt) är på väg att tas i bruk i drabbade områden [39].
Det kan vara svårt eller omöjligt att skilja mellan olika myggöverförda sjukdomar på basis av klinisk sjukdomsbild. Malaria, denguefeber, chikungunyafeber och zikavirusinfektion kan ge mycket liknande symtom, och sjukdomarna misstas ofta för varandra i områden där flera av patogenerna cirkulerar [40, 38, 41]. Många av virusen orsakar en stor andel lindriga och symtomfria infektioner [4], vilket bidrar till under- och feldiagnostisering och till brister i övervakningsdata.
Litteraturen visar tydligt vikten av välfungerande vård, övervakning och förebyggande arbete som medel mot myggöverförda sjukdomar. Bland de fall där malaria återvänt till kontrollerade områden har försvagade insatser för malariakontroll varit den vanligaste bidragande faktorn. Som orsaker till att kontrollprogrammen brustit uppgavs i 49 procent av fallen brist på finansiering och i 41 procent krig, konflikter eller naturkatastrofer, enligt en metaanalys [19]. Också ebolaepidemin i Västafrika 2014–2015 har slagit hårt mot malariaprogrammen [9]. Rädsla bland patienter och hälsoarbetare har stört det kliniska arbetet på många sätt samt bidragit ytterligare till att blodprov inte alltid tas, samtidigt som distributionen av läkemedel störts. I Guinea uppstod rykten om ett samband mellan myggnät och ebola. Tillsammans befaras dessa händelser få långsiktiga konsekvenser [42]. Även i länder med stabilare och mindre överbelastade hälsovårdssystem, såsom Sverige, är övervakning och varningar om riskerna viktiga för att förebygga och begränsa epidemier [10, 28, 8].
Forskningen ger kontinuerligt ny information om både patogenernas och vektorernas fysiologi och biologiska interaktioner samt klarlägger mekanismer som kunde utgöra mål för nya interventioner. Till exempel påvisades nyligen en mekanism som skyddar stickmyggans tarmkanal mot attacker från människoblodets komplementsystem [43].
Nya och föränderliga patogener
Största delen av de senaste decenniernas ökade utbrott av myggöverförda sjukdomar har orsakats av patogener som varit kända sedan tidigare, men som av en eller annan orsak inte ansetts utgöra omedelbara hot [1, 19]. Under de senaste åren har dessutom en del nya eller mindre kända patogener rapporterats. Zikaviruset har orsakat sina första rapporterade epidemier 2007 och 2013–2014 i Stillahavsområdet, med de första allvarliga symtomen i Franska Polynesien 2013–2014 [40]. År 2013 upptäcktes en femte serotyp av dengueviruset [44].
Allt fler fall av malaria orsakad av Plasmodium knowlesi rapporteras, vilket delvis beror på att diagnostiken utvecklas [9]. Parasiten cirkulerar i makaker i Sydostasien, och största delen av fallen har påträffats i Malaysien. Man har kunnat visa att parasiten kan överföras av stickmyggor från människa till människa under experimentella förhållanden [45].
Den dramatiskt ökade chikungunyatransmissionen tog fart genom en ny genetisk variant av viruset, som Aedes albopictus överför mycket mer effektivt [3]. Också i andra myggöverförda virus har genetiska förändringar noterats [20, 4]. Förutom malariaparasiters resistens mot läkemedel orsakar insekticidresistens hos stickmyggor stora utmaningar för bekämpningen av patogenerna som de överför [19, 46].
Uppfattningar och förhållningssätt
För många viktiga infektionssjukdomar leder lyckade kontrollinsatser lätt till en riskabel »out of sight, out of mind«–paradox. Då incidensen sjunker börjar de förebyggande åtgärderna försummas och det leder i värsta fall till att incidensen återgår till utgångsnivån. Problemet gäller i högsta grad malaria [19] och åtminstone i viss mån andra sjukdomar som sprids av stickmyggor. Rapporteringen om chikungunyaepidemin på den franska stillahavsön Réunion 2007 påverkades av de franska myndigheternas uppfattning av sjukdomen som ett »tropiskt« och avlägset problem [47]. Förutom att beslutsfattare inte alltid prioriterar vektorkontroll så högt som de borde, leder också negativa, misstroende och skentrygga attityder bland allmänheten ofta till att rekommendationer för prevention inte följs fullt ut på lokal och individuell nivå [19]. Å andra sidan kan förutspådda hälsorisker eller rädsla för smitta göra att människor blir försiktigare och den faktiska transmissionsrisken minskar [25].
Eftersom de flesta människor inte ser skillnad mellan stickmyggor av olika arter påverkar också den totala myggtätheten folks tendens att skydda sig mot myggbett i högre grad än den faktiska vektorpopulationens täthet, även om dessa faktorer kan variera helt oberoende av varandra [48].
Till sist
Förutsättningarna för spridningen av de sjukdomar som överförs av stickmyggor skapas av en mängd processer med och utan mänsklig inverkan. Globaliseringen har varit en drivande kraft i att sammanföra patogener, vektorer och värdar, och har därigenom bidragit väsentligt till utbredningen av många sjukdomar. Även i de fall där potentiella transmissionsnätverk uppstår eller utvidgas kan omständigheter eller aktiva interventioner ändå förhindra att epidemier uppstår eller att transmissionen etableras. Behovet av forskning om myggöverförda sjukdomar är fortsättningsvis stort. Det samma gäller behovet av nya vacciner och global tillgång till information och vård samt förutsättningar att skydda sig mot smitta. Det är också viktigt att övervaka utbredningen av stickmyggor och de patogener de överför.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.