Prostatacancer är den vanligaste cancerformen i Sverige.
De senaste åren har metoder för utredning, behandling och rehabilitering av män med prostatacancer utvecklats betydligt.
Multidisciplinär och multiprofessionell handläggning av män med prostatacancer är nödvändig i alla faser av sjukdomen.
Det finns ett glapp mellan det nationella vårdprogrammets riktlinjer och dagens svenska sjukvård.
Specialiserade prostatacancercentrum skulle ge bättre förutsättningar för att män med misstänkt eller konstaterad prostatacancer ska få den vård som det nationella vårdprogrammet föreskriver.
Prostatacancercentrum skulle ge goda förutsättningar för fortsatt utveckling av prostatacancersjukvården.
Fram till 1990-talet var prostatacancer vanligen avancerad och obotlig vid diagnos. Diagnostiken var oftast enkel, eftersom tumörerna var stora och lätta att palpera, behandlingen likaså: hormonbehandling följd av symtomlindring i livets slutskede.
Prostatacancersjukvården förändrades dramatiskt när blodprov för prostatacancerspecifikt antigen (PSA) infördes kring 1990. Antalet nya fall i Sverige fördubblades under en 10-årsperiod, och antalet män som opererades eller strålbehandlades tiofaldigades.
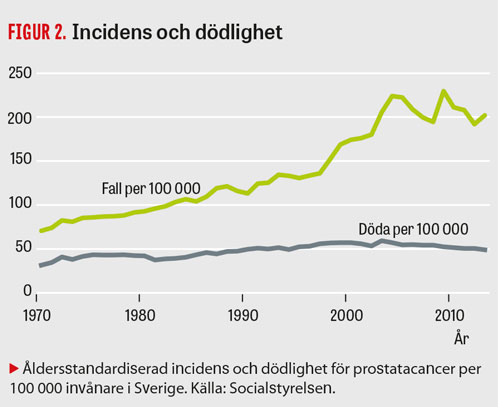
Prostatacancer är nu den vanligaste cancersjukdomen i Sverige med omkring 10 000 nya fall per år (Figur 1) [1]. Nästan 100 000 svenska män lever med diagnosen, en trefaldig ökning på 20 år [2]. Varje år dör 2 400 av dem till följd av sin prostatacancer [3]. Den åldersstandardiserade dödligheten har börjat minska (Figur 2), men eftersom män lever allt längre och därmed har större risk att drabbas av prostatacancer är antalet dödsfall per år oförändrat [3].
Utveckling av diagnostik
Med PSA-provet följde en märklig princip för cancerdiagnostik: man började ta multipla vävnadsprov från prostatakörteln hos män med förhöjda PSA-värden, även om det inte fanns någon tumör att känna eller att se med ultraljud. Eftersom uppemot hälften av alla medelålders och äldre män har små härdar av cancer i sin prostatakörtel, har denna praxis lett till utbredd överdiagnostik och överbehandling av kliniskt betydelselös prostatacancer.
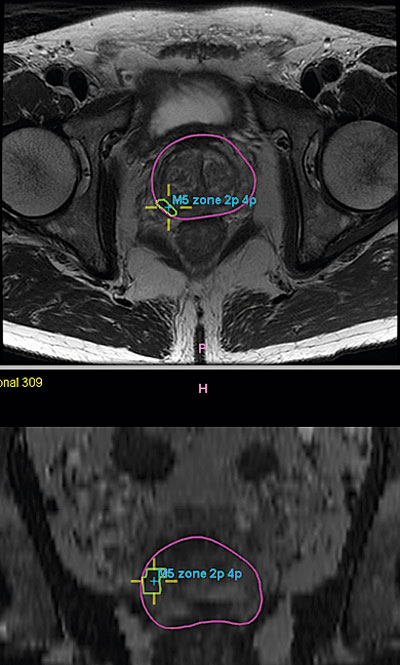
Utvecklingen av multiparametrisk magnetkameratomografi håller nu på att leda till en andra revolution inom prostatacancerdiagnostiken. Genom att rikta vävnadsproven mot misstänkta tumörer och avstå från systematiska vävnadsprov kan man både öka chansen att diagnostisera allvarlig prostatacancer och minska risken för överdiagnostik av betydelselös cancer [4, 5]. För att nå dessa mål krävs såväl rätt utrustning som stor erfarenhet hos dem som tolkar bilderna och hos dem som tar vävnadsproven [6].
Det svenska nationella vårdprogrammet anger specifika krav, bl a att enheten ska utföra minst 100 magnetkameraundersökningar för prostatacancerdiagnostik varje år [7].
Även nya blodprov för diagnostik och prognostik av prostatacancer är på väg in i den kliniska vardagen. De kan användas som komplement hos män med lätt ökade PSA-värden för att selektera till fortsatt diagnostik med magnetkamera och vävnadsprov [8-10].
Screening
Screening med PSA-prov kan leda till minskning av dödligheten i prostatacancer [11]. Effekten i form av minskad cancerdödlighet är minst lika god som vid screening för bröstcancer med mammografi [12]. En svensk screeningstudie visade nästan en halvering av prostatacancerdödligheten hos de män som bjöds in till screening mellan 50 och 70 års ålder [13]. Socialstyrelsen har emellertid, i likhet med nästan alla andra sjukvårdsmyndigheter i övriga världen (undantag är Litauen och Kazakstan), bedömt att de negativa effekterna av överdiagnostiken är för stora för att allmän screening ska kunna rekommenderas [14-16]. Trots detta PSA-testas mer än två tredjedelar av svenska män i storstadsregionerna [17, 18].
Den nu pågående, osystematiska PSA-testningen är ojämlik, mycket resurskrävande och ineffektiv [18, 19]. Många män över 75 års ålder PSA-testas [20], trots att behandling av lokaliserad prostatacancer inte skulle förlänga deras liv och trots att risken för överdiagnostik är betydande [21]. PSA-test upprepas ofta årligen hos män med minimal risk för behandlingskrävande prostatacancer [18], trots att testning vart sjätte år skulle vara tillräcklig [7, 22]. Varje enskilt provsvar bedöms av läkare, som gör en individualiserad bedömning och därefter ger besked till mannen vid en direkt kontakt eller i ett personligt brev – en mycket resurskrävande procedur jämfört med organiserad screeningverksamhet. Socialstyrelsen rekommenderade därför i 2014 års nationella riktlinjer att landstingen utvärderar systematisk information om PSA-prov till män mellan 50 och 70 års ålder och organiserad testning för dem som därefter väljer att låta testa sig [23].
Utvecklingen av nya biomarkörer och av multiparametrisk magnetkameratomografi med riktade vävnadsprov (Figur 3) kan ha gett möjligheter att få ner överdiagnostiken vid screening till en acceptabel nivå [5, 8, 9, 24, 25]. Med anledning av de nya diagnostiska testen påbörjade Socialstyrelsen våren 2016 en förnyad bedömning av nationell screening för prostatacancer. Den förväntas vara klar våren 2017.
Behandling av icke-metastaserad prostatacancer
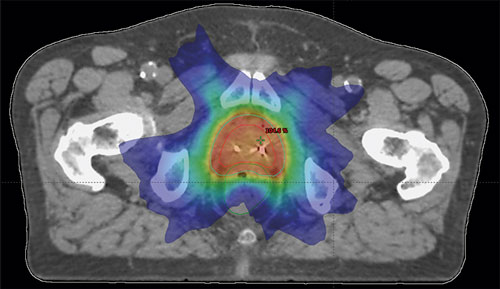
Icke-metastaserad prostatacancer kan botas såväl med kirurgi som med strålbehandling. Den kirurgiska behandlingen utförs numera huvudsakligen med robotassistans. Roboten är ett värdefullt hjälpmedel, men den är dyr och det krävs att kirurgen har lång erfarenhet och opererar ofta för att resultaten ska bli bra [26]. Det nationella vårdprogrammet anger en nedre gräns på 25 operationer per år [7]. Strålbehandlingen har också genomgått en dramatisk teknikutveckling, som har lett till större chans till bot och minskade biverkningar (Figur 4) [27]. Modern strålbehandlingsutrustning är ännu dyrare än en operationsrobot.
Utvärdering av metoder för selektiv behandling av tumören och omgivande delar av prostatakörteln pågår, t ex högintensivt fokuserat ultraljud, kryoterapi och interstitiell fotodynamisk behandling.
Prognosen för män med organbegränsad, högt differentierad prostatacancer är mycket god, även utan behandling [28]. Män med denna beskedliga form av prostatacancer erbjuds därför regelbunden uppföljning (aktiv monitorering) med sikte på att operera eller strålbehandla endast om man i ett senare skede påvisar allvarlig prostatacancer. Över 90 procent av svenska män med prostatacancer i den lägsta riskgruppen påbörjar numera aktiv monitorering [1]. Även för denna patientgrupp är multiparametrisk magnetkameratomografi och riktade vävnadsprov på väg att etableras för att öka chansen att upptäcka allvarlig cancer i tid och för att minska antalet vävnadsprov [29, 30].
Valet mellan kirurgi, extern strålbehandling, brakyterapi (interstitiell strålbehandling) och aktiv monitorering är ofta svårt. Patientens ålder, samsjuklighet och olika riskfaktorer för förtida död måste vägas samman för en bedömning av hans förväntade kvarvarande livstid. Den ska sedan ställas mot prognosen i cancersjukdomen, som i sin tur beror på ett flertal prognostiska faktorer. Mannens urinvägsfunktion, tarmfunktion och sexuella funktion måste utvärderas så att hans risker för olika biverkningar kan bedömas [7].
Slutligen ska dessa objektiva bedömningar jämkas samman med mannens egen värdering av vilka typer av biverkningar som han kan tänka sig att acceptera och vilka han absolut vill undvika. Detta är en process som kräver individanpassad muntlig och skriftlig information och upprepade konsultationer med mannen och hans partner. De har rätt att få träffa både en prostatacancerkirurg och en strålbehandlande onkolog [7]. Kontaktsjuksköterskan är en viktig fast punkt under en ofta förvirrande och ångestfylld tid fram till behandlingsbeslutet.
Metastaserad prostatacancer
Förr behandlades män med metastaserad prostatacancer enbart med medicinsk eller kirurgisk kastration. År 2004 registrerades den första effektiva behandlingen av »kastrationsresistent« metastaserad prostatacancer: docetaxel, ett cytostatikum [31]. De senaste åren har tillkommit enzymhämmare och receptorblockerare som påverkar testosteron (abirateron och enzalutamid), en radionuklid (radium-223) och ytterligare ett cytostatikum (cabazitaxel) [32-35]. Fler nya behandlingar förväntas inom de närmaste åren [36]. År 2015 flyttades docetaxel fram till första linjens behandling av spridd prostatacancer, eftersom studier visat att detta ger bättre effekt än om man väntar till dess sjukdomen har blivit kastrationsresistent [32].
Sammantaget har dessa framsteg inneburit att medianöverlevnaden för män med metastaserad prostatacancer nu är omkring 5 år, jämfört med endast 2 år vid millennieskiftet.
Den snabba introduktionen av nya behandlingar har emellertid skapat kunskapsluckor om när i sjukdomsförloppet och i vilken ordning de ska användas för att ge bästa möjliga effekt och minsta möjliga biverkningar. Det finns nästan ingen kunskap alls om hur de kan kombineras. Behovet av fortsatt klinisk forskning som kan ge underlag för evidensbaserade riktlinjer på området är alltså stort.
Med eller utan tydliga riktlinjer är och förblir det multidisciplinära teamets erfarenhet och engagemang avgörande för omhändertagandet av den enskilde mannen med metastaserad prostatacancer; det behövs alltid en individualiserad bedömning av symtom, allmäntillstånd, bilddiagnostik, laboratorievärden och biverkningar samt av patientens livskvalitet, livssituation och önskemål.
Rehabilitering
På senare år har betydelsen av tidigt insatt rehabilitering av personer med cancer lyfts fram [33], men kompetens och resurser inom sjukvården är begränsade – ofta till en nivå klart under riktlinjerna i det nationella vårdprogrammet [2]. Alla män med prostatacancer och deras partner ska kunna erbjudas allmän psykosocial rehabilitering; de flesta behöver även specifik rehabilitering av sexuell funktion, och många behöver dessutom rehabilitering av blåsfunktion och tarmfunktion [7].
Motiv för att införa prostatacancercentrum
De senaste årens framsteg inom diagnostik, kirurgi, strålbehandling, läkemedelsbehandling och rehabilitering gör att dagens patienter har rätt att förvänta sig att sjukvården ska kunna
- diagnostisera allvarlig prostatacancer med hög sensitivitet
- i görligaste mån undvika överdiagnostik av kliniskt betydelselös cancer
- erbjuda män med icke-metastaserad prostatacancer individanpassad behandling som kombinerar god chans till bot med minsta möjliga risk för biverkningar
- rehabilitera män med prostatacancer så att kroppsliga och psykiska besvär minimeras
- effektivt kombinera de olika systemiska behandlingarna för spridd prostatacancer
- snabbt lindra de olika symtom som kan uppträda vid lokalt avancerad och spridd prostatacancer.
Dessvärre kan sjukvården sällan motsvara dessa förväntningar. I Cancerfondsrapporten 2016 anges att endast 14 procent av prostatacancersjuka män i Sverige fick sitt cancerbesked inom 18 dagar från vävnadsprovtagningen [2], vilket anges som den längsta acceptabla väntetiden i det nationella vårdprogrammet [7]. Variationen mellan olika landsting var från 5 till 44 procent [2]. I tre landsting fick färre än var tionde man med nydiagnostiserad prostatacancer en namngiven kontaktsjuksköterska [2], vilket alla ska ha enligt det nationella vårdprogrammet [7].
För att kunna erbjuda prostatacancersjukvård i överenstämmelse med det nationella vårdprogrammet behöver sjukvården organiseras så att den främjar multidisciplinärt samarbete och specialiserad kompetensutveckling.
Här kan vi lära av bröstcancersjukvården: erfarenheterna av specialiserade centrum för diagnostik och behandling av bröstcancer är goda [34]. I England och Skottland observerades 18 procent lägre dödlighet i bröstcancer vid de sjukhus som infört multidisciplinära bröstcancerenheter [35]. Från Norge rapporteras att de bröstcancerenheter som byggdes upp för diagnostik och behandling när man införde screening kan ha betytt mer än själva screeningen för att minska dödligheten i bröstcancer [36]. Detta verkar vara överförbart till screening för prostatacancer; resultat från en populationsbaserad studie i Göteborg talar för att organiserad screening är mer effektiv och leder till mindre andel överdiagnostik än osystematisk PSA-testning [19].
Behovet av särskilda prostatacancercentrum påtalas i ökande omfattning i Europa [37]. År 2011 publicerades ett europeiskt konsensusdokument med specificerade krav för struktur och process vid ackrediterade prostatacancercentrum [38]. Specifikationerna uppdaterades 2015, då även ett nätverk för europeiska prostatacancercentrum bildades [39].
Prostatacancercentrum i Tyskland, England och Norge
Sjukvårdsmyndigheterna i Tyskland började redan 2003 stimulera bildandet av prostatacancercentrum [37]. Det mest kända resultatet av denna satsning är Martini-kliniken i Hamburg, av många betraktad som världens främsta prostatacancercentrum (www.martini-klinik.de). Verksamheten, inklusive bilddiagnostik och patologi, bedrivs i egna lokaler. Varje kirurg utför över 200 radikala prostatektomier per år. Varje enskild kirurgs resultat registreras och diskuteras regelbundet [40]. En patolog undersöker prostatakörteln redan innan operationen avslutas så att en kompletterande resektion kan utföras vid behov [41]. Martiniklinikens metodiska kvalitetsutveckling av kirurgin imponerar, men vi uppfattar det som att onkologin, uppföljningen och rehabiliteringen skulle kunna integreras bättre i verksamheten.
Vid Universitetssjukhuset i Cambridge i England bildades år 2014 CamPARI-kliniken, med Martinikliniken som förebild (www.campari-clinic.co.uk). I Cambridge finns internationell spetskompetens inom många delar av prostatacancersjukvården, men CamPARI-kliniken saknar egna lokaler. Vården är spridd på olika kliniker och upplevs därför fragmenterad av den av oss som arbetar där.
I Norge och Danmark pågår sedan några år en koncentration av kirurgi och kurativt syftande strålbehandling av prostatacancer till multidisciplinära enheter. Prostatacentrum vid Haukelands universitetssjukhus i Bergen har kommit särskilt långt [42]. Där finns högklassig utrustning, en god struktur för multiprofessionellt och multidisciplinärt samarbete, sammanhållna och snabba vårdförlopp, kontinuerlig kvalitetskontroll, forskning, patientutbildning och välutvecklad samverkan med primärvården och med den lokala patientorganisationen.
I Sverige finns ännu inget prostatacancercentrum, men vid Sahlgrenska universitetssjukhuset i Göteborg pågår planering för ett sådant.
Vision för svenska prostatacancercentrum
Vår vision för svenska prostatacancercentrum följer i stort sett det europeiska konsensusdokumentet och är helt i linje med det nationella vårdprogrammets riktlinjer för nivåstrukturering och standardiserade vårdförlopp [7, 39]. Vi ser ett behov av två olika typer av prostatacancercentrum: dels mindre centrum för diagnostik, utredning, uppföljning och medicinsk behandling, dels större centrum där även kurativ behandling utförs.
Öppenvården i ett prostatacancercentrum sker i särskilda lokaler där urologer, onkologer, kontaktsjuksköterskor, forskningssjuksköterskor, uroterapeuter, kuratorer, sekreterare och andra arbetar tillsammans. I dessa gemensamma lokaler kan mycket skötas utan remisser, vilket effektiviserar vården och skapar trygghet för patienterna. Detta är särskilt viktigt inför behandlingsbeslut och under den kontinuerliga vården av män med obotlig cancer.
Prostatacancercentrum ansvarar för organiserad PSA-testning. Skriftlig information om fördelar och nackdelar med tidig diagnostik skickas till samtliga män i specificerade åldersgrupper. Män som vill diskutera testningen kan ringa till en specialutbildad sjuksköterska. Kallelser till blodprovstagning och besked om provsvar sköts av en dator enligt en riskbaserad algoritm. Män med mycket låg risk för allvarlig prostatacancer kallas till nytt blodprov först efter många år. För män med PSA över en viss nivå görs omedelbar »reflextestning« av kompletterande biomarkörer i samma blodprov, varefter en stor andel kan besparas ytterligare utredning.
Algoritmen, testmetoderna och det diagnostiska utfallet utvärderas kontinuerligt och förändras stegvis, eftersom den vetenskapliga utvecklingen på området fortsätter.
Män som på grund av undersökningsfynd eller blodprovsanalyser har en måttlig eller hög risk att ha prostatacancer genomgår magnetkameraundersökning redan innan de kommer till urologmottagningen. Många av männen slipper genomgå vävnadsprov, eftersom kombinationen av en måttlig risk enligt blodprov och frånvaro av synlig tumör med magnetkamera innebär låg sannolikhet för behandlingskrävande cancer. Detta gör att överdiagnostiken av kliniskt betydelselös prostatacancer och därmed den totala incidensen av prostatacancer i Sverige minskar.
Män med synlig eller palpabel tumör genomgår riktade vävnadsprov; män med hög risk för cancer enligt blodproven men i övrigt normala undersökningsfynd genomgår extensiv, systematisk vävnadsprovtagning. Vävnadsproven bedöms av specialiserad uropatolog. De som bedömer magnetkameraundersökningarna och genomför vävnadsproven träffas regelbundet för att diskutera det diagnostiska utfallet.
Män med nyupptäckt prostatacancer får sitt cancerbesked av kontaktsjuksköterska. Ibland närvarar även urolog eller onkolog, t ex om det kan vara aktuellt att direkt påbörja behandling för symtomgivande cancer. Mannen och hans närstående får muntlig och skriftlig information om de olika tänkbara behandlingarna, om de kliniska studier som kan vara aktuella och om hur de kan kontakta patientföreningen. Patientföreningen erbjuder kontakt med andra män som själva har en liknande form av prostatacancer och med deras närstående.
Innan mannen lämnar mottagningen får han reda på när han ska göra kompletterande bilddiagnostik (om det behövs), när hans handläggning ska diskuteras på multidisciplinär konferens och när han ska komma tillbaka till mottagningen för att diskutera behandlingen. Mannen och hans närstående har då ett gemensamt möte med prostatacancerkirurg, strålbehandlande onkolog och kontaktsjuksköterskan. Inför besöket har mannens sexuella funktion, blåsfunktion och tarmfunktion utretts så att man ska kunna välja den typ av lokal behandling som ger minst risk för biverkningar.
Tiden från det att cancermisstanken väcktes till detta besök är högst 6 veckor. Under denna tid har mannen haft upprepade samtal med sin kontaktsjuksköterska, och rehabiliteringen har påbörjats. Mannen behåller den kontaktsjuksköterska som gav honom cancerbeskedet, oberoende av om han sedan följs upp med aktiv monitorering, opereras, strålbehandlas, hormonbehandlas, cytostatikabehandlas eller får experimentell behandling.
Om mannen ska opereras eller få strålbehandling vet han att behandlingen kommer att utföras av en erfaren läkare eller av en läkare under utbildning under överinseende av en erfaren specialist. Han fyller i enkäter om biverkningar och bemötande före och efter behandlingen, som ett led i kvalitetsuppföljningen.
Resultaten av samtliga operationer och strålbehandlingar registreras och återkopplas regelbundet till de behandlande läkarna. De publiceras också öppet på Nationella prostatacancerregistrets webbplats (www.npcr.se). Efter behandlingen intensifieras rehabiliteringen så att de negativa effekterna på livskvaliteten blir så begränsade och kortvariga som möjligt.
Män med spridd prostatacancer behandlas och följs upp av en uro-onkolog och sin kontaktsjuksköterska. Många av dem får en förfrågan om de vill vara med i en klinisk prövning. Inför mottagningsbesöken registrerar mannen sina symtom på internet eller på surf-/läsplatta i väntrummet. Det han registrerar förs direkt över till Patientöversikt prostatacancer (ett redan nu infört kvalitetsregister för spridd prostatacancer, http://npcr.se/rapporter/ppc/). Vid besöket får han se hur symtomen har varierat över tid och hur de har påverkats av de olika behandlingar som han har fått. Den grafiska framställningen hjälper honom när han tillsammans med sin läkare eller kontaktsjuksköterska ska bestämma hur behandlingen ska fortsätta.
Eftersom all mottagningsverksamhet i prostatacancercentrum sker i gemensamma lokaler, får mannen direkt en bedömning av urolog vid eventuella urinvägsproblem. Uppgifterna i Patientöversikt prostatacancer används naturligtvis regelbundet för lokal, regional och nationell kvalitetskontroll.
Om sjukdomen tar överhanden får mannen i ett tidigt skede kontakt med den palliativa vården på hemorten så att eventuell övergång till vård i livets slutskede blir smidig.
Stort glapp mellan vision och dagens verklighet
På många håll i Sverige är glappet mycket stort mellan vår vision och dagens verklighet. Å andra sidan är visionen inte långt från den prostatacancersjukvård som rekommenderas i det nationella vårdprogrammet [7]. Det finns alltså ett stort gap mellan den prostatacancersjukvård som borde erbjudas och den vård som faktiskt erbjuds [2].
Vi hoppas att vår vision ska stimulera sjukvårdpersonal, tjänstemän och politiker till att börja planera för framtidens prostatacancersjukvård, med prostatacancercentrum som drivande nav.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även författarintervjun med Ola Bratt