Akut insjuknande med neurologiska symtom i nära anslutning till en invasiv medicinsk åtgärd kan vara uttryck för arteriell luftemboli.
Diagnosen bör ställas baserat på den kliniska bilden och anamnesen.
Skyndsam behandling med hyperbar syrgas kan vara livräddande vid detta tillstånd.
Luft i blodbanan, gasemboli, kan uppkomma accidentellt vid snabba förändringar i omgivningstrycket såsom vid dykning och flygning, vid mekaniskt trauma mot torax och hals eller i samband med invasiva medicinska ingrepp då luft får tillträde till kärlsystemet. Det är inte ovanligt att mindre mängder luft injiceras intravenöst, men detta ger sällan upphov till några symtom. Arteriell gasemboli är däremot betydligt mer problematisk, eftersom även mycket små mängder luft kan få allvarliga konsekvenser.
Luft kan komma in i artärsystemet på följande vis:
- En venös luftembolus passerar över från höger till vänster förmak via persisterande foramen ovale. Förutsättningen är att det hydrostatiska trycket i höger förmak kortvarigt överstiger trycket i det vänstra, vilket kan inträffa vid hosta eller krystning.
- En venös luftembolus i arteria pulmonalis passerar över till lungvenerna via lungkapillärerna. Det krävs dock stora mängder luft för att luftembolus ska kunna passera.
- Luft kommer in direkt i artärsystemet i samband med kirurgiska eller diagnostiska ingrepp såsom angiografi, hjärtkirurgi et cetera.
- Vid lungbiopsi genom att en punkterad lungven kortvarigt kommer i direkt förbindelse med luftförande delar av torax.
- Även andra mekanismer för luftpassage kan förekomma; exempelvis kan luft utan att gå via lungkapillärerna passera via accessoriska blodkärl i lungan.
Eftersom hjärnan förbrukar 15–20 procent av hjärtminutvolymen transporteras en stor del av gasbubblorna med blodflödet till hjärnan, vilket leder till blockering av cerebrala kärl, s k cerebral arteriell gasemboli. Detta är ett allvarligt tillstånd med hög mortalitet och svåra neurologiska bortfall hos överlevande [1-4].
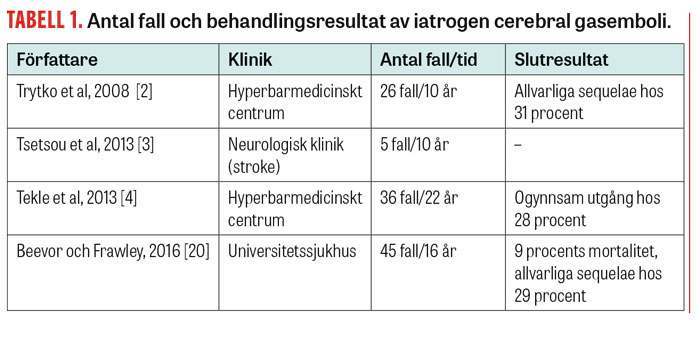
Incidensen av cerebral arteriell gasemboli är oklar beroende på bristande diagnostik och/eller underrapportering. Vi är hänvisade till publicerade serier av patientfall (Tabell 1). Symtomgivande cerebral arteriell gasemboli i samband med öppen hjärtkirurgi har rapporterats förekomma vid 0,1 procent av operationerna [5]. Uppgifterna om förekomsten i samband med perkutan lungbiopsi varierar mellan olika publicerade material, från 0,02 procent till 0,4 procent [6-8], men med hög rapporterad mortalitet (26 procent) [7].
Sannolikt är tillståndet underdiagnostiserat, eftersom symtomen kan variera alltifrån mycket diskreta till mycket akuta med plötslig medvetslöshet och död som följd [9].
Vi beskriver här förloppet hos två patienter.
Patient 1
En 60-årig tidigare rökande, heltidsarbetande kvinna insjuknade för 15 år sedan i pneumoni. Kontrollröntgen utfördes efter tillfrisknandet och visade kvarstående infiltrat apikalt vänster, vilket föranledde fortsatt utredning. Bronkoskopi genomfördes utan cytologisk diagnos, och man beslutade att gå vidare med biopsi.
De apikala förändringarna visualiserades med ultraljud utan föreliggande kärl. I lokalanestesi punkterades förändringarna med finnål tre gånger och ett stick med mellannål (18 gauge). Direkt efter biopsin uttryckte patienten att det inte varit så farligt som hon befarat, men strax därefter kände hon sig svimfärdig och förlorade medvetandet.
Patienten hade god egenandning och puls, men initialt omätbart blodtryck. EKG visade nodal rytm och utbredda STT-förändringar, framför allt diafragmalt. Lungröntgen visade ingen pneumotorax eller blödning. Ekokardiografi visade apikal hypokinesi. Persisterande foramen ovale kunde inte verifieras.
Patienten intuberades och lades in på intensivvårdsavdelning (IVA). Luftemboli bedömdes vara trolig orsak till patientens medvetslöshet. Tryckkammarbehandling påbörjades 2,5 timmar efter larm enligt tabell 6 (T6) med 2,8 atmosfärer absolut tryck, motsvarande 18 meters djup, under 285 minuter.
Patienten genomgick undersökning med DT-hjärna, vilken inte visade några parenkymförändringar eller tecken till infarkt.
Dagen efter händelsen fick patienten ytterligare en tryckkammarbehandling (2,8 atmosfärer absolut tryck × 100 minuter) och behandlades därefter konservativt. Undersökning med MR-hjärna dag 3 visade utbredda kortikala förändringar av färskt ischemiskt utseende bilateralt.
Patienten kunde efter hand skrivas ut från IVA och överföras till neurorehabilitering. I dag, 15 år senare, har patienten kvarstående hemipares och behov av personlig assistans.
Patient 2
En 68-årig icke-rökande pensionerad kvinna med hypertoni, i övrigt frisk, behandlades med antibiotika för övre luftvägsinfektion, men blev inte fullständigt återställd efter given kur. Patienten utreddes med DT-torax, som visade en tumörsuspekt förändring i vänster underlob.
Tre månader senare var patienten symtomfri, men utredningen fortsatte med punktion av en lymfkörtel, vilken visade endast benigna celler. Resultatet bedömdes som icke-konklusivt, och patienten planerades för lungbiopsi. En DT-ledd mellannålspunktion (18 gauge eller 1,2 mm i diameter) i lokalanestesi genomfördes. Strax efter avslutad punktion kände sig patienten yr och blev därefter medvetslös. HLR genomfördes i någon minut innan puls åter detekterades. EKG visade inga STT-förändringar. Vid neurologisk undersökning noterades vänstersidig hemiplegi och olikstora pupiller.
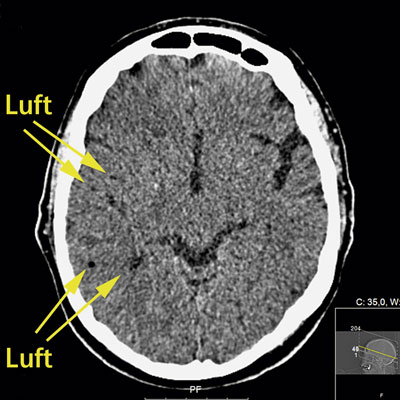
Eftersom patienten fortfarande befann sig i datortomografen utfördes undersökning med DT-hjärna/
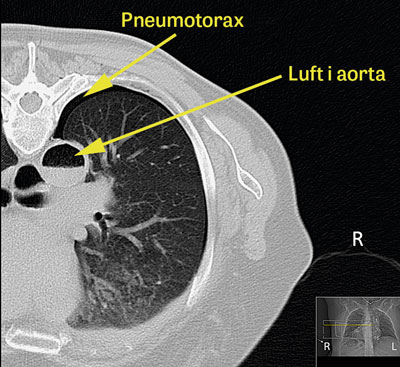
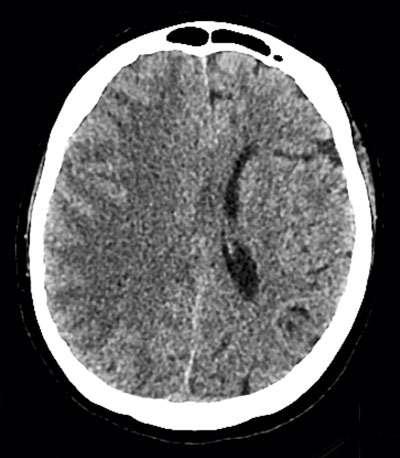
torax, vilken visade multipla lågattenuerande förändringar i höger hjärnhemisfär, vilka initialt tolkades som fettembolier (Figur 1). Eftergranskning av bilderna från DT-torax visade betydande mängder luft i aorta (Figur 2), vilket dock inte sågs initialt.
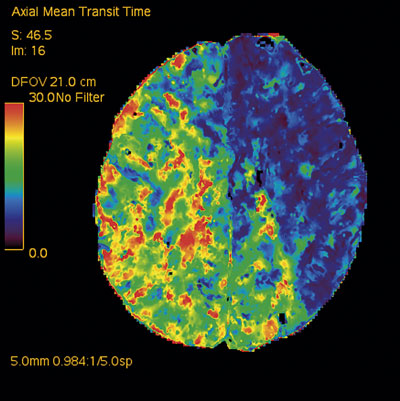
Eftersom diagnosen i detta läge var oklar, beslöt man att flytta patienten till neuroröntgen för undersökning enligt strokeprotokoll. En undersökning med perfusions-DT genomfördes 1 timme senare och visade gravt nedsatt genomblödning i hela höger hemisfär och i occipitoparietala delar av vänster hemisfär (Figur 3). Patienten överfördes till IVA.
Misstanke om luftemboli hade uttalats tidigt i förloppet, men inte verifierats. Vid eftergranskning av bilderna ändrades dock tolkningen från fettemboli till luftemboli samt även luft i aorta. Jourläkare för tryckkammarbehandling kontaktades, och tryckkammarbehandling initierades ca 3,5 timmar efter insjuknandet. Patienten hade då sträckkramper och var höggradigt cirkulatoriskt instabil vid behandlingsstart, men stabiliserades vid 2,8 atmosfärer absolut tryck. Behandlingen fortsatte därefter enligt tabell 6 (T6): 2,8 atmosfärer absolut tryck × 285 minuter.
DT-hjärna efter första behandlingen visade ingen kvarvarande luft, men svullnad av höger hemisfär med viss överskjutning av medellinjen (Figur 4). Upprepad tryckkammarbehandling gavs dag 2 och dag 3 (2,8 atmosfärer absolut tryck × 285 minuter), totalt tre seanser med sammanlagd tid 485 minuter. Frekventa DT- och MR-undersökningar utfördes under vårdtiden, vilka visade att hjärnsvullnaden kulminerade dag 1–2 och därefter gick i regress. Även infarktsuspekta områden parietalt höger som sågs under dag 1–3 började långsamt normaliseras senare i förloppet (Figur 5).
Det kliniska läget förbättrades successivt. Patienten tränades ur respirator och överflyttades till vårdavdelning. Hon var subjektivt i stort sett återställd 2 månader senare.
Arteriell gasemboli: symtom och behandling
Symtomen vid arteriell gasemboli är beroende av vilket kärlområde som ockluderats: cerebrala symtom är vanligast och innefattar medvetandesänkning, fokalneurologiska bortfall, kramper och illamående. Luftembolisering av kranskärl kan resultera i bröstsmärtor, EKG-förändringar, arytmier och hjärtstillestånd. Karakteristiskt för luftemboli i kranskärlen är flyktig, snabbt föränderlig EKG-bild, där ST-sträckan rör sig över stora avstånd i de olika avledningarna, samt skiftande typer av arytmier [10]. Embolier i perifer och visceral cirkulation ger vanligen mycket diskreta eller inga symtom.
Behandling i det akuta skedet syftar till understöd av vitala funktioner (cirkulation och andning) och tillförsel av 100 procent syrgas. Sänkt huvudända av sängen (Trendelenburg-läge) bedöms numera inte vara av värde, eftersom lägesförändringen inte är tillräcklig för att påverka luftens bana i det snabba och turbulenta arteriella blodflödet [11]. Dessutom uppstår luftemboliseringen nästan momentant, och efter att luft väl kommit in i ändartärerna sker ingen större omfördelning eller förflyttning.
Hyperbar oxygenbehandling innebär att patienten andas 100 procent syrgas under förhöjt tryck motsvarande 15−18 meter (2,5−2,8 atmosfärer absolut tryck) i en tryckkammare [5].
Effekterna av hyperbar oxygenbehandling är flera: först och främst komprimeras luftbubblorna till en tredjedel av sin volym genom det ökade omgivningstrycket. På detta sätt minskas icke-invasivt luftbubblornas storlek, vilka därför kan passera längre distalt till mer finkalibriga kärl. Vidare ökar lösligheten av kvävgas i blodet mångfaldigt, vilket skapar förutsättningar för att bubblorna löses upp och vädras ut [12]. Ytterligare gynnsamma effekter uppnås genom kraftigt ökad syreleverans till dåligt perfunderade områden i hjärnan [13]. Man uppnår därigenom effektiv behandling av vävnadshypoxi, förutsatt att en viss perfusion av vävnaden fortfarande finns kvar. Hyperbar oxygenbehandling har även andra positiva molekylära effekter, såsom minskad inflammatorisk reaktion, minskat ödem, protektion av endotel och minimerad ischemi/reperfusionsskada vid återupptagen cirkulation i tidigare ockluderat område [14].
Vid eventuell transport ska patienten andas 100 procent syrgas från respirator (intuberad patient) eller reservoarmask (vaken patient). I de fall då patienten måste flygas till ett hyperbarmedicinskt centrum ska transporten ske med lågt flygande helikopter eller flygplan med marktryck i kabinen.
Lungbiopsi: genomförande och komplikationer
Biopsi och nålcytologi av lungförändringar med ledning av datortomografi är en väletablerad metod för att erhålla material för diagnos av lungnoduli och pleurala och mediastinala förändringar. Metoden beskrevs 1976 [15], och flera rapporter därefter har visat att undersökningen är både effektiv och precis [16]. De vanligaste komplikationerna är pneumotorax och lungblödning, medan luftemboli är mindre vanlig men potentiellt dödlig.
I en retrospektiv studie av 610 patienter som genomgick lungpunktion beskrevs symtomgivande luftemboli hos 0,49 procent av patienterna, varav ett dödsfall (0,16 procent) [17]. För att reducera antalet komplikationer ska alltid blödningsstatus (PK-INR, APTT, TPK) och lungfunktion (FEV1) kontrolleras före biopsi. En högre frekvens av komplikationer har rapporterats vid mellannålsbiopsi [18, 19].
Behandling påbörjas direkt utifrån symtom och anamnes
De här beskrivna patienterna illustrerar det för cerebral arteriell gasemboli typiska urakuta insjuknandet med medvetslöshet och cirkulatorisk påverkan i samband med lungbiopsi. Händelserna inträffade med 13 års mellanrum, men påfallande likheter föreligger vad gäller patienternas bakgrund, diagnostisk procedur, symtombild och handläggning.
Trots att misstanke om cerebral arteriell gasemboli uttalades tidigt i förloppet hos patienterna, dröjde det ca 3 timmar innan diagnosen fastställdes. Detta berodde på att de inblandade upplevde situationen som dramatisk och oväntad. Flera alternativa diagnoser övervägdes, och patienterna utreddes med DT-hjärna, perfusions-DT, ekokardiografi, lungröntgen etc.
Eftersom cerebral arteriell gasemboli är en sällsynt komplikation, är det svårt att ta fram robusta kliniska rutiner. Det är dock viktigt att inte fastna i tidskrävande utredningar, utan att behandla patienten utifrån anamnes och kliniska fynd. Hos patient 2 verifierades luftemboli genom DT-hjärna, och diagnostiken underlättades genom att embolierna var massiva och undersökningen gjordes direkt efter händelsen. I litteraturen beskrivs flera exempel där luft aldrig har kunnat påvisas vid DT-undersökning, vilket kan bero på att det rört sig om mindre volymer luft eller att tidsfönstret för detektion passerats [3].
Således är det optimalt att ställa diagnosen cerebral arteriell gasemboli enbart baserat på patientens symtom och anamnes och påbörja behandling direkt.
Tiden till start av hyperbar oxygenbehandling torde vara avgörande för behandlingsresultatet, eftersom tiden för upphävd eller kraftigt nedsatt cirkulation är avgörande vid uppkomst av ischemiska hjärnskador [1]. Det är fullt möjligt att vid snabb diagnos inleda tryckkammarbehandling inom 20 minuter, förutsatt att denna metod finns vid sjukhuset.
Vi rekommenderar att sjukvårdsinrättningar som genomför nålpunktion i lunga utan att ha tillgång till tryckkammarbehandling på förhand säkrar kontakter med närmaste hyperbarmedicinska centrum (i Göteborg, Uddevalla, Karlskrona eller Stockholm). Tryckkammarjour kan i akuta situationer nås via sjukhusväxel eller via 112.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.




![Figur 5 (patient 1). MR-hjärna dag 13 visar normalisering av bilden (minimalt kvarvarande ödem, inga cerebrala infarkter) (axial T2-viktad EPI-sekvens [ekoplanar avbildning]).](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3A/%5bD93A%5d/2016-142_5_webb.jpg)