Evidensbaserade riktlinjer för endoskopisk uppföljning efter kolorektal polypektomi presenteras i denna artikel.
Riktlinjerna är huvudsakligen baserade på de rekommendationer som den europeiska föreningen för gastrointestinal endoskopi (ESGE) publicerade 2013.
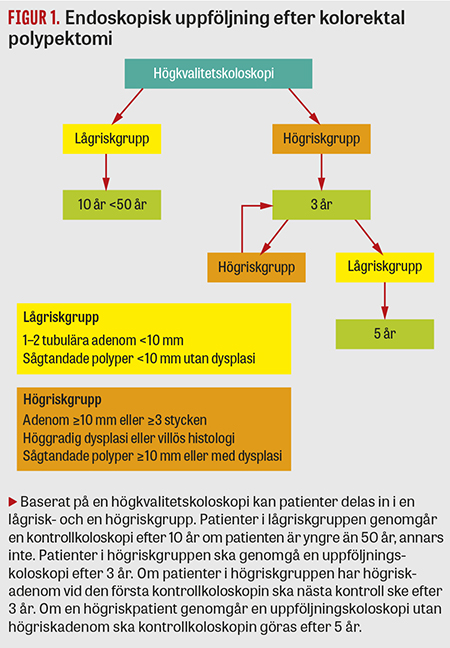
I dag är det möjligt att dela upp patienter i en lågrisk- och en högriskgrupp med avseende på risk att utveckla kolorektal cancer.
En förutsättning för uppföljning är att den baseras på en högkvalitetskoloskopi.
Mer kunskap om sågtandade polypers biologi och naturalförlopp behövs för att utveckla riktlinjerna.
Kolorektal cancer drabbar drygt 6 000 personer varje år och är den tredje vanligaste cancerrelaterade dödsorsaken i Sverige [1]. Neoplastiska polyper utgör förstadium till all kolorektal cancer. Ett ökande antal länder i Europa inför koloskopiscreening, och i Sverige pågår en screeningstudie (SCREESCO-studien). Primärt syftar screeningen till att ta bort precancerösa polyper och detektera cancer på ett tidigt stadium, och därmed minska antalet personer som insjuknar och dör av kolorektal cancer [2-5]. Sekundärt möjliggör de endoskopiska fynden att man kan identifiera högriskpatienter med ökad framtida risk att utveckla kolorektal cancer [6-8].
I dag saknas randomiserade studier som visar effekten av endoskopiska kontroller. Epidemiologiska studier har visat att patienter som inte ingår i sådana program har en 3–4 gånger högre risk att drabbas av kolorektal cancer [9, 10]. Flera undersökningar har visat att 15–30 procent av befolkningen har kolorektala polyper [6, 7, 11, 12]. Oselekterad implementering av endoskopisk uppföljning efter polypektomi skulle utgöra en orimlig belastning på sjukvården med onödiga kostnader och längre väntetider till koloskopi för andra indikationer. I dag upptar koloskopikontroller ca 20 procent av den endoskopiska kapaciteten. Med införande av screening kan behovet av endoskopisk uppföljning antas öka ytterligare [13-15]. Även om koloskopi anses vara en ofarlig undersökning finns risk för allvarliga komplikationer (perforation, blödning). Hos patienter med ökad risk för att utveckla kolorektal cancer är fördelarna med koloskopi större än riskerna. Hos patienter med marginellt ökad risk för kolorektal cancer är däremot vinsten med endoskopisk uppföljning mer tveksam. Om man beaktar bristen på starkt vetenskapligt stöd och den stora arbetsinsats som koloskopikontroller innebär ter det sig rimligt att begränsa uppföljning till patienter med substantiellt ökad risk för att drabbas av kolorektal cancer.
Nyare studier har visat att det är möjligt att dela upp patienter i en lågrisk- och en högriskgrupp med avseende på risk att utveckla kolorektal cancer [16, 17]. Detta är grunden för flera internationella riktlinjer, till exempel de från den brittiska föreningen för gastroenterologi [18] och de senaste från den europeiska föreningen för gastrointestinal endoskopi (ESGE), vilka gavs ut 2013 [19]. De senaste svenska riktlinjerna publicerades 2003 [20]. Vår målsättning är att på uppdrag från Svensk gastroenterologisk förening och Svensk förening för kolorektal kirurgi uppdatera och anpassa dessa riktlinjer till de senaste europeiska riktlinjerna. ESGE:s evidensbaserade riktlinjer utgör grunden till de aktuella riktlinjerna för endoskopisk uppföljning efter polypektomi (Figur 1). I de här riktlinjerna inkluderas inte koloskopikontroller efter borttagande av maligna polyper eftersom dessa patienter alltid ska diskuteras på multidisciplinär konferens.
Högkvalitetskoloskopi
Koloskopi som görs på kvalitetskontrollerade enheter kan substantiellt reducera risken för att drabbas av metakron avancerad neoplasi [2, 21, 22] (Fakta 1). Studier har visat att lågkvalitetskoloskopi (lågfrekvent polypdetektion eller inkomplett intubation) är regelmässigt associerad med ökad incidens av intervallcancer [3, 23-25]. Dessutom orsakar inkomplett resektion av polyper en ökad risk för senare kolorektal cancer [10, 26, 27]. Data har också visat att frekvensen missade polyper inte är försumbar. Till exempel missas 2 procent av alla polyper större än 10 mm och 13 procent av alla polyper mellan 6 och 9 mm i storlek [28]. Därför är högkvalitetskoloskopi (Fakta 2) en förutsättning för de aktuella riktlinjerna för endoskopisk uppföljning. Definitionen av högkvalitetskoloskopi anges i en separat artikel i detta nummer av Läkartidningen.
Lågriskgrupp
Lågriskpatienter definieras som patienter med 1–2 tubulära adenom mindre än 10 mm i storlek. Studier har övertygande visat att risken för att utveckla kolorektal cancer i lågriskgruppen inte är större än hos befolkningen i allmänhet [10, 29, 30]. En registerstudie som inkluderade 5 779 patienter efter polypektomi visade att lågriskgruppen inte hade någon ökad långtidsrisk för kolorektal cancer trots att ingen endoskopisk uppföljning genomfördes [9]. Majoriteten av studier har också rapporterat att incidensen av metakron neoplasi i lågriskgruppen inte är förhöjd upp till 10 år efter polypektomi [31-33]. Det saknas i dag övertygande data som stöder att lågriskgruppen har ökad risk att utveckla kolorektal cancer. Det finns därför olika rekommendationer. Den brittiska föreningen för gastroenterologi rekommenderar ingen endoskopisk uppföljning [18] medan ESGE rekommenderar uppföljande koloskopi efter 10 år av patienter i lågriskgruppen. Mot bakgrund av att koloskopiresurserna måste användas optimalt har vi här kompromissat och rekommenderar endoskopisk uppföljning av lågriskpatienter efter 10 år om patienten är yngre än 50 år, annars inte. Framtida forskning får visa hur lågriskpatienter bäst ska följas upp.
Högriskgrupp
I ESGE:s riktlinjer definieras högriskpatienter som patienter med adenom med villös histologi, höggradig dysplasi eller storlek på 10 mm eller mer, eller där tre eller fler adenom detekteras. Epidemiologiska studier har visat att patienter i högriskgruppen har ökad risk att drabbas av kolorektal cancer jämfört med befolkningen i allmänhet. En studie beskrev att patienter i högriskgruppen hade 3,6–6,6 gånger ökad risk för kolorektal cancer efter 14 år utan koloskopikontroller [34]. Dessutom har studier visat att endoskopisk uppföljning av patienter i högriskgruppen minskar incidensen av kolorektal cancer [10, 29, 30]. Övertygande data indikerar att incidensen av metakron avancerad neoplasi är högre hos patienter i högriskgruppen än hos patienter utan polyper vid indexkoloskopin [21, 31, 35]. Även om den ökade risken för senare avancerad neoplasi i högriskgruppen är tydlig är det dock oklart vilken enskild betydelse de individuella polypegenskaperna såsom storlek, antal, dysplasigrad och villös histologi har. En studie har visat att antal, storlek och villös histologi utgör oberoende riskfaktorer för metakron avancerad neoplasi [17].
Studier har visat att incidensen av metakron avancerad neoplasi hos patienter i högriskgruppen endast är 3,3 procent oavsett om kontrollkoloskopin görs efter 1 eller 3 år [36]. Däremot talar data starkt för att risken för avancerad neoplasi ökar markant efter 3–5 år i högriskgruppen [37]. Mot den här bakgrunden rekommenderar ESGE en uppföljande koloskopi efter 3 år hos patienter i högriskgruppen. Patienter med 10 eller fler adenom rekommenderas genetisk rådgivning på grund av risk för familjär adenomatös polypos (FAP) eller andra genetiska tillstånd såsom Mut-YH-associerad polypos (ärftligt polypossyndrom). Om högriskadenom detekteras vid första eller senare koloskopikontroll rekommenderas nästa uppföljningskoloskopi efter 3 år. Patienter med högriskadenom vid indexkoloskopin som inte har några högriskadenom vid den första uppföljningskoloskopin har dubbelt så hög risk för metakron avancerad neoplasi vid den andra uppföljningskoloskopin jämfört med personer som inte hade något högriskadenom vid indexkoloskopin [31, 38, 39]. Detta är anledningen till att den andra koloskopikontrollen görs 5 år efter den första uppföljningskoloskopin hos patienter med högriskadenom vid indexkoloskopin men utan sådana vid den första kontrollkoloskopin. Det finns inga data om optimala intervall för kontroller hos patienter med högriskadenom vid indexkoloskopin och sedan två konsekutiva uppföljningskoloskopier utan högriskadenom, men ESGE rekommenderar ett intervall på minst 5 år.
Sågtandade polyper
Sågtandade polyper klassificeras enligt WHO i 3 olika kategorier: bredbasigt sågtandat adenom/polyp, traditionellt sågtandat adenom och hyperplastisk polyp med några undergrupper [40, 41]. Det finns inga prospektiva studier som utvärderat icke-neoplastiska och neoplastiska sågtandade polyper med avseende på långtidsrisk att utveckla kolorektal cancer. Totalt sett orsakar sågtandade polyper 20–30 procent av all sporadisk kolorektal cancer, vilket gör dessa förändringar till ett stort hälsoproblem [42, 43]. ESGE rekommenderar att sågtandade polyper mindre än 10 mm i storlek och utan inslag av dysplasi klassificeras som lågriskfall. Patienter med sågtandade polyper som är 10 mm eller större eller med inslag av dysplasi ska följas upp som dem med högriskpolyper. Patienter med sågtandade polyper som uppfyller WHO:s kriterier för sågtandat polypossyndrom (Fakta 3) bör remitteras för genetisk rådgivning.
Speciella situationer
Inkomplett resektion. Inkomplett resektion av större polyper (≥ 10 mm) måste uteslutas innan patienter inkluderas i uppföljningsprogram. En studie rapporterade att upp till en femtedel av alla polyper ≥ 10 mm genomgår ofullständig resektion [44]. Data visar att inkomplett polypresektion ökar risken för intervallcancer [27]. Mot denna bakgrund rekommenderas patienter med polyper ≥ 10 mm som genomgått inkomplett eller så kallad piecemeal-resektion med oklar radikalitet att genomgå en kontrollkoloskopi inom 6 månader. Normalt makroskopiskt utseende på platsen för polypektomin och negativa biopsier borgar för radikalitet.
Ålder. Det finns inga studier som utvärderat optimal ålder för att avsluta uppföljning efter polypektomi. Man vet att personer äldre än 80 år har en nära 3 gånger så hög risk för metakron avancerad neoplasi som personer i åldern 50–60 år [17]. Däremot är det ingen skillnad mellan individer 50–60 år och 60–70 år gamla [31]. Eftersom tiden för progression från adenom till cancer bedöms vara 10–20 år bör patienten bedömas ha minst 10 år kvar att leva för att ingå i ett endoskopiskt uppföljningsprogram. ESGE rekommenderar att uppföljningen avslutas vid 80 års ålder. Individualiserade rekommendationer bör ta hänsyn till allmän hälsa, samsjuklighet och tidigare koloskopifynd.
Ärftlighet. I en stor metaanalys som inkluderade drygt 21 000 patienter undersöktes risken för metakron avancerad neoplasi hos patienter med en förstagradssläkting (föräldrar, syskon eller barn) med kolorektal cancer [45]. Ingen av studierna analyserade betydelsen av ålder vid cancerdiagnos eller antalet släktingar med cancer. Noterbart är att man inte kunde påvisa något samband mellan patienter med förstagradssläkting med cancer och metakron avancerad neoplasi.
Suboptimal koloskopi. Ofullständigt rengjord tarm ökar risken för att missa polyper vid koloskopi [46-48]. Bristande tarmrengöring har också visat sig öka risken för att missa metakron avancerad neoplasi [49]. I sådana fall rekommenderas att patienten genomgår en ny koloskopi inom en snar framtid. Om tarmen är relativt ren men man inte detekterat någon polyp och kan utesluta polyper större än 5 mm kan man överväga att tidigarelägga uppföljningen till 5 år. Vid förnyad koloskopi på grund av dålig tarmförberedelse ska alla rekommendationer för tarmrengöring inklusive delad laxering följas.
Slutsats
Dessa ESGE-baserade riktlinjer möjliggör en evidensgrundad riskstratifiering för endoskopisk uppföljning efter polypektomi, i syfte att begränsa kontroller till patienter med ökad risk för kolorektal cancer. Riktlinjerna optimerar resursutnyttjandet för att maximera vinster för patienter, något som är viktigt med tanke på det ökade införandet av kolorektal cancerscreening som pågår i hela Europa inklusive Sverige. Fortfarande behövs mer kunskap inom området, framför allt en ökad förståelse av sågtandade polypers biologi och naturalförlopp.
Läs även:
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Avancerad neoplasi.
- Adenom med villös histologi eller höggradig dysplasi samt cancer.
Fakta 2. Högkvalitetskoloskopi
- Komplett koloskopi med noggrann inspektion av hela tarmen efter adekvat rengöring.
- Radikal polypektomi och PAD på alla borttagna polyper.
Fakta 3. WHO-kriterier för sågtandat polypossyndrom
- Mer än 5 stycken sågtandade polyper proximalt om sigmoideum.
- Minst en sågtandad polyp proximalt om sigmoideum hos person med en förstagradssläktning som har sågtandat polypossyndrom.
- Fler än 20 sågtandade polyper i kolon.