Antalet patienter som läggs in levande på sjukhus efter hjärtstopp ökar.
Graden av cerebral hypoxi/ischemi vid hjärtstoppet är avgörande för prognosen för om övriga vitala organ återfår stabil funktion.
Europeiska rekommendationer anger att den neurologiska prognosen inte bör bedömas förrän tidigast 3 dygn efter hjärtstoppet.
Neurologisk prognosbedömning bör vila på undersökningsmetoder som är oberoende av varandra: kliniska och neurofysiologiska undersökningar, bilddiagnostik och biomarkörer.
Om prognosbedömningen 3–4 dygn efter hjärtstoppet inte säkert indikerar dåligt neurologiskt utfall rekommenderas ytterligare något dygns exspektans med förnyade undersökningar.
Av de drygt 5 500 personer i Sverige som får hjärt–lungräddning (HLR) på grund av hjärtstopp utanför sjukhus har antalet som läggs in levande på sjukhus ökat de senaste åren till knappt 1 400 under 2015 [1]. För de patienter som återfår stabil hjärtfunktion och cirkulation men som är fortsatt medvetslösa är graden av hypoxisk/ischemisk hjärnskada avgörande för prognosen [2].
Svenska HLR-rådets arbetsgrupp för vård efter hjärtstopp har tidigare i Läkartidningen beskrivit vilka undersökningsmetoder som bör finnas på olika sjukhus och hur de kan tillämpas för att den neurologiska prognosbedömningen ska bli så säker som möjligt [3]. Sedan dess har nya data och sammanställningar av en europeisk expertgrupp modifierat bilden något [4].
Till de viktigaste nyheterna hör att det inte längre finns stöd för att förlänga observationstiden om patienten behandlats med aktiv temperaturkontroll. Vidare har utebliven motorisk smärtreaktion visat sig vara ett osäkert tecken på dålig prognos, även 72 timmar eller mer efter hjärtstoppet. Bortfall av pupillreflex och blinkreflex samt bortfall av kortikala svar på stimulering (sensorisk reaktionspotential; SEP [sensory evoked potentials]) är fortfarande de mest robusta prediktorerna för dåligt neurologiskt utfall. »Sena uppvaknanden«, som beskrivits bland patienter som av olika skäl fått förlängd behandlingstid [5-7], understryker vikten av att utesluta kvarvarande effekt från sederande läkemedel.
European Resuscitation Council (ERC) gav nyligen ut uppdaterade evidensbaserade riktlinjer för vård efter hjärtstopp, vilka även omfattar rekommendationer för individuell neurologisk prognosbedömning [8]. Bra respektive dåligt neurologiskt utfall definieras med hjälp av den s k CPC (Cerebral performance categories)-skalan (Fakta 1).
Syftet med denna artikel är att, baserat på de europeiska rekommendationerna och av den svenska arbetsgruppen valda referenser, uppdatera HLR-rådets rekommendationer för neurologisk prognosbedömning av den medvetslösa patienten efter hjärtstopp. Artikeln kan med fördel läsas som en fortsättning på den tidigare publikationen, där en del grundinformation om de olika metoderna återfinns [3].
Omständigheter kring hjärtstoppet
Tack vare ett stort antal analyser av data från prehospitala register inklusive Svenska hjärt–lungräddningsregistret (www.hlr.nu) är omständigheter med betydelse för prognos väl kända, och en systematisk genomgång publicerades nyligen i Läkartidningen [10]. Att den första observerade rytmen kunnat defibrilleras och att avancerad HLR startats snabbt är de viktigaste faktorerna som är kopplade till ökad överlevnad. Obevittnat hjärtstopp och lång väntan på HLR är kopplat till sämre överlevnad.
Tiden från hjärtstopp till återkomst av spontan cirkulation (ROSC; return of spontaneos circulation) är en faktor som ofta diskuteras inför eventuell intensivvård efter ett hjärtstopp. Även om tid till återkomst av spontan cirkulation är kortare i gruppen som överlever än i gruppen som avlider efter intensivvård [11] är antalet patienter som överlever lång HLR alltför stort [12, 13] för att tid till återkomst av spontan cirkulation ska vara av säkert prognostiskt värde på individnivå. Under tiden fram till återkomst av spontan cirkulation är sannolikt kvaliteten på utförd HLR mer avgörande, dvs bröstkompressionernas djup och frekvens och bröstkorgens återfjädrande förmåga samt minimala avbrott [14]. Dessa parametrar är dock svåra att skatta i det enskilda fallet.
Sammanfattningsvis är ingen av de i dag mätbara faktiska omständigheterna kring plötsligt hjärtstopp och dess initiala behandling tillräckligt robust som ensam prediktor för senare neurologiskt utfall. Inte heller de hittills publicerade riskpoängsystem som bygger på kombinationer av faktiska omständigheter och patientparametrar direkt efter återkomst av spontan cirkulation [15, 16] ger tillräckligt säkert underlag för individuell prognosbedömning.
Klinisk neurologisk undersökning
Observation av vakenhetsgrad och eventuella kramper samt daglig undersökning av hjärnstamsreflexer är bland de viktigaste underlagen som ger en bild av patientens möjligheter till återhämtning. Tidpunkten för prognosbedömning är avgörande, eftersom utslagna hjärnstamsreflexer kan återkomma under de första dygnen, både vid god och vid dålig prognos. Bilateral avsaknad av både pupill- och kornealreflexer efter 72 timmar är en säker prediktor för dåligt utfall med falskt positiv frekvens nära 0 procent men med låg sensitivitet, kring 20 procent [4].
Hos ett litet antal patienter kan smärtreaktion och hjärnstamsreflexer ha fallit bort permanent till följd av total hjärninfarkt, vilken måste diagnostiseras enligt lagstadgade kriterier.
Kramper efter hjärtstopp uppträder hos en tredjedel av patienterna och är kopplade till dåligt neurologiskt utfall [17]. Myoklona muskelryckningar i ansikte, bål och extremiteter är vanligast, men även generaliserade tonisk-kloniska och fokala epileptiska anfall förekommer. Myoklonier som är uttalade och generaliserade under >30 minuter benämns myoklont status, vilket är en klinisk diagnos. Om myoklont status uppträder under de första 1–2 dygnen efter hjärtstopp talar det starkt för dåligt utfall med falskt positiv frekvens på 0 procent i systematiska översikter [4], men enstaka patienter kan överleva med god funktion [18, 19].
Hos patienter utan kliniska kramper upptäcks ibland vid EEG-undersökning pågående anfallsaktivitet, s k elektrografiskt status epilepticus [20]. Det talar vanligen för dåligt utfall, men en del patienter återhämtar sig väl trots recidiverande anfallsaktivitet under dagar till veckor [21]. Det är osäkert om behandling av elektrografisk anfallsaktivitet förbättrar prognosen [22, 23].
Neurofysiologiska metoder
EEG-bilden förändras dagarna efter ett hjärtstopp men påverkas föga av kroppstemperaturen. EEG-bakgrundens utseende är tydligast kopplat till prognosen. Återkomst av kontinuerlig bakgrundsaktivitet och reaktivitet under det första dygnet är ett gynnsamt tecken. Bland patienter som tidigt uppvisar kontinuerlig bakgrundsaktivitet men som senare utvecklar elektrografiskt status epilepticus finns en liten grupp som får bra neurologiskt utfall [20]. Om man inte använder kontinuerlig uppkoppling kan således ett rutin-EEG under det första dygnet vara av värde för jämförelse med ett rutin-EEG ca 3 dygn efter hjärtstoppet. Det senare ger dock det viktigaste underlaget för prognosbedömning.
I nyare EEG-studier används ofta en standardiserad tolkningsterminologi, som införts av American Clinical Neurophysiology Society [24]. Bland 103 patienter i TTM-studien [25] med rutin-EEG registrerat 2–4 dagar efter hjärtstopp fann man att »högmalignt« mönster (Figur 1) var kopplat till dåligt utfall med falskt positiv frekvens på 0 procent och sensitivitet 50 procent [26]. Dessa mönster, som med varierande definition även tidigare angivits som starkt förenade med dåligt utfall [27], kan betraktas som säkra negativa prediktorer om de uppträder inom detta tidsspann och om läkemedelseffekt kan uteslutas.
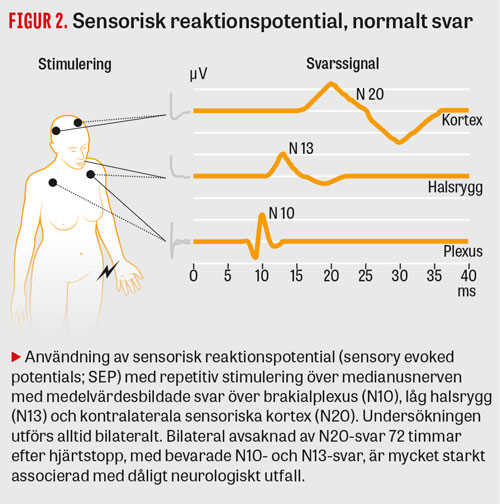
Användning av sensorisk reaktionspotential (sensory evoked potentials; SEP) förutsätter en tekniskt korrekt undersökning och görs alltid bilateralt. Som kvalitetsindikatorer ska svar finnas över plexus/låg halsrygg (N10- respektive N13-potentialer; Figur 2), och brusnivån kortikalt ska vara <0,25 μV, vilket vanligen kräver muskelrelaxering och ibland nålelektroder. Bedömning görs huruvida »svar finns«, »svar saknas bilateralt« eller huruvida patienten tillhör en grupp där registreringen är »obedömbar«, vilket innebär att patienten prognosmässigt ska behandlas som om N20-svar finns. Undersökningen kan i sådana fall med fördel upprepas nästa dag.
I metaanalyser har bilateral avsaknad av N20-potentialer vid undersökning 1–7 dygn efter hjärtstopp haft falskt positiv frekvens på nära 0 procent för dåligt utfall, men sensitiviteten är begränsad till ca 40 procent [27]. Gränsen för avsaknad av N20-svar är inte strikt definierad; 0,3 μV har föreslagits [28], men även låga amplituder <0,5–0,6 μV talar starkt för dålig prognos [29, 30]. Att ett fåtal patienter rapporterats ha bra utfall trots bortfall av N20-svar kan sannolikt hänföras till feltolkning av artefaktrika registreringar [31, 32].
Bilddiagnostik
Efter fullbordad ischemi uppstår ett generellt cytotoxiskt ödem i hjärnan som gör att grå substans i kortex och basala ganglier avgränsas dåligt eller inte alls från vit substans på datortomografi (DT) (Figur 3). Minskad kvot mellan täthet i grå och vit substans har stark koppling till dåligt utfall om förändringarna är utbredda och uppträder inom 24 timmar. Sensitiviteten varierar dock starkt beroende på vilka gränsvärden som tillämpas. Med kvoten mellan täthet i grå och vit substans tillräckligt lågt satt för falskt positiv frekvens (0–4 procent) har sensitiviteten visat sig vara mycket låg: 3,5–20 procent i färska studier [33, 34].
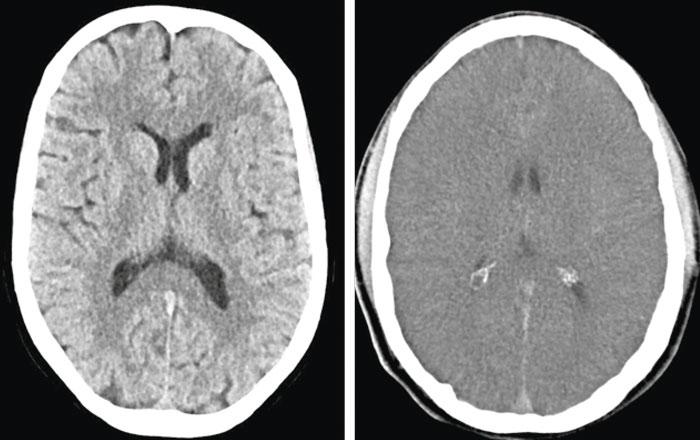
Mindre uttalade ischemiska/anoxiska förändringar är ofta svåra att påvisa och bedöma med hjälp av DT, och för neurologisk prognosbedömning rekommenderas främst undersökning med magnetresonans (MR) 3–5 dagar efter hjärtstoppet, eftersom MR-bilden utvecklas över tid. Diffusionsviktade bilder med beräknad »apparent diffusion coefficient« (ADC), som avspeglar medeldiffusionen i varje bildelement, är överlägsna konventionella MR-sekvenser för att påvisa akuta hypoxiska/ischemiska lesioner.
Den nedsatta diffusionen i sådana områden ger hög signalintensitet (vitt) på diffusionsviktade bilder och låg signalintensitet (svart) på kvantitativ ADC-karta (Figur 4). Bilaterala utbredda eller multipla lesioner med nedsatt diffusion i kortex, djup grå substans och lillhjärna är förknippade med dålig prognos.
I en nyare studie med strukturerad visuell skattning av akuta diffusionslesioner nådde man 0 procent falskt positiv frekvens och 55–60 procents sensitivitet för dåligt utfall [35]. I studier med ADC-mätning har låga värden i olika regioner eller i hela hjärnan associerats till dålig prognos. Nyligen fann man vid retrospektiv semiautomatisk diffusionsanalys i en multicenterkohort med 125 patienter att ADC <650 × 10-6 mm2/s i minst 10 procent av hjärnans volym gav 9 procent falskt positiv frekvens och 72 procents sensitivitet för dåligt utfall [36].
Icke desto mindre är tillgängliga MR-studier analystekniskt heterogena, och för såväl diffusionsviktade som ADC-baserade mätningar saknas säkra tröskelvärden för prognosbedömning i klinisk vardag.
Biomarkörer
Bland hittills kända biomarkörer i blod har neuronspecifikt enolas (NSE), som frisätts till blodet från hjärnans nervceller vid bl a hypoxisk/ischemisk skada, visat sig fungera bäst för prognosbedömning vid hjärtstopp [8]. NSE förekommer också i röda blodkroppar och vissa tumörer, varför hemolys respektive förekomst av neuroektodermal tumör kan ge förhöjda NSE-värden utan hjärnskada.
En fördel med NSE är att det, till skillnad från kliniska undersökningsfynd och EEG, ger ett kvantitativt mått som inte påverkas av sederande läkemedel. Till nackdelarna hör att det har varit svårt att identifiera tillförlitliga tröskelvärden för bra respektive dålig prognos. Detta beror delvis på bristande standardisering av metoder och instrument [37] men också på att provhanteringen skiftar mellan olika laboratorier.
Den hittills största studien med NSE som prognostisk markör omfattade 686 patienter och visade att tröskelvärde ≥48 ng/ml vid 48 timmar alternativt ≥38 ng/ml vid 72 timmar efter hjärtstopp gav ≤2 procent falskt positiv frekvens och 58 procents sensitivitet för dåligt utfall (Roche analysmetod). En stigande trend mellan prov tagna vid 24 och 48 timmar stärkte det negativa prognostiska värdet [38].
Som indikator för dåligt utfall rekommenderar vi därför en kombination av höga värden vid 48 och 72 timmar efter hjärtstoppet och en stigande NSE-nivå mellan 24 och 48 timmar. Vad som är höga värden måste anges lokalt och baseras på vilken analysmetod som används.
Prognosbedömning i praktiken
Rekommendationerna är avsedda som praktisk vägledning för neurologisk prognosbedömning av patienter som är medvetslösa efter hjärtstopp. De utgår från svenska förhållanden och följer i allt väsentligt nyligen publicerade europeiska riktlinjer [8]. En förutsättning för adekvat prognosbedömning är att ett brett underlag samlats in genom systematiska undersökningar vid specificerade tidpunkter efter hjärtstoppet och att resultaten genomgående pekar i samma riktning.
Som komplement till den kliniska neurologiska undersökningen är därför tillgång till DT, EEG och analys av NSE av stor betydelse. MR kan ge god vägledning om man har erfarenhet av mätmetoder och tolkning av anoxiska/ischemiska typskador efter hjärtstopp. Sensorisk reaktionspotential (SEP) är en viktig metod, och det är önskvärt att tillgängligheten till metoden ökar.
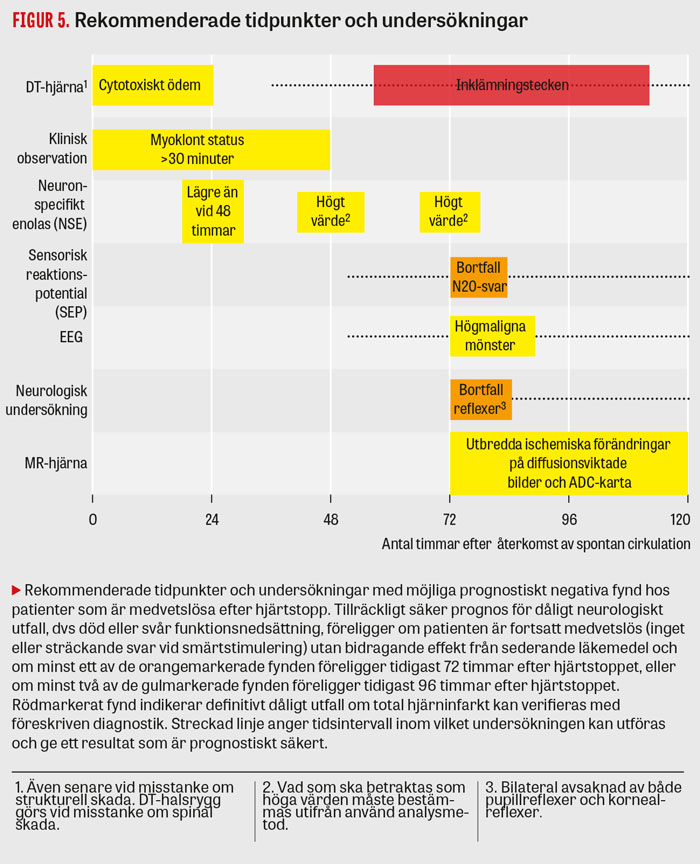
Figur 5 visar rekommenderade undersökningar och tidpunkter efter hjärtstopp. Det är viktigt att påverkan från sederande läkemedel minimeras inför klinisk undersökning och EEG-registrering. Under de 3 första dygnen samlas information, men någon säker neurologisk prognosbedömning kan inte göras förrän tidigast 72 timmar efter hjärtstoppet.
Prediktorer för gynnsam prognos är bristfälligt utforskade. Patienter som återfår kontinuerlig EEG-bakgrund inom 24 timmar [39], patienter med ett godartat rutin-EEG efter avslutad temperaturbehandling [26] och patienter med lokaliserande smärtreaktion eller bättre efter avslutad sedering [40] har bra prognos för återgång till ett självständigt liv med god livskvalitet.
Avbrytande av behandling
Nyttan med intensivvård måste värderas löpande från första dagen utifrån pågående svikt i olika organ, grundsjukdomar och patientens habituella funktionsnivå. Under de 3 första dygnen efter hjärtstopp bör den bedömningen dock hållas skild från vad man tror om det neurologiska utfallet. Man bör vara medveten om risken för självuppfyllande profetia när livsuppehållande behandling avbryts utan säkra prediktorer för dåligt neurologiskt utfall [5-7].
Beräkningar baserade på amerikanska registerdata har antytt att 26 procent av de patienter som avlidit efter det att intensivvård avbrutits tidigare än 72 timmar skulle ha kunnat överleva om livsuppehållande behandling hade fortsatt [18]. I en nyligen publicerad europeisk studie återfick 29 procent av dem som vaknade medvetandet senare än 72 timmar efter återkomst av spontan cirkulation [41]. Författarna fann att sederande läkemedel i kombination med farmakokinetiska riskfaktorer som hög ålder och njursvikt hade avgörande betydelse för sena uppvaknanden (upp till 12 dagar efter hjärtstoppet). Dessa studier talar starkt för användning av kortverkande sederande preparat för att undvika såväl förlängd som för tidigt avbruten vård på grund av kvardröjande läkemedelseffekter.
Många patienter med dålig prognos går inte att identifiera vid den första bedömningen efter 3 dygn, eftersom de mest robusta negativa prediktorerna har begränsad sensitivitet (okulära reflexer, sensorisk reaktionspotential) och tillgänglighet (sensorisk reaktionspotential). De flesta patienter med dålig prognos kommer dock att kunna identifieras efter ytterligare något dygn med hjälp av resultaten från de rekommenderade undersökningarna (Fakta 2).
Även efter 4–5 dygn kommer ett litet antal patienter att vara fortsatt medvetslösa men utan tillräckligt säkra prediktorer för dåligt utfall. I det läget rekommenderas något till några dygns fortsatt intensivvård med upprepade kliniska undersökningar och EEG. Detta konservativa förhållningssätt syftar till att möjliggöra sent uppvaknande för enstaka patienter.
Någon tidsgräns för aktiv exspektans i avsaknad av tillräckligt säkra undersökningsresultat är svår att rekommendera. Totalt 1 veckas intensivvård ter sig rimlig för att kunna göra kompletterande undersökningar och för att helt utesluta inverkan från sederande läkemedel. Ytterligare tid kan vara motiverad i vissa fall, t ex om man valt att aktivt behandla elektrografiskt status epilepticus med stöd av gynnsamma prognostiska faktorer [20].
Det saknas vetenskapligt stöd för att förlängd intensivvård i brist på tydliga tecken på svår hjärnskada skulle skapa fler vegetativa patienter. Patienter som inte vaknat efter hjärtstopp avlider vanligen en kort tid efter det att intensivvård avbrutits och man övergått till palliativ vård [2, 41].
I avsaknad av tydliga positiva eller negativa prediktorer blir till sist den sammantagna kliniska bilden avgörande för vidare beslut.
Potentiella bindningar eller jävsförhållanden: Hans Friberg har mottagit föreläsararvode från BARD Medical och är medicinsk rådgivare till QuickCool AB.
Fakta 1. CPC-skalan
Neurologisk funktion efter hjärtstopp klassificeras enligt CPC (Cerebral performance categories)-skalan: 1–2 räknas vanligen som bra utfall och 3–5 som dåligt utfall [9].
CPC 1. God cerebral funktion. Alert, har förmåga att arbeta och leva ett normalt liv. Kan ha mindre psykologiska eller neurologiska svårigheter (lindrig dysfasi, icke-funktionsnedsättande hemipares eller mindre kranialnervsdysfunktion).
CPC 2. Måttlig cerebral funktionsnedsättning. Tillräcklig cerebral funktion för deltidsarbete i skyddad omgivning eller självständigt vardagsliv såsom påklädning, resa med allmänna transportmedel och matlagning. Kan ha hemiplegi, kramper, ataxi, dysartri, dysfasi eller kroniska minnessvårigheter eller mentala svårigheter. Är orienterad till tid och rum.
CPC 3. Svår cerebral funktionsnedsättning. Vid medvetande. Beroende av andra för dagliga aktiviteter på grund av försämrad hjärnfunktion (på institution eller hemma med exceptionellt familjestöd). Begränsad uppfattningsförmåga. Inkluderar ett brett spektrum av cerebrala nedsättningar.
CPC 4. Medvetslös. Omedveten om omgivningen. Ingen uppfattningsförmåga. Inget verbalt eller psykologiskt samspel med omgivningen.
CPC 5: Död.
Fakta 2. Prognosbedömning
Tillräckligt säker prognos för dåligt neurologiskt utfall (död eller svår funktionsnedsättning) efter hjärtstopp föreligger om patienten är fortsatt medvetslös (inget svar eller sträckmönster vid smärtstimulering) och utan bidragande effekt från sederande läkemedel under följande förutsättningar.
Tidigast 3 dygn (72 timmar) efter hjärtstoppet med minst ett av dessa fynd:
- bilateralt bortfall av pupill- och kornealreflex
- bilateralt bortfall av N20-svaret vid undersökning av sensorisk reaktionspotential.
Tidigast 4 dygn (96 timmar) efter hjärtstoppet med minst två av dessa fynd:
- myoklont status som debuterat <48 timmar efter återkomst av spontan cirkulation
- höga NSE-värden vid 48 och 72 timmar samt en stigande trend mellan värdena 24 och 48 timmar efter återkomst av spontan cirkulation
- högmalignt EEG-mönster på registrering ca 3 dygn efter återkomst av spontan cirkulation eller senare
- omfattande tecken på anoxisk/ischemisk skada på DT-undersökning av hjärnan inom 24 timmar eller MR-undersökning av hjärnan 3–5 dygn efter hjärtstoppet.