Den svenska studien BDD (Bättre diabetesdiagnos) har pågått i tio år. Data har samlats in från 8 000 barn med diabetes.
Analys av HLA-genotyp, diabetesautoantikroppar och C-peptidnivå vid insjuknande i diabetes förbättrar diagnostiken av såväl typ 1- och typ 2-diabetes som monogen diabetes (MODY). Dessa analyser är nu klinisk rutin.
Om ett barn med diabetes inte har diabetesautoantikroppar och har HLA-typer kopplade till låg risk för typ 1-diabetes bör genetisk MODY-diagnostik övervägas. Patienter med MODY ska ha specifik behandling.
Typ 2-diabetes är ovanlig bland barn i Sverige. Snabb diagnos och behandling är dock viktigt för den långsiktiga prognosen.
Det är svårt att initialt ställa rätt diabetesdiagnos. Man bör därför efter 1 år ta ställning till om diagnosen är korrekt.
Det har länge funnits både kliniska och vetenskapliga skäl att försöka optimera diabetesdiagnostiken bland barn i Sverige. Incidensen av typ 1-diabetes har ökat under lång tid (Figur 1), och även typ 2-diabetes har ökat bland ungdomar i stora delar av världen. Detta har medfört en oro att diabetes hos barn felklassificeras, med suboptimal vård som effekt.
Barnläkarföreningens sektion för diabetes och endokrinologi bjöd därför in alla barndiabetologer i Sverige till en diskussion om hur diagnostiken skulle kunna förbättras. Så småningom utkristalliserades den forskargrupp som skapade studien BDD (Bättre diabetesdiagnos) med målsättning att förbättra diagnostiken av barn med diabetes för att undvika felbehandling och för ökad kunskap om varför incidensen av typ 1-diabetes är så hög och fortsätter att öka.
Den här översikten avser att ge en bild av kunskapsläget kring barndiabetesdiagnostik i dag och vilka förändringar som skett under de 10 år som BDD funnits.
Analyser från BDD-studien blir klinisk rutin
BDD startade med att barn med nydebuterad diabetes erbjöds att delta i studien. Blodprov analyserades för kända autoantikroppar mot diabetes samt HLA-genotyp. Även C-peptidnivå analyserades för att bättre diskriminera mellan olika diabetestyper. Efter något år adderades autoantikroppar mot zinktransportör till analyserna [1]. Redan under det första helåret, 2006, var anslutningen hög; 75 procent av barnen med diabetes registrerades i BDD, och i dag är mer än 95 procent av svenska barn som får diabetesdiagnos med i BDD-studien. Barn med ovanliga typer av diabetes som inte sköts av diabetesteamen på barnklinikerna kommer inte alltid med i BDD.
Det blev så småningom uppenbart att det förelåg ett kliniskt värde i att få information om antikroppsnivåer, HLA-typer och C-peptidnivå för att barn med nyupptäckt diabetes snabbt skulle få rätt diagnos och behandling. Barnläkarföreningen beslutade därför 2011 att rekommendera barnklinikerna att införa dessa analyser som klinisk rutin (Figur 2). Det ekonomiska ansvaret för att genomföra testningarna kom därmed på de enskilda klinikerna, och samtliga barnkliniker har accepterat denna kostnad för förbättrad diagnostik.
I det amerikanska diabetesförbundets (American Diabetes Association; ADA) rekommendationer står sedan länge att klassifikation av typ 1-diabetes bekräftas med HLA-typning och analys av ö-cellsautoantikroppar [2]. Så vitt vi vet är Sverige det första och, än så länge, enda landet i världen som har omsatt denna rekommendation i praktiken och som på ett systematiskt sätt omsätter nya kunskaper om diabetessjukdomarnas genetiska etiologi och biomarkörer i praktiskt kliniskt arbete.
Typ 1 vanligaste diabetesformen bland svenska barn
Det finns en mängd olika former av diabetes (Fakta 1). Den vanligaste formen bland svenska barn och ungdomar är typ 1-diabetes, som beror på insulinbrist till följd av destruktion av betacellerna i bukspottkörteln. Betacellsdestruktionen pågår ofta under flera år, då autoantikroppar mot olika betacellsantigener kan detekteras innan symtom på insulinbrist uppträder och diagnosen manifest diabetes kan ställas. Sjukdomen går aldrig i långtidsremission med den behandling som är tillgänglig i dag, och behandlingen ställer stora krav på patienten och familjen.
HLA-typer vid typ 1-diabetes
Typ 1-diabetes hör till gruppen HLA-associerade cell- eller organspecifika autoimmuna sjukdomar, som också omfattar celiaki, reumatoid artrit, Hashimotos sjukdom, Addisons sjukdom och flera andra. Dessa sjukdomars genetik är starkt kopplad till de HLA-gener som styr hur immunsystemet reagerar på infektioner. Det är känt sedan 1970-talet att typ 1-diabetes är kopplad till HLA-typerna DR3 och DR4 [3]. Senare analyser har visat att närliggande DQA1*05:01-B1*02:01 (DQ2) respektive DQA1*03:01-B1*03:02 (DQ8) förklarar en större del av risken [4].
En fiktiv familj som har de olika HLA-DQ-haplotyperna DQ2, DQ8 och DQA1*01:02-B1*06:02 (DQ6) (som är en skyddande haplotyp) kan beskriva hur barnen slumpmässigt kan ärva olika risk för typ 1-diabetes. Ett barn som föds med genotypen DQ2/DQ8 har den högsta risken att tidigt utveckla autoimmunitet mot pankreasöarnas betaceller och i ung ålder få typ 1-diabetes [5, 6]. Ett barn som bär på DQ6 i kombination med DQ2 eller DQ8 kommer sannolikt inte att få diabetes före 12–13 års ålder men kanske senare i livet, eftersom den skyddande effekten avtar med stigande ålder [6].
Gener i HLA-regionen på kromosom 6 är kopplade till autoimmuniteten riktad mot betacellerna och inte till själva insjuknandet i diabetes.
Autoantikroppar vid typ 1-diabetes
Vid typ 1-diabetes förekommer autoantikroppar mot insulin (IAA), mot antigen i betacellerna (islet antigen A [IA-2A]) och mot glutamatdekarboxylas (GAD65A) och zinktransportör 8 (ZnT8A). Autoantikroppar mot insulin som ses hos barn, ofta redan vid 1–3 års ålder, är starkt kopplade till HLA-DR4-DQ8, medan autoantikroppar mot GAD65A är kopplade till DR3-DQ2 [7]. Autoantikroppar mot IA-2A är sällan primära utan kommer oftare efter GAD65A och insulinautoantikroppar och är associerade med att diabetesdiagnos kan ställas snabbare. IA-2A-autoantikroppar är kopplade till DR4-DQ8 men intressant nog negativt associerade med DR3-DQ2 [6, 8].
Nya generationens sekvensering kan ge ökad förståelse
En förutsättning för att identifiera nya vägar att förebygga diabetes i framtiden är sannolikt att man i detalj förstår den genetiska bakgrunden till den autoimmuna reaktionen mot betacellerna. Nya generationens sekvensering (NGS) (massiv parallell DNA-sekvensering) eller andra generationens sekvensering (AGS) är tekniker som möjliggör snabb, säker och relativt billig analys av stora mängder DNA.
BDD har nyligen med hjälp av NGS bestämt vilka HLA-DR-alleler som är kopplade till fynd av olika uppsättning av autoantikroppar [9]. HLA-typning med NGS är således ett viktigt steg på vägen mot ökad förståelse av vilka HLA-gener som bidrar till risken för betacellsautoimmunitet och typ 1-diabetes [9].
Typ 1-diabetesgenetik utanför HLA-systemet
Andra gener än HLA bidrar i mindre utsträckning till risken för typ 1-diabetes. I familjer med två eller flera personer med typ 1-diabetes visades DR3-DQ2- och DR4-DQ8-haplotyperna bidra till ca 60 procent av den ärftliga risken [10]. Detta uppfattades som att det borde finnas andra genetiska faktorer som på ett avgörande sätt kunde avgöra risken för typ 1-diabetes.
Omfattande ärftlighetsstudier med helgenomundersökningar (genome-wide association studies; GWAS) av genetiska varianter har genomförts. Ett stort antal (mer än 50) kandidatgener för typ 1-diabetes har rapporterats [10], varav en del också är riskfaktorer för andra autoimmuna sjukdomar [11]. Dessa geners bidrag till risken för typ 1-diabetes är dock begränsad, och informationen är ännu inte kliniskt användbar [2].
Intressant nog finns det också genetiska varianter som ökar risken för uppkomst av betacellsautoantikroppar men inte för diabetes [12]. Autoantikroppar är således snarare en markör för autoimmun aktivitet än en direkt orsak till diabetessjukdom.
Stora skillnader i typ 1-diabetesincidens
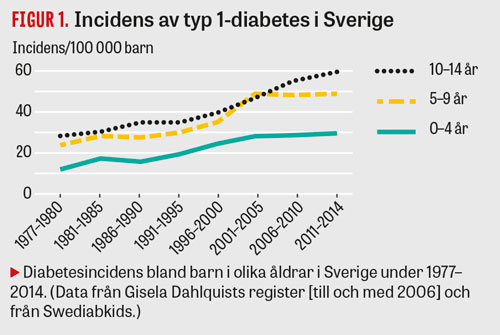
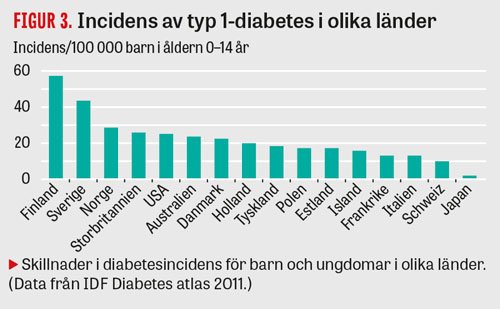
I Sverige är förekomsten av typ 1-diabetes sedan länge hög. Incidensen har ökat under flera decennier med ca 2–3 procent per år, och debutåldern har sjunkit (Figur 1); incidensen av typ 1-diabetes hos barn och ungdomar är dubbelt så hög i dag som för 30 år sedan [13]. Samma trend ses i många andra länder [14], men Finland, följt av Sverige, har fortfarande den högsta typ 1-diabetesincidensen i världen (Figur 3).
Trots intensiv forskning vet vi inte varför incidensen är dubbelt så hög i Sverige som i Tyskland och Polen och fem gånger högre i Finland än i Estland, två länder med genetiskt nästan identisk befolkning [15]. Den snabba ökningen och den uttalade geografiska variationen tyder på att miljöfaktorer spelar en avgörande roll.
I både Sverige [16] och andra länder [17, 18] har det visats att vissa HLA-genotyper som på 1980-talet inte var associerade med risk för typ 1-diabetes nu omkring 30 år senare har förskjutits till att bli riskgenotyper. Denna förändring över tid har sannolikt bidragit till ökningen av typ 1-diabetesincidensen och avspeglar en förändrad interaktion mellan genom och miljö [16].
Redan 1927 föreslogs att ett samband kan finnas mellan virusinfektion och diabetesinsjuknande [19].Något specifikt virus av betydelse har dock inte kunnat påvisas, även om enterovirus och sannolikt även andra virus kan accelerera övergången från subklinisk till manifest diabetessjukdom [20].
I BDD-studien har vi snarare sett motsatsen; H1N1-influensaepidemin och vaccinationen mot H1N1-influensa var associerade med minskat insjuknande i typ 1-diabetes bland de yngsta barnen [21]. Det har även tidigare föreslagits att virusinfektioner kanske kan förlångsamma insjuknandet i typ 1-diabetes [22].
Föreslagna bidragande orsaker som studerats är överdriven hygien, kostfaktorer som tidig introduktion av komjölk och gluten samt vitamin D-brist.
Faktorer som förknippas med insjuknande i typ 2-diabetes som stress, övervikt och minskad fysisk aktivitet leder till ökad insulinresistens och betacellsstress och kan möjligen hos genetiskt predisponerade individer också leda till en autoimmun reaktion och öka risken för typ 1-diabetes [23]. BDD-studien har funnit att övervikt och fetma i kombination med vissa HLA-typer är associerat med ökad risk att utveckla typ 1-diabetes [24].
Ö-amyloidpolypeptid (islet amyloid polypeptide; IAPP) är en peptid med autokrina och parakrina effekter som frisätts tillsammans med insulin från betacellerna i bukspottkörteln. Vi har funnit att vissa barn med typ 1-diabetes kan ha mycket höga cirkulerande nivåer av ö-amyloidpolypeptid (på samma sätt som tidigare visats för typ 2-diabetes) [25], vilket också kan antyda liknande patogenes hos vissa individer med typ 1- och typ 2-diabetes.
Typ 2-diabetes hos barn är en mycket allvarlig sjukdom
Typ 2-diabetes har historiskt varit sällsynt bland barn och ungdomar. I samband med den globala ökningen av barnfetma på 1990-talet började det uppmärksammas att typ 2-diabetes blev allt vanligare bland ungdomar, först i USA men även i många andra länder [26]. Med ökande grad av fetma bland barn i Sverige ökar de diagnostiska svårigheterna, eftersom också barn med fetma kan få typ 1-diabetes. Det finns även exempel på barn i Sverige som behandlats för fetma, där diagnosen typ 1-diabetes blivit allvarligt försenad då diabetessymtom som viktnedgång tolkats som framgångsrik fetmabehandling.
Ärftligheten för typ 2-diabetes är uttalad; det är sällsynt att ungdomar får typ 2-diabetes utan att nära släktingar har typ 2- eller graviditetsdiabetes. Genetiken är dock helt annorlunda än vid typ 1-diabetes: patienter med typ 2-diabetes har samma fördelning av HLA-DQ-haplotyper som bakgrundsbefolkningen [27].
Typ 2-diabetes hos ungdomar och unga vuxna är en mycket allvarlig sjukdom med nästan dubbelt så hög risk för för tidig död som vid typ 1-diabetes och även en högre risk för snabb progress av följdsjukdomar [28, 29]. Behandlingen måste vara kraftfull direkt vid diagnos för ett lyckat resultat hos ungdomar [30]. Studier på både ungdomar och vuxna tyder på att ordentlig viktnedgång (t ex med fetmakirurgi) leder till att typ 2-diabetes i hög utsträckning kan gå i fullständig remission under många år. Detta gäller endast om viktnedgången sker kort tid efter diagnos av typ 2-diabetes, och fler ungdomar än vuxna går i remission efter fetmakirurgi [31, 32].
Sammantaget visar dessa studier att det är angeläget att identifiera individer som insjuknar i typ 2-diabetes så tidigt som möjligt för långsiktigt effektiv behandling. I Sverige är typ 2-diabetes fortfarande ovanlig bland ungdomar, trots att det prediabetiska tillståndet förhöjt fasteglukos (IFG) är 2–3 gånger vanligare i Sverige än i både Tyskland och Polen [33]. Det är möjligt att förhöjt fasteglukos inte har samma prediktiva värde hos ungdomar som hos vuxna [34]. Cirka 95 procent av alla barn som insjuknar i diabetes i Sverige i dag har typ 1-diabetes.
MODY – dominant ärftlig diabetes
Det finns även andra typer av diabetes än typ 1 och typ 2 som drabbar barn. MODY (maturity onset diabetes of the young) är samlingsnamnet för dominant ärftlig diabetes som generellt inte är insulinberoende under barnaåren och som är mycket heterogen avseende behandling och prognos. Prevalensen av MODY i diabetespopulationen är olika i olika länder beroende på dels att prevalensen av typ 1-diabetes varierar kraftigt, dels att förekomst av MODY-mutationer också varierar. I Sverige är prevalensen inte tidigare klarlagd.
Vissa mutationer medför långsamt försämrad insulinproduktion, vilket innebär att sjukdomen successivt förvärras. Dit hör HNF-1-alfa (hepatocyte nuclear factor-4-α) och HNF-4-alfa (äldre benämning på MODY 1 och MODY 3). Under barndomen behandlas de bäst med sulfonylureapreparat och inte med insulin [35].
Glukokinasdefekter (tidigare MODY 2) karakteriseras av förhöjt fasteblodsocker. Bukspottkörtelns betaceller reagerar först på höga glukosnivåer med frisättning av insulin, »glukostermostaten« är inställd på högre glukosvärden, men i övrigt är betacellsfunktionen och glukosregleringen helt normal (Fakta 2). Individer med glukokinasdefekter identifieras accidentellt i alla åldrar och behöver ingen behandling trots att HbA1c kan ligga över de rekommenderade nivåerna vid diabetesbehandling [36]. När dessa patienter diagnostiseras tidigt i barndomen får de ofta, felaktigt, diagnosen typ 1-diabetes. Detta innebär att barnen i onödan behandlas med insulin med allt vad det innebär av komplikationer, oro och onödiga sjukvårdskontroller.
Bland vuxna och ungdomar med många släktingar med diabetes är MODY en differentialdiagnos till typ 2-diabetes. Tidigare kunde patientens vikt användas som diagnostiskt hjälpmedel. Patienter med MODY var normalviktiga, medan patienter med typ 2-diabetes var överviktiga eller led av fetma. I ett samhälle där en stor andel av befolkningen är överviktig eller lider av fetma blir den bilden missvisande, eftersom övervikt naturligtvis inte skyddar mot MODY.
Merparten av patienterna med MODY kan numera diagnostiseras med sekvensering av de gener där förändringar kan ge MODY. Fortfarande finns dock en mindre grupp patienter med MODY där orsaken är okänd.
Ett pågående projekt försöker klarlägga förekomsten av MODY bland barn med diabetes i Sverige och i vilken utsträckning dessa fall blir identifierade som MODY. Över 4 000 barn och ungdomar under 18 år med diagnosen diabetes som deltog i BDD-studien mellan 2005 och 2010 har inkluderats i denna studie. De som inte hade några av autoantikropparna GAD65A, IA-2A, IAA eller ZnT8A, dvs ca 10 procent av barndiabetespopulationen, sekvenserades för de fyra kända MODY-varianterna som har relevans för den här populationen.
Våra preliminära resultat tyder på att 10–20 procent av barnen i BDD-studien som inte har autoantikroppar vid debut har någon variant av MODY, dvs ca 1,5 procent av alla barn som insjuknar i diabetes före 18 års ålder i Sverige. En stor grupp barn som visade sig ha MODY behandlades med insulin helt i onödan. Detta styrker att man bör överväga att sekvensera MODY-generna hos samtliga barn med diabetes där diabetesautoantikroppar saknas och C-peptidnivåer och övrig klinik inte starkt talar för typ 2-diabetes.
Även om det är ovanligt bör det finnas barn med MODY även bland barn med diabetesautoantikroppar, dvs patienter som vi inte identifierar när vi sekvenserar dem som saknar autoantikroppar. Diabetesautoantikroppar finns hos 1–2 procent av den friska populationen [37], och 1–2 procent av barn med både typ 2-diabetes och MODY har också autoantikroppar.
Det bör således finnas enstaka barn med lindrig, välkontrollerad diabetes som felaktigt fått diagnosen typ 1-diabetes men som i stället har MODY eller typ 2-diabetes. På motsvarande sätt finns det också barn med MODY som också fått typ 1-diabetes, eftersom MODY-genetik inte skyddar en individ från risken att utveckla typ 1-diabetes.
För att dessa barn ska få korrekt diagnos och behandling krävs, trots avancerad diagnostik, även i framtiden att barnläkaren är vaksam och reagerar när den kliniska bilden avviker från den förväntade.
Klinisk diagnostik och BDD-studien
Den viktigaste kliniska slutsatsen i BDD-studien är att HLA-typning i kombination med analys av C-peptidnivå och ö-cellsautoantikropparna IA-2A, GAD65A, IAA och ZnT8A gör det möjligt att bättre klassificera sjukdomen efter det att diagnosen diabetes har ställts. I ca 7 procent av fallen kunde den initiala klassificeringen ifrågasättas och utredning riktas mot förekomst av MODY (monogen diabetes), typ 2-diabetes eller sekundär diabetes. Barn som är autoantikroppsnegativa och har höga C-peptidnivåer och HLA-typer som är associerade med låg risk för typ 1-diabetes har hög sannolikhet att ha annan typ av diabetes, t ex MODY eller typ 2-diabetes. Som diskuterats ovan kring MODY är diagnoskriterierna dock inte helt strikta, och 5–10 procent av barn med kliniskt helt säkerställd typ 1-diabetes är autoantikroppsnegativa [38]. BDD har därför skickat ut rekommendationer och diagnosförslag snarare än slutliga diagnoser till klinikerna, som därefter tagit ställning till huruvida t ex sekvensering av de kända MODY-generna ska genomföras.
C-peptidnivå ger kompletterande information utöver HLA och autoantikroppar, inte minst vad gäller förlopp och risk för komplikationer. C-peptidnivån vid insjuknandet är generellt hög hos patienter med typ 2-diabetes, låg vid typ 1-diabetes och inom normalvariationerna vid MODY [39].
Mycket låg C-peptidnivå, och därmed uttalad insulinbrist vid typ 1-diabetes, bidrar till ökad kunskap om vilket behandlingsbehov som föreligger. På samma sätt tyder höga eller mycket höga C-peptidnivåer vid typ 2-diabetes på uttalad insulinresistens. För patienter med övervikt och fetma under puberteten kan typ 1-diabetes bli manifest trots god kvarvarande insulinsekretion på grund av den uttalade insulinresistensen och det därmed höga insulinbehovet. Ofta sjunker C-peptidnivån hos dessa patienter snabbt, särskilt hos flickor [39, 40]. Detekterbara C-peptidnivåer flera år efter diabetesinsjuknandet hos patient med lågt insulinbehov och bra HbA1c-värde kan indikera att patienten inte har typ 1-diabetes.
Kostnaden för analyserna av C-peptidnivå, autoantikroppar och HLA, omkring 1 500 kronor per nyinsjuknad diabetespatient, är rimlig både ekonomiskt och kliniskt eftersom ett antal patienter därmed kan besparas daglig insulinbehandling och frekventa blodsockerkontroller och mottagningsbesök.
Utöver att HLA-typen vägs in när det är oklart vilken typ av diabetes en patient har, påverkar HLA-typen även risken för att celiaki ska utvecklas; 10 procent av alla barn med diabetes utvecklar också celiaki. Har patienten inte HLA-typen DQ2 och/eller DQ8 är risken att utveckla celiaki mycket låg. Detta är en viktig prognostisk information för patienten och reducerar mängden onödiga kontroller.
Även autoantikroppar mot tyreoideaperoxidas och tyreoglobulin (bägge markörer för Hashimotos sjukdom) analyserades i BDD-studien, eftersom risken för tyreoidit är ökad hos patienter med typ 1-diabetes. I Sverige har 6 procent av barn med diabetes också fått behandling med T4 [41]. Prognostiskt viktigt, utöver stegrat TSH, är tyreoideaperoxidas och GAD-autoantikroppar [41].
Bättre diagnostik och ökad kunskap med BDD-studien
BDD-studien har bidragit till förbättrad diagnostik av diabetes hos barn och ungdomar, ökad kunskap om sjukdomarnas förlopp, flera intressanta vetenskapliga resultat och ökat intresse och engagemang för pediatrisk diabetologi i Sverige. Det finns dock mycket som återstår innan vi förstår diabetessjukdomarnas uppkomstmekanismer så väl att vi kan förebygga dem.
Potentiella bindningar eller jävsförhållanden: Åke Lernmark är medlem i rådgivande kommitté vid Diamyd Medical AB, Stockholm. Claude Marcus medverkar i kliniska studier som finansieras av Novo Nordisk; han är dessutom rådgivare åt Oriflame Wellness AB, Itrim AB, McDonald’s Sweden AB och Sigrid Therapeutics AB.
Fakta 1. Olika typer av diabetes
Typ 1-diabetes är autoimmun och den absolut vanligaste diabetesformen bland barn i Sverige. Insulinbehandling krävs alltid.
Typ 2-diabetes orsakas av insulinresistens och oförmåga att kompensera med ökad insulinfrisättning. Typ 2-diabetes är kopplad till övervikt och förekommer inte bland yngre barn. Sjukdomen ska behandlas med viktnedgång, fysisk aktivitet och specifika typ 2-diabetesläkemedel.
LADA (latent autoimmune diabetes of the adult): långsamt utvecklad autoimmun diabetes som därför kan likna typ 2-diabetes; ses ibland hos ungdomar med fetma.
MODY (maturity onset diabetes in young): en dominant ärftlig diabetes vars svårighetsgrad varierar med den genetiska bakgrunden. MODY diagnostiseras i alla åldrar och ska därför alltid finnas med som differentialdiagnos då den inte ska behandlas som typ 1-diabetes.
Diabetes på grund av pankreasskada: alla former av skada på pankreas, cystisk fibros, trauma eller pankreatit kan ge diabetes av insulinbristtyp.
Farmakologiskt inducerad diabetes: behandling främst med höga doser glukokortikoider kan ge en oftast transient diabetes.
MIDD (maternally inherited diabetes and deafness) är en mitokondriell mutation som ger insulinbrist och dövhet. MIDD kan drabba barn, och dövhet kommer oftast före diabetes.
Neonatal diabetes är en heterogen grupp av sjukdomar, ofta orsakade av mutationer vilka avgör prognosen. Cirka 50 procent av fallen är övergående.
Graviditetsdiabetes beror liksom typ 2-diabetes på en oförmåga att öka insulinmängderna vid insulinresistens, vilken uppkommer fysiologiskt under graviditet.
Fakta 2. MODY-typer och påverkan på insulinfrisättning
De flesta kända MODY-mutationer sitter i transkriptionsfaktorer, som på olika sätt påverkar reglering av insulinproduktionen. Glukokinasmutationerna gör att det krävs mer glukos för insulinfrisättning, men den totala förmågan att frisätta insulin påverkas inte.
Glukos som tas in i cellen metaboliseras till ATP. ATP aktiverar depolarisation som ökar kalciuminflödet, vilket leder till insulinfrisättning. Mängden ATP styr således hur mycket insulin som frisätts.