Neutrophil extracellular traps (NET) upptäcktes för drygt ett decennium sedan som en del av vårt medfödda immunförsvar. Genom att utsöndra sitt kärninnehåll i nätlika strukturer bestående av DNA och histoner täckta med antimikrobiella peptider kan neutrofilen fånga in och oskadliggöra invaderande mikroorganismer.
NET är inte bara av godo; okontrollerad NET-bildning kan också vara skadlig. Studier visar att NET spelar en central roll vid flertalet både infektiösa och icke-infektiösa tillstånd – såsom autoimmuna sjukdomar, trombossjukdomar och cancer.
Framtiden får utvisa huruvida markörer för NET kan användas vid diagnostik eller som måltavlor för terapeutiska behandlingar vid olika sjukdomstillstånd.
Neutrofiler har sedan länge betraktats som immunförsvarets infanteri och en första försvarslinje vid hotande infektion. Beväpnade med proteolytiska enzymer, antimikrobiella peptider och förmåga att bilda reaktiva syreradikaler (ROS) patrullerar neutrofiler blodbanan redo för att eliminera inkräktande mikroorganismer. Rekryterade av andra typer av celler och lokalt frisatta cytokiner kan neutrofiler migrera ut i infekterad och skadad vävnad för att fullgöra sin uppgift.
Länge trodde man att vapenarsenalen endast utgjordes av fagocytos (när neutrofilen omsluter och inaktiverar den främmande patogenen) eller degranulering (när neutrofilen utsöndrar antimikrobiella peptider och enzymer som oskadliggör inkräktaren).
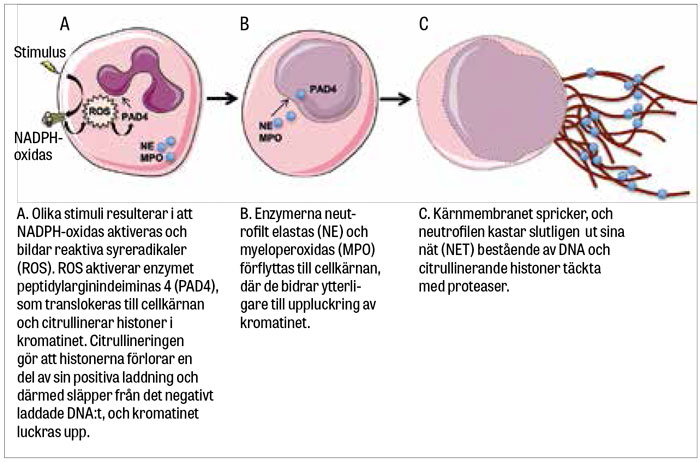
Början på ett paradigmskifte inträdde emellertid för drygt ett decennium sedan i och med beskrivningen av en ny mekanism genom vilken neutrofilen försvarar organismen mot inkräktare [1]. Genom att från cellkärnan frisätta nätliknande strukturer innehållande kromatin (DNA och histoner) täckta med antimikrobiella peptider (Figur 1) – neutrophil extracellular traps (NET) – kunde man visa att neutrofilerna fångade in och oskadliggjorde både grampositiva och gramnegativa bakterier (Figur 2). På detta sätt förhindrar neutrofilerna bakteriespridningen, och eftersom näten innehåller höga koncentrationer av för bakterien toxiska molekyler avdödas inkräktarna lokalt i nätet.
Inte bara bakterier har visats inducera NET. NET frisätts exempelvis i högre grad som svar på stora mikrobstrukturer, som inte enkelt kan fagocyteras, såsom svamphyfer [2].
Betydelsen av NET i bekämpningen av virus är inte lika väl beskriven, men virus kan också inducera NET-bildning [3, 4].
NET utgör dock sannolikt inte bara ett skydd för organismen, utan kan också vara skadligt och involverat i patofysiologin vid en rad olika sjukdomstillstånd [5].
Från kärna till nät
Sedan upptäckten för 15 år sedan har antalet vetenskapliga publikationer inom detta fält ökat kraftigt (en sökning i Pubmed på »neutrophil extracellular traps« ger drygt 2 000 träffar, varav nästan 400 under 2018). Trots denna betydande ökning av studier är det dock fortfarande oklart vad som triggar neutrofilen till NET-bildning och hur denna dramatiska cellulära process egentligen regleras.
I en första studie kunde visas hur isolerade neutrofiler som exponerades för forbol-12-myristat-13-acetat (PMA), lipopolysackarid (LPS) eller interleukin 8 (IL-8) frisatte NET in vitro [1]. Man visade senare hur neutrofilers NADPH-oxidas bildar höga halter av reaktiva syreradikaler [6], vilket katalyserar NET-bildningsprocessen via aktivering av enzymet peptidylarginindeiminas 4 (PAD4), som citrullinerar histoner i cellkärnan [7].
Citrullineringen gör att histonerna förlorar en del av sin positiva laddning och därmed släpper från det negativt laddade DNA:t. Samtidigt förflyttar sig enzymerna neutrofilt elastas (NE) och myeloperoxidas (MPO) till cellkärnan, där de bidrar till ytterligare uppluckring av kromatinet [8]. Cellkärnan formförändras, kärnmembranet spricker och kromatinet frisätts till cytoplasman.
Väl ute ur cellkärnan binder kromatinet till ytterligare proteaser [6], varpå cellmembranet öppnas upp i en programmerad process som skiljer sig från apoptos och nekros [6], och neutrofilen kastar ut sina nät för att fånga och döda inkräktarna (Figur 3).
Genom NET-processen beskrev man således hur neutrofilen begick en sorts biologisk »kamikaze-
attack«, och begreppet suicidal NET-bildning myntades. Detta begrepp modifierades dock några år senare då en forskargrupp [9] visade att vissa neutrofiler också kunde kasta ut sina nät utan varaktig destruktion av cellmembranet, s k vital NET-bildning. På så sätt kunde neutrofilerna leva vidare och fortsatt vara immunologiskt aktiva. Vital NET-bildning har visats vara en process oberoende av reaktiva syreradikaler och betydligt snabbare (minuter) än suicidal NET-bildning (timmar).
Patienter med kronisk granulomatös sjukdom, som karakteriseras av nedsatt funktion av NADPH-oxidas och oförmåga till produktion av reaktiva syreradikaler, har dock visats oförmögna till NET-bildning. Genom genterapi har man lyckats återställa funktionen hos NADPH-oxidas och förmågan till NET-bildning [10], vilket talar för vikten av reaktiva syreradikaler vid bildning av NET.
Man har också sett att neutrofiler kan frisätta nät med mitokondriellt DNA [11] och att andra immunceller såsom makrofager, basofiler och eosinofiler också bildar extracellulära nät [12]. Mycket är fortfarande oklart kring dessa olika processer, och pågående forskning försöker belysa bakomliggande mekanismer mer i detalj.
För mycket av det goda
Forskningen kring neutrofilernas sofistikerade försvarsstrategi mot inkräktande mikroorganismer gav snabbt insikten att näten inte bara försvarar organismen mot inkräktare, utan att NET-bildning också kan skada organismen. Nätstrukturen lokaliserar de höga koncentrationerna av potentiellt skadliga kroppsegna molekyler som finns i NET, men okontrollerad bildning och/eller otillräcklig nedbrytning av näten kan skada organismen och t ex bidra till endotelskada [13] och trombosbildning [14].
NET som patofysiologisk mekanism har på senare tid kunnat kopplas till en rad icke-infektiösa tillstånd utöver trombos, såsom autoimmuna sjukdomar [15] och cancer [16].
Hur näten elimineras i kroppen är ännu inte klarlagt, men tidiga in vitro-studier visade att endogent deoxiribonukleas kan bryta ner nätens ryggrad, DNA [1]. Likaså har man kunnat visa att heparin – som genom sin negativa laddning har hög affinitet för de positivt laddade histonerna – demonterar näten [14].
Kanske central roll vid autoimmuna sjukdomar
Autoimmuna sjukdomar kännetecknas av ett överdrivet inflammatoriskt svar med produktion av autoantikroppar mot kroppsegna strukturer. Vissa studier talar för att molekylära strukturer i NET kan utgöra autoantigener och därmed spela en central roll i uppkomsten av autoimmuna sjukdomar såsom systemisk lupus erythematosus (SLE), reumatoid artrit och småkärlsvaskulit [17].
Neutrofiler isolerade från patienter med autoimmuna sjukdomar har visats ha ökad benägenhet för NET-bildning in vitro [18], och systemisk exponering för näten och dess komponenter har föreslagits vara en utlösande faktor för aktivering av immunsystemet [19]. Vid SLE förekommer en överproduktion av antikroppar mot kärnantigen (ANA) och anti-DNA-antikroppar, men också antikroppar mot myeloperoxidas och neutrofilt elastas, alla centrala beståndsdelar i neutrofilernas nät.
Näten stimulerar till antikroppsbildning, och det förstärkta immunsvaret och immunkomplexen som bildas kan leda till fortsatt NET-bildning och uppkomst av en ond cirkel. Det har också rapporterats att det vid SLE föreligger begränsad förmåga att bryta ner näten, eftersom de är täckta med autoantikroppar och därmed inte är åtkomliga för nedbrytande enzymer som deoxiribonukleas [20]. SLE-patienter kan dessutom ha höga nivåer av endogena hämmare av deoxiribonukleas, vilket har visats korrelera med klinisk sjukdomsmanifestation [21].
Cirkulerande antikroppar mot citrullinerade proteiner är starkt kopplade till reumatoid artrit. Citrullineringen kräver aktivering av PAD-enzym, vilket (som nämnts ovan) spelar en central intracellulär roll vid NET-bildning. Neutrofilernas PAD-enzym frisätts extracellulärt i samband med NET-bildning och anses kunna bidra även till extracellulär citrullinering, vilket kan ses vid reumatoid artrit [22]. Neutrofilderiverade nät kan också påvisas i synovialvävnad från patienter med reumatoid artrit, och dess förekomst korrelerar även här med sjukdomsaktivitet, grad av systemisk inflammation och förekomst av antikroppar mot citrullinerade proteiner [23].
På liknande sätt tror man att minskad nedbrytning av NET kan spela roll vid ANCA (antineutrofila cytoplasmaantikroppar)-associerad småkärlsvaskulit [24, 25] där man ser autoantikroppar mot myeloperoxidas och myeloblastin (PR3), proteiner som frisätts vid NET-bildning. Vid SLE har man visat att Libman–Sacks endokardit, som vanligen är starkt associerad med förekomst av fosfolipidantikroppar, kan vara kopplad till NET-bildning [19]. Man har vidare påvisat NET i glomeruli vid histopatologiska undersökningar av njurbiopsier från patienter med småkärlsvaskulit, och förekomsten har korrelerat till sjukdomsgraden [24].
Kan bidra till trombotiska tillstånd
2013 myntades begreppet immuntrombos [26] när man visade hur immunsystemet interagerar med koagulationssystemet i syfte att begränsa infektionstillstånd. Studier har belyst hur neutrofilerna, som dominerar tidigt vid aktivering av det medfödda immunförsvaret, och NET spelar en avgörande roll i detta samspel. Genom att bilda NET och intravaskulära mikrotromboser i vitala organ [27] fångar neutrofilerna in och eliminerar bakterierna, vilket förhindrar infektionens spridning.
Den protektiva effekten till trots kan dock kärlocklusion och immuntrombosbaserad NET-bildning få förödande konsekvenser och medverka i utveckling av sepsisassocierad disseminerad intravasal koagulation (DIC), en välkänd och svår klinisk komplikation vid sepsis.
Ytterligare studier har belyst flera av nätens protrombotiska egenskaper. Näten är klibbiga och bildar stora aggregat. Därigenom kan de ockludera små kärl [27] men också stabilisera fibrinbildningen och fibrinnätverket och därmed försvåra fibrinolysen – kroppens förmåga att lösa upp tromber [28].
Av betydelse är också att neutrofilernas nät binder både trombocyter och röda blodkroppar [14] och andra protrombotiska faktorer såsom von Willebrand-faktorn [14], mikropartiklar [29] och vävnadsfaktor (tissue factor) [30]. De negativt laddade ytorna på nätens DNA aktiverar koagulationskaskaden via faktor XII [31], och histonerna aktiverar trombocyter [32], som i sin tur ytterligare förstärker NET-bildningen hos närliggande neutrofiler. Proteolytiska enzymer i nätverken förstärker trombosprocessen genom att klyva och inaktivera endogena antikoagulerande faktorer såsom »tissue factor pathway inhibitor« (TFPI) [33].
Kraftig neutrofilaktivering med otyglad NET-bildning har, förutom vid mikrotrombotisering i samband med sepsis, även kunnat påvisas vid icke-infektiösa tillstånd [34].
Ett starkt bevis för betydelsen av NET vid venös tromboembolism kom 2010 när markörer för NET påvisades i såväl plasma som tromber hos babianer med djupa ventromboser [14]. Behandling med deoxiribonukleas och heparin bröt ned näten och förhindrade trombbildning.
NET har sedan dess visats bidra även till arteriell trombos, t ex vid ischemisk stroke [35] och vid akut hjärtinfarkt [30, 36], tillstånd där man också sett att mängden nät i tromberna samvarierat med infarktstorlek.
Till skillnad från systemisk inflammation och svårare infektionstillstånd, där näten bildas i blodbanan och sedan kan ge upphov till disseminerad trombotisering av små kärl, bildas näten vid kardiovaskulär sjukdom troligtvis lokalt i och omkring tromben som en konsekvens av lokal kärlskada, trombotiseringsprocessen, hypoxi och lokal inflammation. Det finns dock mycket som fortfarande är oklart kring NET vid arteriell trombos, och ytterligare studier krävs inom området.
Ny möjlig mekanism vid cancerassocierad trombos
Trombos är en allvarlig och relativt vanlig komplikation vid cancer [37]. Eftersom inflammation är en nyckelkomponent vid cancer [38], och neutrofilernas nät visats vara starkt protrombotiska, har hypotesen uppkommit att NET kan bidra till cancerassocierad trombos. Den första studien publicerades 2012 [39], där det visades att neutrofiler bildade höga nivåer av NET i blodbanan vid kronisk myeloisk leukemi, lungcancer och bröstcancer och att dessa nät kunde återfinnas i tromber i lungans kärl. Man föreslog att den förändrade systemiska miljön som kan ses vid cancer lurar neutrofilerna till NET-bildning, och en ny möjlig mekanism bakom cancerassocierad trombos var därmed postulerad.
Systemisk induktion av NET vid cancer bekräftades kort därefter, när man visade att neutrofiler från friska individer bildade nät vid inkubation i plasma från cancerpatienter men inte i plasma från friska individer [40].
Vilka plasmaderiverade faktorer som stimulerar neutrofiler till NET-bildning vid cancer är ännu inte klarlagt, men studier talar för att tumörderiverade och cirkulerande cytokiner såsom granylocytkolonistimulerande faktor (G-CSF) [39, 41] och IL-8 [40] samt den hypoxiska intratumorala miljön [42] kan spela roll. Flera studier har undersökt kopplingen mellan cancer, NET och trombos.
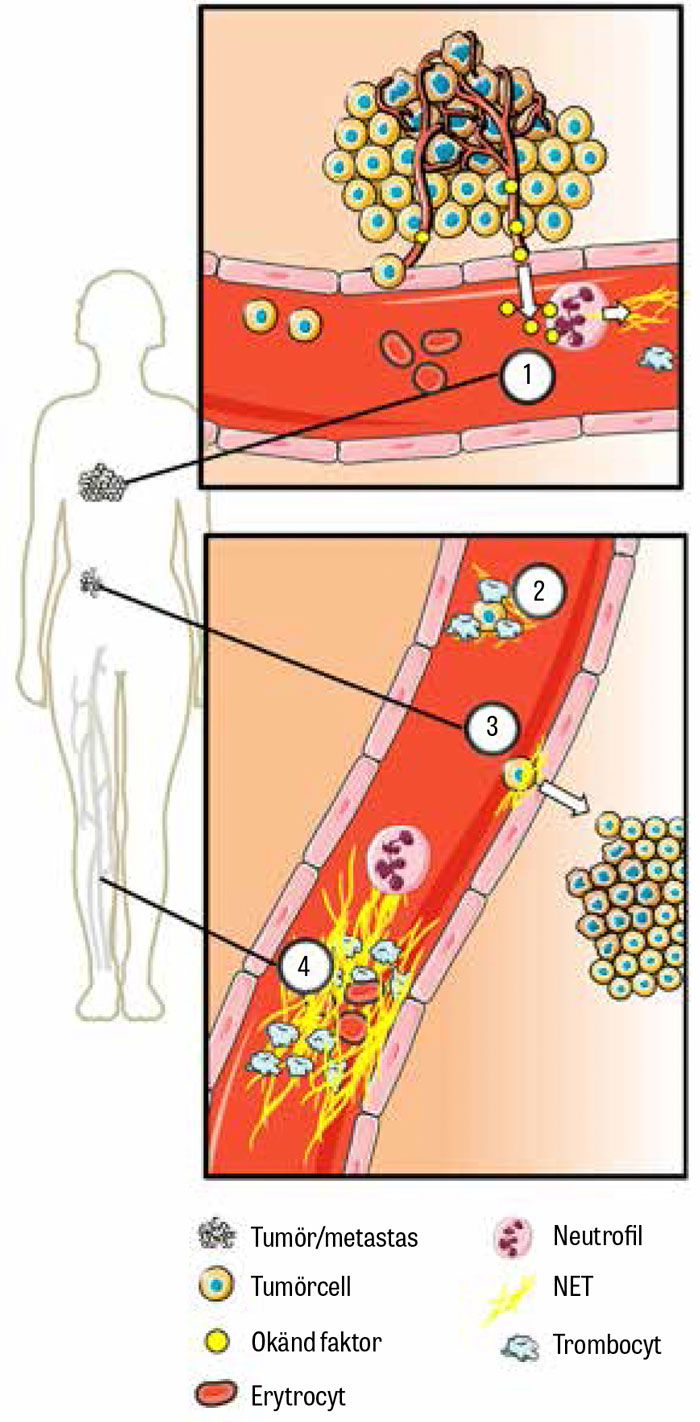
Vi har i en av våra studier kunnat visa höga nivåer av NET i blodet hos strokepatienter med bakomliggande cancer [43], och näten återfanns också i tromber i flera organ. En annan svensk forskargrupp visade samtidigt i musmodeller att näten ansamlades i blodkärl perifert från tumören och bidrog till nedsatt perfusion och organsvikt hos drabbade organ [41]. Notabelt var att detta kunde reverseras genom eliminering av näten med tillfört deoxiribonukleas.
Några år senare kunde samma forskargrupp i ytterligare djurförsök visa att också PAD4-hämmare förhindrade organskadan genom att hämma neutrofilernas förmåga till NET-bildning [44].
Parallellt med fynden att NET påverkade cancerassocierad trombos observerades att näten också kunde bidra till tumörväxt och metastasering. Redan 2013 publicerades bilder av NET i tumörer vid Ewings sarkom [45], och mängden av påvisade nät korrelerade till metastasering av tumören.
Samma år publicerades också data som visade att näten kunde fånga cancerceller på samma sätt som de fångade bakterier och på så sätt omsluta och skydda cancercellerna mot att upptäckas av immunförsvaret [46]. Man visade att infångandet av cancerceller var associerat till metastasering både in vitro och in vivo, och man lyckades i musmodeller förhindra metastasering genom att eliminera näten med deoxiribonukleas.
Under 2016 publicerades en studie [47] som visade att näten omringade metastaserande cancerceller och stimulerade till invasion och migration av bröstcancerceller in vitro. Behandling med nanopartiklar täckta med deoxiribonukleas reducerade markant metastasering till lungor i musmodeller. Nyligen visades också att NET kan väcka slumrande cancerceller som kan finnas i syre- och näringsfattiga delar av solida tumörer [48].
Nivån av citrullinerad histon H3 (H3Cit), som anses vara en NET-specifik markör eftersom den bildas specifikt under NET-processen [49], har vidare visats vara förhöjd i plasma hos patienter med avancerad cancer [50]. Höga cirkulerande nivåer korrelerade till sämre överlevnad, vilket skulle kunna spegla dels metastaseringsprocessen, dels multiorgansvikt beroende på mikrotrombotisering och/eller endotelskada.
Huruvida näten också i viss mån kan skada cancerceller via sin arsenal av toxiska substanser är ännu oklart, men allt fler studier ger alltså stöd för en betydelse av NET vid tumörprogression, metastasering och cancerassocierad trombos (Figur 4).
En smula skepsis blandad med framtidstro
Som vid alla nya upptäckter genomsyras den tidiga NET-forskningen av övertro och barnsjukdomar, och entusiasmen över neutrofilernas nät vid en rad sjukdomstillstånd har ibland lett till övertolkning av fynden [51]. Histopatologiska undersökningar av NET är svåra, eftersom fixering med olika kemiska substanser kan ge morfologiska förändringar hos neutrofilerna liknande dem som ses vid NET-bildning [52]. Likaså kan det vara svårt att skilja på fibrinnätverk (vilka också bryts ner av deoxiribonukleas) och NET vid elektronmikroskopiska undersökningar [53].
Nämnas bör också att en del studier som har isolerat neutrofiler vid olika sjukdomstillstånd framkallat NET-bildning in vitro med hjälp av icke-fysiologiska stimulus (t ex forbol-12-myristat-13-acetat) och sedan dragit den tvivelaktiga slutsatsen att den aktuella sjukdomen är associerad till NET-bildning. De patofysiologiska studierna har nästan uteslutande utförts på möss, och eftersom det finns relativt stora immunologiska skillnader mellan mus och människa [54] ska dessa studier självfallet tolkas med försiktighet.
Slutligen bör också vad som benämns vara cirkulerande NET-markörer ifrågasättas. Många studier påvisar cellfritt DNA, myeloperoxidas och neutrofilt elastas i blodet och beskriver detta som patognomont för NET. Dessa markörer återfinns dock i förhöjda nivåer i blodet vid en rad sjukdomstillstånd, inte minst vid autoimmuna sjukdomar, oberoende av NET-bildning. Citrullinerad histon H3 betraktas, som nämnts ovan, som en NET-specifik markör eftersom histonernas citrullinering är det inledande och avgörande steget i NET-bildning [49]. Enzymet peptidylarginindeiminas 4, som citrullinerar H3, förekommer visserligen primärt i neutrofiler, men det är viktigt att påpeka att detta enzym också finns uppreglerat i vissa cancerceller [55], och cirkulerande H3Cit skulle därför även kunna komma direkt från tumörceller.
Sammanfattningsvis fortsätter forskningsfältet kring NET att expandera, och i takt med optimering av metoder som kan detektera och mäta förekomsten av neutrofilernas nät kommer vi säkerligen att få bättre förståelse för deras kliniska relevans. Potentiella farmakologiska NET-hämmare och behandlingsmöjligheter att avlägsna näten och minimera deras skador ligger också i forskningens framtid.
Huruvida NET-markörer kan komma att användas i diagnostik, vid prognostisering eller som nya måltavlor för behandling vid vissa sjukdomstillstånd får framtiden utvisa.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.






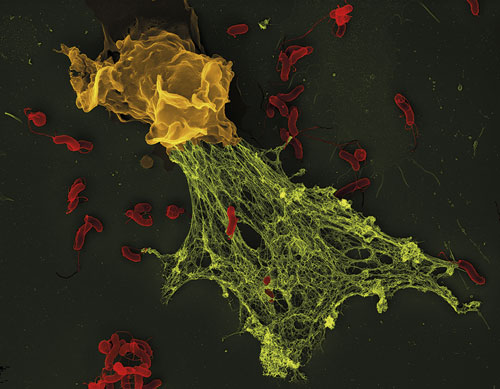
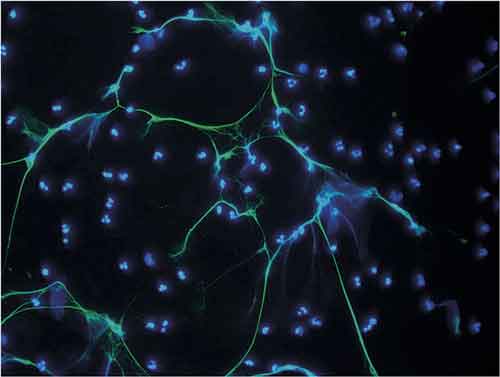
![Figur 2. Neutrofilers nät fångar in och oskadliggör bakterier, såväl grampositiva (Staphylococcus aureus [till vänster]) som gramnegativa (Salmonella typhimurium [i mitten] och Shigella flexneri [till höger]). Från: Brinkmann, et al [1], med tillstånd från Association for the Advancement of Science.](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3S/%5bFI3S%5d/2018-264_2_webb.jpg)