Hos många patienter med pacemaker eller intern kardiell defibrillator ses förmakstakykardi (atrial high rate episodes; AHRE) utan kliniskt förmaksflimmer.
Förmakstakykardi med duration ≥5 minuter medför ökad risk för ischemisk stroke.
Det finns inget tydligt tidsmässigt samband mellan förekomst av förmakstakykardi och ischemisk stroke.
Flera pågående studier utvärderar antikoagulantiabehandling vid förmakstakykardi.
European Heart Rhythm Association (EHRA) rekommenderar antikoagulantia vid förmakstakykardi ≥5,5 timmar/dygn och CHA2DS2-VASc ≥2 poäng (≥3 för kvinnor). Antikoagulantia kan övervägas även vid CHA2DS2-VASc 1 poäng (2 för kvinnor). Vid fler riskfaktorer kan antikoagulantia övervägas även vid kortare duration.
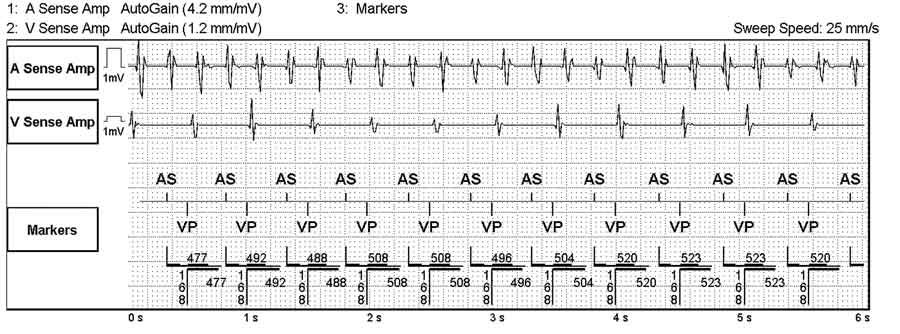
Figur 1. Pacemakeravläsning: Förmaksarytmi med frekvens 240 slag/minut.
Trots utveckling av diagnostik och behandling bidrar förmaksflimmer fortfarande till omfattande sjuklighet och dödlighet. Associationen till en femfaldigt ökad risk för ischemisk stroke, ofta medierad genom embolier, med ödesdigra konsekvenser för den enskilde och betydande samhällskostnader, är avgörande [1-4]. Dessbättre finns numera effektiv behandling med antikoagulantia [3], något som allt fler patienter får tillgång till, även om det fortfarande föreligger underbehandling [3, 5].
En särskild utmaning utgörs av »tysta flimmer« där patienten saknar rapporterade symtom. Ibland hittas de i samband med vårdkontakt av annan orsak, men ofta konstateras de först i samband med stroke eller hjärtsvikt [6]. Patienter utrustade med pacemaker eller intern kardiell defibrillator (ICD) har möjlighet till rytmövervakning, med följd att även tysta flimmer påvisas. Handläggningen skiljer sig inte från tidigare riktlinjer om det rör sig om ett vanligt, kliniskt asymtomatiskt förmaksflimmer (paroxysmalt, persisterande eller permanent men ofta ihållande flera timmar och möjligt att detektera med 12-avlednings-EKG) [3].
Det som däremot har varit kontroversiellt är med kardiell elektronisk apparat (device) detekterade kortvariga asymtomatiska förmaksarytmier som benämns AHRE (atrial high rate episodes) eller SCAF (subclinical atrial fibrillation) (Fakta 1), vanligen i frånvaro av kliniskt förmaksflimmer diagnostiserat med 12-avlednings-EKG eller ambulatoriskt EKG (Holter-EKG) [3, 6, 7]. AHRE/SCAF är associerat med ökad risk för såväl kliniskt förmaksflimmer som ischemisk stroke/systemisk embolism. Dock tycks risken för stroke vara lägre än vid kliniskt förmaksflimmer, och det är ännu inte klarlagt huruvida behandling med antikoagulantia förbättrar prognosen [6, 8-10]. Förhoppningar finns om att pågående studier ska kunna besvara frågan om antikoagulantias roll [11-13].
I nu gällande riktlinjer behandlas AHRE/SCAF kortfattat [3], och vårt intryck är att praxis i Sverige varierar mellan både kliniker och behandlande läkare. Under 2017 publicerade European Heart Rhythm Association (EHRA) ett konsensusdokument om hantering av AHRE/SCAF [6].
Rapporterad prevalens är 30–60 procent
Rapporterad incidens av apparatdetekterad kortvarig förmakstakykardi bland patienter med pacemaker eller ICD varierar med studiedesign, underliggande hjärtsjukdomar, inkluderade patienter med tidigare förmaksflimmer och observationstid. Sammantaget tycks incidensen vara ca 20 procent efter 12 månaders observation av patienter med pacemaker eller ICD utan tidigare känt förmaksflimmer [6].
Prevalensen har rapporterats vara 30–60 procent. Studier som designats särskilt för att exkludera patienter som kan ha haft förmaksflimmer tidigare (känt förmaksflimmer, antikoagulantia, antiarytmika) har funnit en prevalens på ca 30 procent i kohorter av patienter med pacemaker eller ICD [9, 10]. Denna prevalens kan inte med självklarhet översättas till en allmän population; sjuk sinusknuta och ventrikulär stimulering är associerade med högre prevalens av förmaksflimmer [14].
Förmakstakykardin oftast asymtomatisk
Patienter med pacemaker eller ICD lämpar sig genom rytmövervakningen väl för jämförelser av upplevda och faktiska arytmier. Hur förmaksarytmi upplevs är varierande, inte minst beträffande förmågan att alls känna av pågående arytmi [6]. I en studie av 89 pacemakerpatienter med sjuk sinusknuta och tidigare känt paroxysmalt förmaksflimmer jämfördes antalet apparatdetekterade flimmerepisoder (>30 sekunder) med patienternas upplevda symtom [15]. Av de 1 141 tillfällen då patienterna rapporterat symtom fanns förmaksflimmer registrerat enbart i 21 procent av fallen. Av de episoder som registrerats var 81 procent asymtomatiska.
I en annan studie av 48 patienter med paroxysmalt förmaksflimmer och pacemaker rapporterade varje patient i medel 25 förmaksflimmerepisoder under 1 år, men i genomsnitt överensstämde bara en av dessa episoder med en registrerad arytmi. Av samtliga registrerade arytmier var endast 4 procent symtomgivande [16].
En studie jämförde traditionell uppföljning med vilo-EKG med avläsning av apparaten hos patienter med förmaksflimmer. Vid EKG-uppföljning hade 44 procent recidiverat i förmaksflimmer, medan 88 procent hade recidiverat vid apparatavläsning under studieperioden. Av dem med flimmerduration över 48 timmar var 38 procent helt symtomfria med sinusrytm vid uppföljningen [17].
Att använda enbart symtom som underlag för utvärdering av interventioner eller inför ställningstagande till antikoagulation är inte tillräckligt. Med den evidens som finns i dagsläget bör asymtomatiska förmaksflimmer inte behandlas annorlunda än symtomatiska när det kommer till antikoagulation [6, 18, 19].
Snabba förmakstakykardier och risken för stroke
I EHRA:s konsensusdokument framhålls sju studier av större betydelse avseende tromboemboliska risker associerade med apparatdetekterad förmakstakykardi [6-8, 20-24]. I de första fyra studierna exkluderades dock inte patienter med tidigare förmaksflimmer i anamnesen. En knäckfråga har varit att försöka definiera den minsta duration av förmakstakykardi som är associerad med ökad tromboembolisk risk. Av olika skäl, ibland med hänsyn till statistisk metod, har de tidsgränser för duration som valts varierat mellan olika studier, vilket gör att osäkerhet i dag kvarstår om det finns någon minsta duration som är tromboemboliskt riskfri.
I de mindre studierna nämnda ovan visade sig 5 minuter respektive 24 timmar av förmakstakykardi vara en oberoende prediktor för död eller tromboembolism (hazardkvot 2,8; 95 procents konfidensintervall [95KI] 1,51–5,15 respektive 3,0; 95KI 1,1–10,5) [8, 20].
I den större (n = 2 486) prospektiva studien TRENDS, där patienterna hade måttliga riskfaktorer för stroke (CHA2DS2 i genomsnitt 2,2 poäng), visade det sig att gränsvärdet >5,5 timmars duration var associerat med fördubblad tromboembolisk risk [22]. Studien visade oväntad låg förekomst av tromboembolism jämfört med vad man kunde förvänta sig hos en jämförbar grupp med samma riskfaktorer och kliniskt förmaksflimmer. Att antalet fall av ischemisk stroke var så lågt gjorde det svårt att extrapolera utifrån studien (hazardkvot 2,2; 95KI 0,96–5,05).
I en studie med hemmonitorering (n = 560) medförde >3,8 timmars duration av förmakstakykardi en 9-faldig riskökning för tromboembolism [23]. Författarna betonar det tidigare problemet med att det låga totala antalet tromboemboliska händelser gör det svårt att slå fast en användbar gräns för duration. De gör en metaanalys baserad på sina egna patienter och publicerade kohorter och visar att bland totalt 4 651 patienter med uppföljning under en mediantid på 18 månader förekom 51 tromboemboliska händelser (1,1 procent).
I studien ASSERT (n = 2 580) ingick patienter >65 år med hypertoni och utan förmaksflimmer i anamnesen. Under 3 månader monitorerades patienterna, och 10 procent hade någon gång förmakstakykardi med duration >6 minuter. Patienterna följdes sedan under 2,5 år, och man fann att förmakstakykardi var förenad med en 2,5-faldigt ökad risk för ischemisk stroke eller tromboembolism och en 5-faldigt ökad risk för kliniskt förmaksflimmer [7]. I en metaanalys (n = 10 016) av 5 studier var ett gränsvärde för förmakstakykardi >1 timme förenat med fördubblad risk för ischemisk stroke [24]. Även i dessa två studier konstaterades att strokerisken var lägre än förväntat mot bakgrund av CHA2DS2-riskfaktorerna (strokeincidens 0,72 respektive 0,39 årligen) [7, 24].
Sammanfattningsvis finns nu ett växande underlag som visar en tydlig association mellan apparatdetekterad förmakstakykardi och risk för stroke. En kliniskt viktig fråga är om det går att definiera en minsta arytmibörda, en brytpunkt, där risken blir kliniskt signifikant. Den första studien på området tydde på att enbart 5 minuters förmakstakykardi var tillräcklig för ökad strokerisk. Efterföljande studier har dock använt olika brytpunkter, allt från 5 minuter till 24 timmar. Eftersom ingen gemensam tidsgräns studerats mer ingående, råder fortsatt osäkerhet om vilken som är den minimala flimmerdurationen för att ge ökad tromboembolisk risk.
Inga tydliga tidsmässiga samband
I en subgruppsanalys av TRENDS-studien (n = 40) visades att endast 50 procent av de strokedrabbade patienterna hade förmaksflimmer före strokeinsjuknandet, och av dessa hade 45 procent inget registrerat förmaksflimmer de 30 dagarna närmast före stroke [25]. För 27 procent av patienterna förekom arytmin under de 30 dagarna närmast före stroke, vilket fick författarna att just här misstänka ett kausalt samband. För det stora flertalet patienter med pacemaker eller ICD, i detta fall 73 procent, menar författarna att man får söka andra orsaker till stroke än själva arytmin i sig och exemplifierar med vaskulära riskfaktorer, arteriell plackruptur och abnormala förändringar i förmakets extracellulära matrix samt andra strokemekanismer utöver embolism.
En liknande subgruppsanalys på de 51 patienter som drabbades av stroke i ASSERT-studien pekar i samma riktning: 92 procent av patienterna hade inte förmaksflimmer/apparatdetekterad förmakstakykardi de 30 dagarna närmast före strokeinsjuknandet. 27 procent av patienterna hade förmaksflimmer/asymtomatisk förmaksarytmi före strokeinsjuknandet, men >30 dagar före, och medianvärdet för patienternas tidsmässigt närmaste episod var 339 dagar före [26]. För de allra flesta med förmaksflimmer före strokeinsjuknande var durationen under de 48 timmar som många uppfattar som minimitiden för att en tromb ska hinna bildas i vänster förmaksöra. Slutligen hade 16 procent förmakstakykardi först efter strokeinsjuknandet, trots att kontinuerlig monitorering föregick stroketillfället med i genomsnitt 228 dagar.
Trots de tydliga sambanden mellan apparatdetekterad förmakstakykardi och risken för stroke tycks det inte finnas några tydliga tidsmässiga samband mellan arytmin och strokeinsjuknandet. Resultaten hittills får tolkas som att man för majoriteten av pacemaker- och ICD-patienterna med apparatdetekterad förmakstakykardi och tromboembolism får söka andra mekanismer för stroke än själva arytmin.
Patofysiologi och trombogenes – tolkning av resultaten
Det finns således evidens för att apparatdetekterade episoder av förmakstakykardi medför ökad risk för stroke. Dock är incidensen av stroke vid förmakstakykardi anmärkningsvärt låg jämfört med vad som tidigare visats vid kliniskt förmaksflimmer. De subgruppsanalyser som visade att tidsmässiga samband mellan förmakstakykardi och strokeinsjuknande till största del saknas har väckt uppseende: dels för att så få patienter uppvisat flimmerepisoder månaden före strokeinsjuknandet, dels för att durationen nästan alltid understigit de 48 timmar som många tidigare uppfattat (visserligen utan stark evidens) som minimiduration för trombbildning [14, 27]. Att så korta episoder som 6 minuter varit tillräckliga för att ge tydligt ökad risk för stroke månader och ibland år framöver är också anmärkningsvärt.
Fynden har bidragit till en omvärdering av de mekanismer som tros leda till embolism vid förmaksflimmer [14, 26]. Det är inte troligt att en enda mekanism förklarar strokeinsjuknandet hos alla patienter, utan troligen finns flera olika etiologier och ofta multifaktoriell genes. Att det ofta förflutit så lång tid mellan förmakstakykardin och strokeinsjuknandet får tolkas som att det antingen sker en fördröjning av trombotisering och embolisering, alternativt att stroke hos patienter med pacemaker eller ICD kan involvera andra mekanismer än embolisering till följd av själva arytmin [14]. Ett flertal tänkbara mekanismer har föreslagits.
Det finns fall där stroke inträffar relativt kort tid efter förmakstakykardin där en direkt kausalitet definitivt kan misstänkas: en längre takykardiepisod eller en serie av takykardiepisoder ger påverkad hemodynamik i förmaken med ökad risk för systemisk embolism i nära anslutning till arytmin [28].
För de många fall där längre tid förflutit före strokeinsjuknandet är det tänkbart att återkommande episoder av förmakstakykardi triggat kroniska förändringar i förmaksstrukturen, vilka i sin tur orsakar tromboembolism. Förmaksflimmer har associerats till endoteldysfunktion [29], inflammation [30], spontan ekokardiografisk kontrast i vänster förmak [31] och protrombotisk aktivitet [32, 33], som jämte förändringar i kärlvägg, remodellering av extracellulärt matrix och förändringar i blodets sammansättning kan bidra till ett hypertrombotiskt tillstånd [14, 26, 32]. Dessa förändringar kan vara antingen övergående eller kroniska och då trombogena långt efter en inträffad episod av förmakstakykardi.
Det har påvisats att grad av fibros i vänster förmak uppmätt med magnetresonanstomografi korrelerar med strokerisk hos patienter med förmaksflimmer; denna förmakspatologi skulle kunna utgöra en gemensam mekanism bakom både arytmi och tromboembolism [34]. Även frekventa supraventrikulära extraslag har kopplats till ökad risk för stroke [35]. Det är möjligt att förmakstakykardi inte utlöser dessa kroniska förändringar, utan enbart speglar en pågående process och således är en markör för embolisk risk, utan direkt kausal påverkan [25, 26].
Hos patienter som konverterats till sinusrytm har tidigare noterats ett övergående fenomen med frånvaro av mekaniska förmakskontraktioner (generell kontraktilitetsnedsättning, »stunning«) under upp till flera dagar, något som även nämnts som en möjlig mekanism efter förmakstakykardi [12]. Detta har dock tidigare främst noterats efter långtstående persisterande förmaksflimmer. Ofta förflyter >1 månad mellan episod av förmakstakykardi och strokeinsjuknande, vilket vida överstiger normal tid för detta fenomen [26].
Slutligen får man vara öppen för andra förklaringar till stroke vid förmakstakykardi än tromboembolisk genes, t ex hypertonirelaterade lakunära infarkter eller arteriella plackrupturer, där förmaksarytmin främst får betraktas som en riskmarkör [14, 25]. I de aktuella studierna hade många patienter ett flertal riskfaktorer för stroke som även utan förmakstakykardin kunde förklara ischemisk stroke. För patienter med hög CHA2DS2-VASc-poäng är incidensen av såväl ischemisk stroke som tromboembolism hög och mortaliteten ungefär densamma med eller utan förmaksflimmerdiagnos [6].
Implikationer för klinisk praxis
Den fråga som inga riktlinjer ännu kan besvara med säkerhet rör eventuell nytta av antikoagulantiabehandling av apparatdetekterad förmakstakykardi hos patienter utan kliniskt förmaksflimmer. Ingen studie av denna grupp har ännu publicerats, och alla studier som visat på fördelar med antikoagulantiabehandling vid förmaksflimmer har rört kliniskt förmaksflimmer.
Samtidigt som man inte funnit någon tydlig skillnad i risk för stroke mellan paroxysmala och permanenta förmaksflimmer [36] har studier på patienter med förmakstakykardi hittills indikerat en tydligt lägre incidens av stroke än resultaten vid kliniska förmaksflimmer [10, 22], vilket kan tolkas som att grupperna inte är jämförbara.
EHRA rekommenderar antikoagulantia till patienter med CHA2DS2-VASc-poäng 2 eller mer (≥3 för kvinnor) om asymtomatisk förmaksarytmi samtidigt registrerats ≥5,5 timmar per dygn. Vidare kan behandling övervägas även vid CHA2DS2-VASc 1 poäng (≥2 för kvinnor). För patienter med många riskfaktorer kan man överväga antikoagulantia även vid kortare duration än 5,5 timmar [6].
Rekommendationerna från EHRA utgör en rimlig avvägning i nuläget för svenska förhållanden. Det som är oklart är inte risken för stroke, utan vad som är effektiv behandling. Nackdelen med att ge alla med förmakstakykardi antikoagulantia skulle vara att utsätta en del patienter för onödig blödningsrisk, trots att vi inte vet om behandlingen är effektiv.
Frågan om antikoagulantia vid apparatdetekterad förmakstakykardi måste även ses i en bredare kontext, nämligen behandling av kliniskt förmaksflimmer med antikoagulantia. Där finns tvärtom en tydlig evidens för att antikoagulantia effektivt reducerar risken för stroke. Ändå råder underbehandling, vilket har diskuterats [5, 37]. En risk finns att premisser från denna patientgrupp omedvetet överförs till handläggningen av pacemaker- och ICD-patienter med förmakstakykardi.
En grupp där en mer frikostig behandling med antikoagulantia vid förmakstakykardi skulle kunna övervägas är patienter med tidigare ischemisk stroke eller patienter med ett flertal riskfaktorer. EHRA har öppnat för att erbjuda dessa grupper behandling med antikoagulantia även vid kortare arytmiduration.
Potentiella bindningar eller jävsförhållanden: Peter Magnusson har erhållit föreläsararvoden från Abbott, Alnylam, Boehringer Ingelheim, Medtronic, Novo Nordisk och Pfizer. Måns Almqvist har erhållit föreläsararvoden från Pfizer och Bristol-Myers Squibb.
Fakta 1. Definitioner
AHRE (atrial high rate episodes) definieras som episoder med förmakstakykardi >190 slag/minut detekterade med kardiell elektrisk apparat (pacemaker eller intern defibrillator).
SCAF (subclinical atrial fibrillation) definieras som förmaksflimmer med duration >6 minuter och <24 timmar detekterad med kardiell elektrisk apparat hos patient utan symtom och utan tidigare diagnos kliniskt förmaksflimmer detekterat med EKG eller Holter-EKG [6].
Ofta används AHRE och SCAF i synonym bemärkelse. Förekomst av förmakstakykardi bedöms ofta utifrån pacemakerns algoritm för s k mode-switch (inaktivering av fömaksavkänning och förmaksstimulering vid förmakstakykardi), vilken kräver ett antal konsekutiva slag och är validerad för god specificitet för förmaksarytmi [21-23]. Det är brukligt att i studier bortse från förmakstakykardi <5 minuter för att undvika registrering av störningar, extraslag eller överavkänning (oversensing) [8, 19].



















